白腐真菌转化黄芩苷生成黄芩素的研究
杨 希,刘伶文,王璐倩,陈飞宇,沈苗苗,蒲峻毅
(西安工程大学 环境与化学工程学院,陕西 西安710048)
黄芩是历史悠久的传统中药,属唇形科.黄芩中具有明显药理作用的是黄芩苷(含量大于10%)和黄芩素(约1%)[1],具有抗菌、抗炎、抗肿瘤等作用[2].药物代谢研究[3]发现,黄芩苷在肠道内难以被直接吸收,转化为黄芩素才能被血液吸收而发挥作用.同时,大量临床药效试验[3]证明,黄芩素的药理作用强于黄芩苷.
黄芩苷分子中含有葡萄糖醛酸键,水解难度大.化学水解法能耗高,污染大,收率低.Morimoto S[4]等从黄芩的愈伤组织中分离出内源转化酶,最佳反应pH为7.0~8.0;李建华等[5]研究发现水温50℃浸泡处理时,黄芩内源酶降解黄芩苷的活性最强,但是对黄芩进行炮制处理后,黄芩内源转化酶被灭活,无法实现转化;贺美等[6]采用米曲霉活化法,转化黄芩苷为黄芩素,转化率达到40.72%;陈斌[7]利用蓝藻体系转化黄芩苷制备黄芩素,为制备黄芩素寻找到一个新的途径;刘伶文等[8]采用人体肠道菌转化黄芩苷制备黄芩素.目前,微生物发酵技术,反应温和,无污染,转化率较高,选用微生物进行培养诱导转化黄芩苷制备黄芩素,是制备黄芩素的一个新方向.由于白腐真菌能分泌多种酶,且嗜酸真菌还能产生多种糖苷酶[9],因此本实验采用白腐真菌对黄芩苷进行转化,期望得到黄芩苷转化为黄芩素的一个生物模型.
1 实 验
1.1 材料
黄芩苷(西安小草植物科技有限公司),黄芩素标准品(98%陕西省食品药品检验所),白腐真菌(中科院成都生物研究所),市售新鲜马铃薯,葡萄糖,甲醇(95%,色谱纯),聚酰胺薄膜展层(10cm×10cm).
1.2 仪器
分析用高效液相色谱仪(Agilent Technologies-1200series),C18色谱柱(250mm×4.6mm),HZQ-F160恒温振荡培养箱(杭州汇尔仪器),超净工作台,高速离心机(Eppendorf Centrifuge 5810R),SK5200LH超声波仪(上海科导超声仪器有限公司),752N紫外可见分光光度仪(上海精科实业有限公司).
1.3 培养基的配制
采用马铃薯葡萄糖培养基[10].新鲜土豆洗净去皮,切成小块,称取200g,加蒸馏水煮烂,用4层纱布过滤,加入葡萄糖20g,继续加热,搅拌混匀,得1 000mL马铃薯葡萄糖培养基.0.1MPa,110℃条件下灭菌20min,自然冷却.
1.4 白腐真菌转化黄芩苷模型的建立
1.4.1 生长细胞转化法 为了探索底物黄芩苷的存在是否可以诱导白腐真菌产生相应的转化酶,设计以下实验:准确称取黄芩苷1.0g加入到经灭菌的马铃薯葡萄糖培养基中,选取长势均匀良好的白腐真菌平板培养基,使用直径10mm的打孔器在无菌条件下接入5片直径为10mm的白腐真菌菌饼,放入恒温振荡培养箱37℃条件下培养80h[11].
1.4.2 静态细胞转化法 按照1.4.1中的接种方法,无菌条件下向已灭菌的马铃薯葡萄糖培养基中接入5片直径为10mm的白腐真菌菌饼,待菌株活化后,高速冷冻离心收集菌体,洗涤后将菌体悬浮于磷酸缓冲液中,再加入1.0g黄芩苷进行生物转化,培养时间为80h.
1.4.3 破壁处理 培养完成后,进行超声波破壁处理,频率为40kHz,时间为20min.
1.4.4 白腐真菌转化黄芩苷转化模型对照实验 实验方法设计如表1所示.
1.5 转化后检测
1.5.1 TLC法快速检测黄芩素 以黄芩素标准品为对照,取实验样品在聚酰胺薄膜展层上进行定性分析.
聚酰胺薄膜展层剂:95%乙醇∶36%乙酸=2∶1(体积比),显色剂:2%FeCl3乙醇溶液[12].
1.5.2 HPLC检测 精确称取黄芩素标准品0.02g,溶解于1mL甲醇,配成标准品溶液,待测.将以上各组培养液分别于10 000r/min下离心10min,取上清液浓缩,然后用甲醇定容到30mL,再次离心后取上清液待检测.色谱条件:流动相∶甲醇∶水∶磷酸=65∶35∶0.2(体积比),流速:1mL/min,检测波长275nm,进样量10μL[13].

表1 实验方法设计Table 1 Design of experimental method
1.6 生长细胞转化法培养条件的优化
对选定的转化模型中微生物培养条件进行优化,以期获得对黄芩苷的最大转化效率,选用生长细胞转化法进行实验.
1.6.1 最佳转化时间的确定 固定菌液量为1mL,黄芩苷量为1.0g,分别在0,12,24,36,48,60,72,84,96,108,120,132,144h条件下发酵培养,培养温度37℃.培养完成后离心取上清液.采用吸光光度法在波长275nm下测定其吸光度值,以确定黄芩苷的最佳转化效率时间.
1.6.2 最佳接种量的确定 固定黄芩苷量为1.0g,培养时间为80h.选取长势均匀良好的白腐真菌平板培养基,使用直径为10mm的打孔器进行接种.分别接入1,2,3,4,5片菌饼进行发酵培养,培养温度37℃.培养完成后离心取上清液.采用吸光光度法在波长275nm下测定其吸光度值,以此来确定一定量黄芩苷所需的最佳接种量.
1.6.3 最佳pH的确定 白腐真菌适应于微酸性环境,分别设置培养基pH为3.5,4.5,5.5,6.5.固定黄芩苷的量为1g,依据1.6.1和1.6.2所确定的最佳时间和接种量进行转化培养.培养完成后离心取上清液.采用吸光光度法在波长275nm下测定其吸光度值,以此来确定发酵培养基的最佳pH.
2 结果与讨论
2.1 白腐真菌转化黄芩苷的模型
2.1.1 TLC法检测结果 按照1.4.4实验设计,用TLC法快速检测黄芩素,实验结果如图1所示.
由图1可见,B组实验液在黄芩素标准品对应位置具有明显斑点,A组出现微弱斑点,且颜色一致,为药典描述的棕黑色,C组在相应位置也出现明显斑点,但颜色为墨绿色,不符合药典描述,即C组产物并非纯品黄芩素.由此可初步确定白腐真菌能够将黄芩苷转化为目标产物黄芩素.
2.1.2 HPLC检测结果 按照1.4.4实验设计,采用HPLC对转化产物进行分析.各组实验的液相色谱图如图2所示.黄芩素标准品的保留时间约为7.304min.

图1 转化液TLC图谱Fig.1 Result of TLC analysis
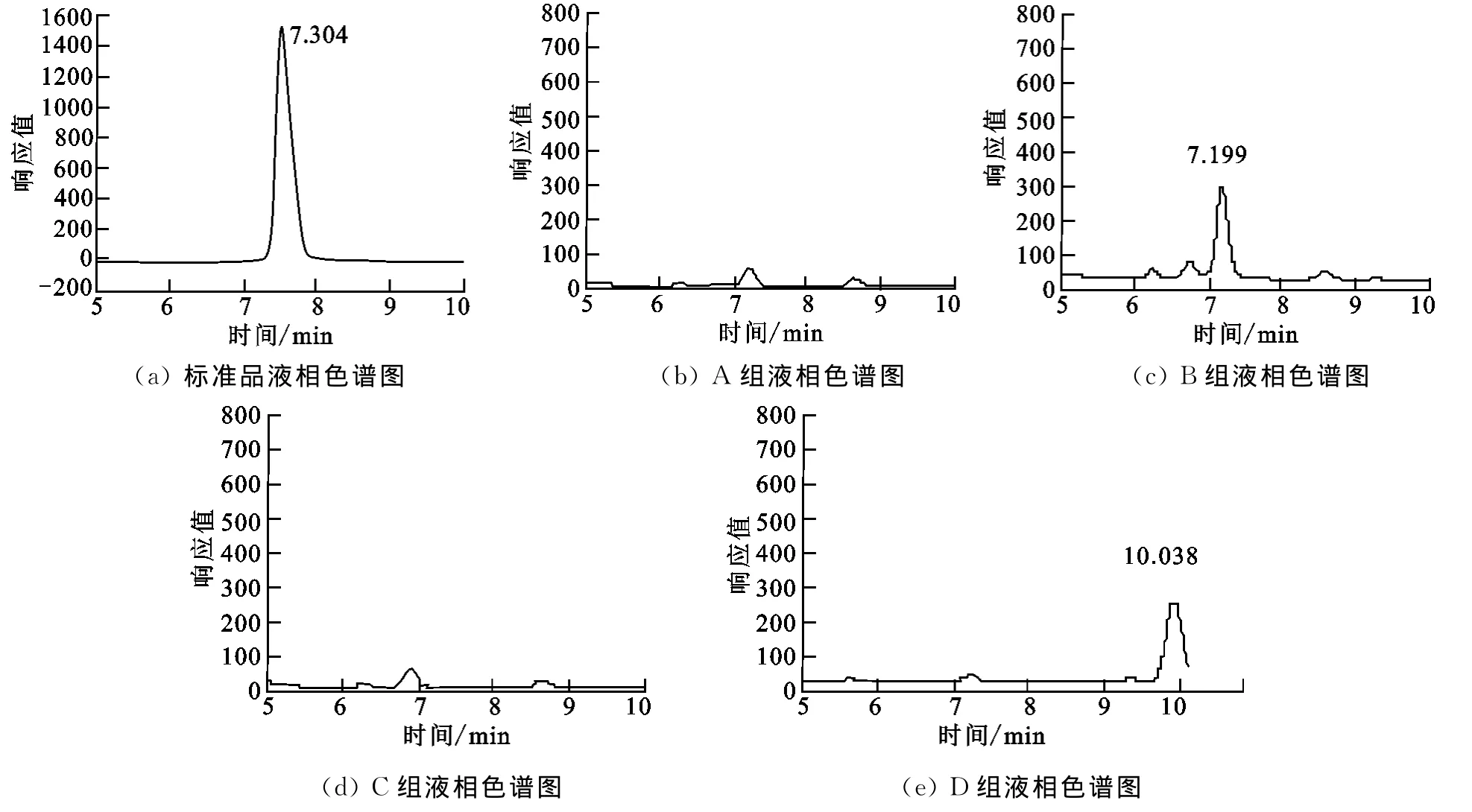
图2 各组液相色谱图Fig.2 Result of HPLC analysis of each group
A组实验采用的是生长细胞转化法,但是未经过超声波处理,在相应保留时间内只检测到极其微量的黄芩素.生长细胞转化法直接将黄芩苷加入转化培养基中,在白腐真菌自身生长繁殖的同时进行转化,由于培养基为白腐真菌生长提供了充足的营养物质,因此其在黄芩苷的诱导下可以产生新的酶.由于未经过超声波破壁处理,相应的胞内酶没有完全释放出来,因此无法收获大量的黄芩素.
B组实验采用生长细胞转化法,经过超声波破壁,在7.199min处检测到黄芩素,说明白腐真菌经生长细胞转化法可以转化黄芩苷,且经超声波破壁后得到黄芩素.按照细胞生长转化法,黄芩苷被加入到转化培养基中可能产生相应的酶,参照A组实验结果,该酶应为胞内酶.
C组、D组实验均采用静态细胞转化法,培养基中没有黄芩苷,即使经超声波处理也不能得到黄芩素.说明静态细胞转化法不能为白腐真菌提供充分的营养物质,也没有诱导其产生相应的酶,因此未能将黄芩苷转化为黄芩素.
综上所述及2.1.1结果,可确定生长细胞转化法配合超声波破壁可转化黄芩苷为黄芩素.
2.2 生长细胞转化法培养条件优化结果
在以上确定的转化模型基础上,探讨培养条件.不同培养条件对转化效率的影响如图3所示.由图3(a)可知,0~96h黄芩素含量不断增加,在96h达到峰值,此后趋于平衡.白腐真菌在0~96h之间经历了适应期、对数期和稳定期,菌丝体逐渐生长累积,产酶量增加,黄芩素的产量也逐渐增加.此后到达衰亡期,菌丝体开始凋亡,转化过程基本停滞,黄芩素产量趋于平衡.因此可选择96h作为白腐真菌转化黄芩苷为黄芩素的最佳转化时间.
由图3(b)可知,接种量在1~4片之间时黄芩素含量不断增加,此后趋于平衡且伴有下降趋势.接种量在1~4片之间时随着接种量增加,产酶量增加,黄芩素产量随之增加,当达到5片时,由于培养基已不能提供充足的营养物质,菌丝体生长受到影响,产酶量下降,黄芩素产量趋于平衡且伴有轻微下降趋势.因此可确定当料液比为1∶100时所需菌的最佳量为4片直径为10mm的菌饼.
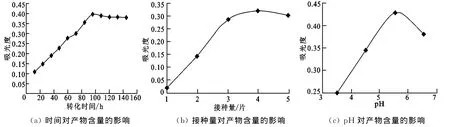
图3 培养条件对转化效率的影响Fig.3 The influence of culture conditions on the conversion efficiency
由图3(c)可知,pH在3.5~5.5之间时黄芩素的含量不断增加,大于5.5以后开始下降.白腐真菌的适宜生长环境是酸性环境,在pH 3.5~5.5之间时,菌丝体生长良好,产酶量增加,黄芩素产量也逐渐增加,当pH大于5.5以后,菌丝体的生长代谢受到影响,产酶量下降,黄芩素产量随之下降.因此可确定白腐真菌转化黄芩苷生成黄芩素的的最佳pH为5.5.
3 结 论
(1)生长细胞转化法可以诱导菌种表达特定的代谢酶,易于生物转化.而静态细胞的转化过程中没有足够的营养物质及底物的刺激,一般只表达组成性酶,不会产生诱导性酶.此外,破壁后才检测到大量黄芩素.由此推论在转化中起作用的酶应属于诱导酶、胞内酶.
(2)通过单因素实验探究,得知最佳温孵时间为96h,最佳pH为5.5,料液比为1∶100时所需菌的最佳量为4片直径为10mm的菌饼.
[1] 梁英,韩鲁佳.黄芩中黄酮类化合物药理学作用研究进展[J].中国农业大学学报,2003,8(6):9-14.LIANG ying,Han Lujia.Flavonoids in raix scutellariae pharmacological research progress[J].Journal of China Agricultural University,2003,8(6):9-14.
[2] MORTIA M,TAKAHASHI I,KANAI M.Baicalein 5,6,7-trimethyL-ether,a flavonoid derivative,stimulates fatty acid beta-oxidation in skin fibroblasts of X-linked adrenoleukodystrophy[J].FEBS Lett,2005,579(2):409-414.
[3] MUTO R,MOTOZUKA T,NAKANO M,et al.The chemical structure of new substance as the metabolite of baicalin and time profiles for the plasma concentration after oral administration of sho-sai-ko-to in human[J].Yakugaku Zasshi,1998,118(3):79.
[4] SATOSHI Morimoto,TAKAHIRO Harioka,YUKIHIRO Shoyama.Purification and characterization of flavone-specificβ-glucuronidase from callus cultures of scutellaria aicalensis Georgi[J].Planta,1995,195(4):535-540.
[5] 李建华,王力生,邹节明.水提工艺中黄芩内源酶降解黄芩苷的研究[J].中草药,2009,40(3):397-400.LI Jianhua,WANG Lisheng,ZHOU Jieming.Research of radix scutellariae endogenous enzyme degradation of baicalin in water extraction process[J].Chinese Herbal Medicines,2009,40(3):397-400.
[6] 贺美,邱德全,柏仕杰.米曲霉两步活化法对黄芩苷的生物转化及转化产物的纯化与鉴定[J].广东海洋大学学报,2007,27(6):41-44.HE Mei,QIU Dequan,BAI Shijie.Biotransformation of baicalin by Aspergillus oryzae and purification and characterization of product[J].Journal of Guangdong Ocean University,2007,27(6):41-44.
[7] 陈斌.蓝藻对黄芩苷生物转化研究初探[D].北京:北京中医药大学,2009:12-16.CHEN Bin.Transformation of bacicalin by cyanobacteria[D].Beijing:Beijing University of Chinese Medicine,2009:12-16.
[8] 刘伶文,司磊,任树勇,等.人肠道菌对黄芩苷的生物转化[J].天然产物研究与开发,2012,24(10):1437-1440.LIU Lingwen,SI Lei,REN Shuyong,et al.Biotransformation of bacicalin by human intestinal bacteria[J].Nat Prod Res Dev,2012,24(10):1437-1440.
[9] 罗会颖.极端嗜酸真菌Bispora+spMEY1胞外糖苷水解酶类的产酶分析及其相关基因的克隆与表达[D].北京:中国农业科学院,2008:7-9.LUO Huiying.Analysis of extracellular glycoside hydrolase of Bispora+spMEY1and clone of related gene[D].Beijing:Chinese Academy of Agricultural Sciences,2008:7-9.
[10] 沈萍,范秀容,李广武,等.微生物学实验[M].北京:高等教育出版社,1980:30-32.SHENG Ping,Fan Xiurong,Li Guangwu,et al.Microbiology experiment[M].Beijing:Higher Education Press,1980:30-32.
[11] 高大文,文湘华,钱易.白腐真菌培养条件对其分泌木质素降解酶的影响[J].中国环境科学,2005,25(5):572-575.GAO Dawen,WEN Xianghua,QIAN Yi.Influence of white-rot fungi culture condition on lignin-degrading enzyme[J].China Environmental Science,2005,25(5):573-575.
[12] 汪红,高陪,廖勇,等.微生物发酵转化黄芩苷生成黄芩素的研究[J].四川大学学报:自然科学版,2009,46(3):795-798.WANG Hong,GAO Pei,LIAO Yong,et al.Reseach of microbial fermentation baicalin to baicalein[J].Journal of Sichuan University,2009,46(3):795-798.
[13] 聂鑫,罗佳波,吕本强,等.高效液相色谱法定量分析黄芩苷粗品中4种黄酮类成分[J].中国医院药学杂志,2007,27(2):191-193.NIE Xin,LUO Jiabo,LV Benqiang,et al.HPLC quantitative analysis of four flavonoids in crude baicalin[J].Chin Hosp Pharm,2007,27:191-193.

