TEBAB应用于诺氟沙星氯乙基化衍生物的合成研究
王 曼, 夏亚熙, 李阳晶, 孟戎茜
(太原工业学院化学与化工系,山西 太原 030008)
引 言
诺氟沙星又名氟哌酸,是一种合成抗菌药物,它具有抗菌谱广 、活性强、毒性低、与多数抗菌药物无交叉耐药性且人工合成容易的特点。但是,其生物利用度小、血药浓度低(诺氟沙星口服400mg生物利用度为35%~45%),影响其体内疗效[1]。诺氟沙星在体内比较稳定,很少被代谢。影响其抗菌活性的主要因素是口服吸收度,而解决这一问题的关键是适当提高其脂溶性[2]。诺氟沙星哌嗪环N-4’位引入脂溶性的氯乙基,期望赋予喹诺酮药物某些新的性质,得到抗菌谱更广、抗菌作用更强、毒素作用更小的未见报道的药物。实验中,通过加入相转移催化剂使反应时间缩短,反应条件温和,操作简便,抑制副反应,从而提高收率[3]。利用单因素实验法和正交分析实验法确定反应的最佳条件。所得产品通过与诺氟沙星原料药对比熔点及红外光谱图来验证是否为目标产物。该合成主要反应机理如图1。

图1 诺氟沙星衍生物合成机理
1 实验部分
1.1 仪器与试剂
Spectrum型傅立叶变换红外光谱仪,Perkin-Elmer公司,光谱范围 4 000cm-1~650cm-1;SZCL-4B智能磁力加热搅拌器,巩义市予华仪器有限责任公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司。
氟哌酸,河南康缘药业,化学纯;1,2-二氯乙烷,山西双鹤药业,分析纯;DMF,西陇药业,化学纯;氢氧化钠,山西双鹤药业,化学纯;盐酸,10%;乙酸乙酯,天津市申泰化学试剂有限公司,分析纯;TE-BAB,自制。
1.2 诺氟沙星N-4′位氯乙基化衍生物的合成
实验中,影响产品收率的主要因素有反应时间、反应温度、物料比、催化剂量、溶液浓度等。先用单因素实验法确定每种因素的最优条件,再用正交法验证,结合各因素最佳水平确定最佳工艺路线[4]。
以诺氟沙星(取1.6g即0.005mol)、1,2-二氯乙烷为原料,DMF作溶剂(取20mL),NaOH溶液作缚酸剂(20mL),乙酸乙酯作萃取剂(30mL),四丁基溴化铵作单因素法催化剂。反应完毕,用10%盐酸调节溶液pH到7,冷却后溶液分层。取下层沉淀部分,加入30mL乙酸乙酯萃取。静置一段时间后抽滤,并用5mL~10mL去离子水水洗。最后,干燥,称量。最佳反应工艺条件下加入新型相转移催化剂三乙基丁基溴化铵(TEBAB)进行合成实验,对所得产品进行熔点测定及红外光谱表征。
1.3 体内抗菌活性测试
将样品与吐温-80研磨成悬浮液,雌性小鼠(体重18g~20g),感染致死量的大肠杆菌-1515后1h,一次灌胃给药,观察7d内的生存率,用Reed氏法计算半数有效剂量(ED50)。
2 结果与讨论
2.1 正交实验
正交实验采用3因素3水平实验,如表1所示,实验结果见表2。

表1 正交法实验因素及水平

表2 正交实验结果
通过对每组均值1、2、3的比较,可以确定最佳物料摩尔比为1.0∶1.4,最佳反应温度为70℃,最佳反应时间为4h,最佳TEBAB量为0.2g。
通过对极差的比较,可以得出各因素对反应影响的大小:反应温度>TEBAB量>物料比>反应时间。
通过正交实验和对正交表的分析,初步得出该合成反应的条件。通过单因素实验确定出最佳实验条件,即,固定其中任意2个因素,改变另一因素来得出此因素的最佳值。通过3个单因素实验分别确定出反应温度、反应时间、原料配比3个因素的最佳值,即为该合成反应的最佳工艺条件。
2.2 单因素实验(见表3)
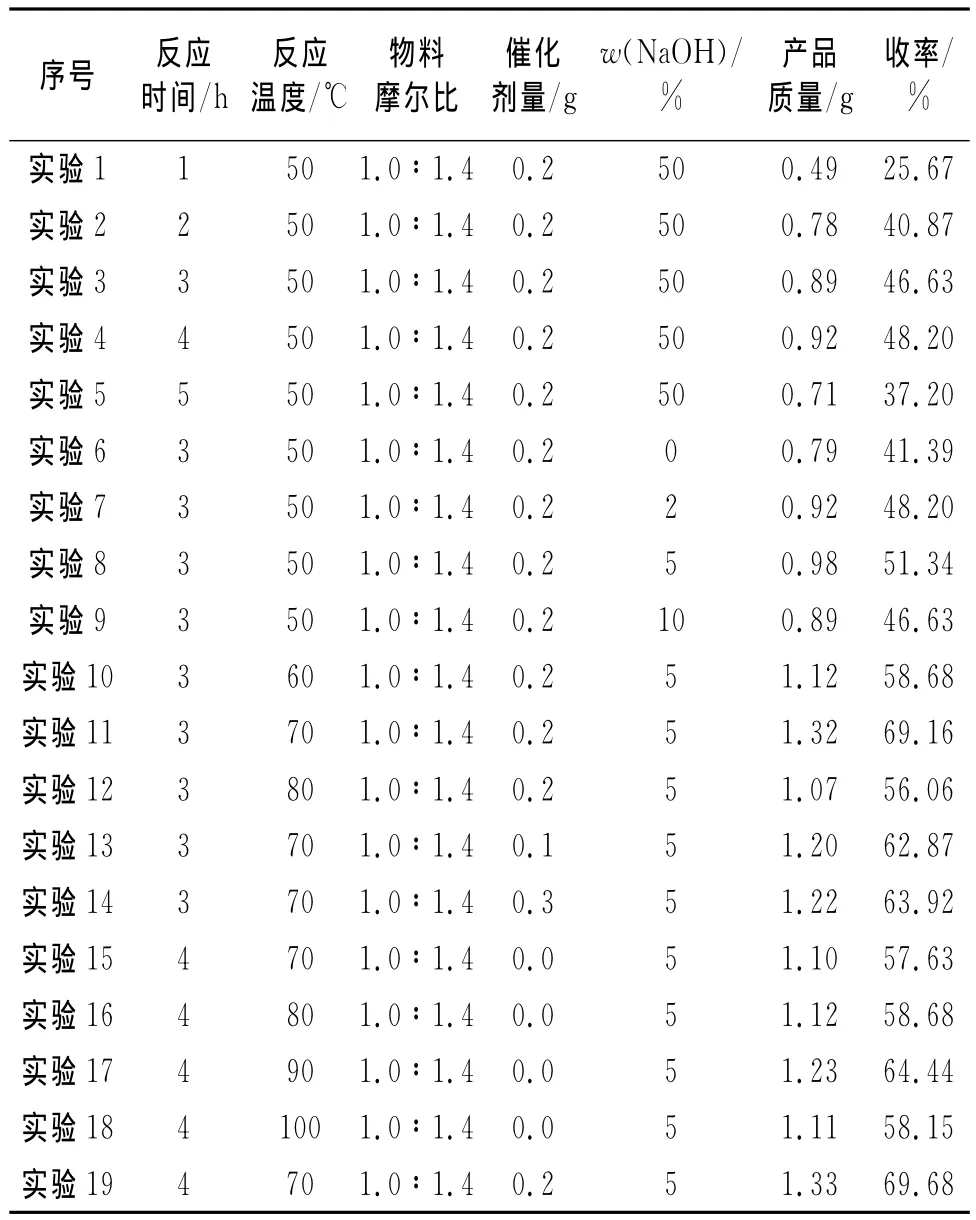
表3 单因素法实验条件及结果
2.2.1 反应时间与产率关系
用实验1、2、3、4、5结果绘图出如图2结果。

图2 反应时间与产率关系图
由图2可知,曲线先升后降;随着反应时间的增加,收率也随之升高,在3h~4h处出现最大值;大于4h后,收率有所下降。在一定范围,反应时间越长,反应就越充分;超过4h,开始有副产物生成,收率下降。将实验19与实验11结果比较可知,其他条件相同时,反应4h产率大于反应3h的产率。所以,正交实验反应温度选取3、4、5h3个水平。
2.2.2 NaOH质量分数与产率关系
用实验6、7、8、9的结果绘图,如图3。

图3 NaOH溶液浓度与产率关系图
图3曲线先升后降,在5%左右有最大值。由于NaOH在反应中作缚酸剂,反应结束后还要调节溶液pH至7,所以NaOH质量分数不宜过大;但反应需在碱性条件下进行,故NaOH质量分数也不宜太低。因此,5%可作为最佳质量分数,正交实验不再对此进行讨论。
2.2.3 反应温度与产率关系
用实验8、10、11、12的结果绘图,如图4。

图4 反应温度与产率关系图
图4曲线先升后降,在70℃出现最大值。在一定范围内,温度越高,收率越大;70℃之后,收率开始下降。因为温度过高有利于1,2-二氯乙烷与NaOH反应生成乙二醇。所以,初步确定70℃为最佳温度。正交实验选取60、70、80℃3个水平,再进行验证。
2.2.4 催化剂量与产率关系
用实验11、13、14的结果绘图,如图5。
图5曲线先升后降,在0.2g左右处有最大值。由于很少量的催化剂就会对反应产生很大影响,所以曲线斜率较大。可初步认为0.2g催化剂为最佳量。正交实验选取0.1、0.2、0.3g 3个水平。

图5 催化剂量与产率关系图
2.2.5 无催化剂时温度与产率关系
实验15、16、17、18为不加催化剂条件下、反应温度分别为70、80、90、100℃的实验,结果如图6。

图6 无催化剂条件下温度与产率关系图
图6曲线先升后降,80℃~100℃时曲线斜率较大,说明不加催化剂的条件下,温度变化对反应的影响大;而且在90℃左右有最大值,可知不加催化剂时90℃为最佳反应温度。70℃时不加催化剂的产率明显比加入催化剂时的产率低,可以判断相转移催化剂能缩短反应时间、降低反应温度、提高收率。
2.3 相转移催化剂TEBAB的应用[4]
本课题在最佳实验条件下,即当反应温度为70℃、n(诺氟沙星)∶n(对氨基苯磺酰氯)=1.0∶1.4、反应时间为4h时,加入不同种类的催化剂,比较四丁基溴化铵(分析纯)和TEBAB(自制)的催化效果。实验结果如表4所示。

表4 四丁基溴化铵和TEBAB的催化效果
比较表4中实验数据可知,加入催化剂可以使合成反应产率得到很大的提高,而自制的相转移催化剂TEBAB的催化效果比四丁基溴化铵的催化效果好。
2.4 产品表征
2.4.1 熔点(见表5)

表5 样品熔点
诺氟沙星熔点在218℃~224℃,样品初熔温度与诺氟沙星大致相同,终熔温度高于诺氟沙星7℃左右,说明样品中有未反应的诺氟沙星原料,有新物质生成可能是诺氟沙星N-4′位氯乙基化衍生物。
2.4.2 红外光谱[5]
图7与图8是诺氟沙星与产品的红外光谱图。

图7 诺氟沙星红外光谱图

图8 样品红外光谱图
752、805、887、949、1 103、1 149、1 199、1 251、1 375、1 441、1 476、1 521、1 616、1 727、2 502、2 830、2 946、2 970、3 343cm-1处出现中强特征吸收峰。
诺氟沙星红外光谱:752cm-1处出现乙基中亚甲基C—H面外弯曲振动;805cm-1处出现哌嗪环中亚甲基C—H面外弯曲振动;887cm-1处出现酸羧基中另一种形式C—O化学键面内弯曲振动;949cm-1处出现酸羧基O—H化学键面外弯曲振动;1 103、1 149cm-1处出现C—F化学键对称伸缩振动和不对称伸缩振动;1 199cm-1处出现杂环中C—N的伸缩振动;1 251cm-1为O—H的面内弯曲振动;1 375cm-1处出现甲基面内对称弯曲振动;1 441cm-1处出现乙基中亚甲基的C—H面内弯曲振动;1 476cm-1处出现甲基的面内不对称弯曲振动;1 521cm-1处出现苯环骨架═C C伸缩振动;1 616cm-1处出现4位酮═C O的伸缩振动;1 727cm-1处出现酸羧基═C O伸缩振动[5];2 502cm-1为—COOH 基 O—H 伸缩振动;2 830、2 946cm-1为乙基中亚甲基的C—H对称伸缩振动和不对称伸缩振动;2 970cm-1为甲基C—H伸缩振动;3 343cm-1为哌嗪环上N—H的伸缩振动。
判断是否生成诺氟沙星N-4′位氯乙基化衍生物,根据如下:
1)3 350cm-1~3 310cm-1处哌嗪环上 N—H的伸缩振动消失。
2)2 950cm-1~2 820cm-1处产生新的乙基中亚甲基的C—H面内弯曲振动。
3)750cm-1~700cm-1处出现C—Cl的伸缩振动。
由图8可知,3 343cm-1为哌嗪环上N—H的伸缩振动未消失;2 838cm-1处产生新的乙基中亚甲基的C—H面内弯曲振动;735cm-1处出现C—Cl的伸缩振动。可判断样品中有诺氟沙星N-4′位氯乙基化衍生物,但诺氟沙星原料未反应完全。
2.5 活性测试
对所合成的目标化合物进行体内抗菌活性实验,用t检验进行了统计学处理,其结果见表6。

表6 In vivo antibacterial activities of the title compounds
从表6可以看出,目标化合物的抗菌活性大于诺氟沙星,这可能是脂溶性取代基的引入增强了对于细菌细胞壁的穿透力,结构的改变也引起了药代动力学性质的改变。本文只测定了对于大肠杆菌-1515的ED50,至于其他菌株的体内抗菌活性还需进一步研究。
3 结论
通过产品熔点的测定以及对红外谱图的分析可知,本次设计成功合成了诺氟沙星N-4′位氯乙基化衍生物。通过对实验数据的分析得出最佳条件:物料摩尔比1.0∶1.4;反应时间4h;反应温度70℃;相转移催化剂TEBAB量0.2g;NaOH溶液质量分数5%。各因素对反应影响强弱从大到小顺序依次为:反应温度>TEBAB量>物料比>反应时间。
新型相转移催化剂TEBAB具有良好的催化活性,可以降低反应温度,缩短反应时间,提高产品收率。实验过程中发现其具有很强的吸湿性,所以保存时注意严格密封。
[1] 李文平,李志万.喹诺酮类药物的发展概况[J].中国兽药杂志,2002,36(9):37-39.
[2] 马建中.第三代喹诺酮类药物的临床应用与发展前景[J].怀化医学专报,2002,1(1):71-73.
[3] 李海滨,林美清.诺氟沙星的临床药理[J].云南民族学院学报,1997,6(1):73-75.
[4] 李建章,李慈.相转移催化反应及其在有机合成中的应用[J].自贡师范高等专科学校学报,1999,2(14):64-66.
[5] 杨志军.红外光谱定量比较分析法及其应用[J].矿产与地质,2003,3(17):256-257.

