杜仲MEP途径系列基因表达差异的研究
刘慧敏,乌云塔娜,王 淋,许靖诗, 叶生晶
(1. 中南林业科技大学 a. 经济林培育与保护省部共建教育部重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州450003)
杜仲MEP途径系列基因表达差异的研究
刘慧敏1a,1b,乌云塔娜2,王 淋1a,1b,许靖诗1a,1b, 叶生晶1a,1b
(1. 中南林业科技大学 a. 经济林培育与保护省部共建教育部重点实验室;b.林学院,湖南 长沙 410004;2.中国林业科学研究院 经济林研究开发中心,河南 郑州450003)
以杜仲果实和叶片转录组为基础,研究了MEP途径系列基因的表达差异,为杜仲基因的克隆、功能鉴定及重要成分的分子积累机理研究提供重要的依据。结果表明,杜仲转录组中共42条Unigene 被MEP途径注释。DXS的DXS2和DXS3在幼果和叶片中表达量具有显著差异,且DXS2在幼果和叶片中的表达量最高;该酶在幼果和成熟果实中有7条Unigene被注释,其中DXS6在成熟果实中特异表达,的表达量具有显著差异。DXR在幼果和叶片中有4条Unigene被注释,其中DXR1、DXR2、DXR3的表达量具有显著差异;该酶在幼果和成熟果实中有3条Unigene被注释,其中DXR3在成熟果实中特异表达,3条Unigene的表达量均无显著差异,DXR1在幼果和成熟果实中表达量均最高。MCT在幼果和叶片中仅1条被注释,表达量差异显著;该酶在幼果和成熟果实中仅1条被注释,其表达量无显著差异。CMK在幼果和叶片中仅CMK1被注释,且表达量无显著差异;该酶在幼和成熟果实中仅CMK1被注释,且表达量无显著差异。MDS在幼果和叶片中仅MDS1被注释,其表达量差异显著;该酶在幼果和成熟果实中有2条Unigene被注释,且表达量无显著差异。HDS在幼果和叶片中仅HDS1被注释,表达量具有显著差异;该酶在幼果和成熟果实中仅HDS1被注释,表达量有显著差异。HDR在幼果和叶片中有5条Unigene被注释,其中HDR1和HDR5的表达量具有显著差异;该酶在幼果和成熟果实中有7条Unigene被注释,其中HDR3、HDR4、HDR5、HDR6的表达量有显著差异。IPI在幼果和叶片中仅IPI1被注释,其表达量无显著差异;该酶在幼果和成熟果实中有2条Unigene被注释,其中IPI1的表达量有显著差异。
杜仲,幼果,叶片,成熟果实,基因表达量分析
杜仲Eucommia ulmoides为杜仲科杜仲属多年生落叶乔木,杜仲科仅1属1种,中国是现存杜仲的唯一原产地[1-2],有学者在北美发现了杜仲的化石[3],来自美国、加拿大和墨西哥的杜仲的25个生长地的植物残骸表明该物种曾经在新生代广泛分布与北美的各个地方。杜仲是中国特有的名贵经济树种,也是世界适应范围最广的重要胶源植物[4]。杜仲以干燥的根皮入药,具有补肝肾、强筋骨、降血压、安胎等诸多功效,用于治疗肾虚腰疼、筋骨无力、妊娠漏血、胎动不安等多种疾病[5]。Jin Nyoung HO[6]等人于2005年的研究了从杜仲中提取的桃叶珊瑚苷在紫外线-B(UVB)诱导的人类成纤维细胞的氧化应激反应中所起到的保护作用,研究发现经过UVB的照射后,用桃叶珊瑚苷预处理的人体皮肤成纤维细胞(Hs68株系),能够明显抑制57%的基质金属蛋白酶-1(MMP-1)的产生。杜仲胶是世界极具发展潜力的优质天然橡胶资源,Shinya Takeno[7]等人于2008年利用傅里叶变换红外光谱和裂解气象色谱/质谱来定量分析了杜仲中的反式-1,4-聚异戊二烯,并成功地将提取/定量的方法应用于研究杜仲橡胶含量和分子量的季节性变化,FT-IR分析表明叶子中的杜仲胶随着季节的变化是逐渐积累的过程,从SEC分析得到的数据看来随着季节变化低分子量的橡胶(Mn=6.0×103)所占的比重呈增加趋势。Nobuaki Suzuki[8]等人于2012年构建并分析了反式聚异戊二烯树种杜仲EST文库,该研究构建了一个杜仲茎外周组织与内周组织的cDNA文库,包含27752个表达序列标签(ESTs),组装成10520个分别由4302个重叠群和6218个单序列组成的Unigene,分离出与胶乳高分子量聚异戊二烯合成相关的橡胶颗粒膜蛋白同源基因以及一些重要的橡胶蛋白编码基因(MLPs),为杜仲胶生物合成的深入研究奠定了基础。李铁柱等于2012年研究了杜仲果实和叶片[9]以及幼果和成熟果实[10]转录组数据组装及基因功能注释。
植物的MEP途径是丙酮酸和3-磷酸甘油醛在1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)的催化下生成1-脱氧-D-木酮糖-5-磷酸(DXP),DXP经1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)的作用发生分子重排并进行氧化还原反应生成MEP,MEP再经过2-甲基-D-赤藓醇-4-磷酸胞苷酰转移酶(MCT)的作用生成4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇(CDP-ME),接着经过4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶(CMK)的磷酸化后生成4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇-2-磷酸(CDPMEP),然后经过2-甲基-D-赤藓醇-2,4-环焦磷酸合酶(MDS)的作用生成2-甲基-D-赤藓醇-2,4-环焦磷酸(MEcPP),接着又在1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶(HDS)的作用下生成1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸(HMBPP),最后在1-羟基-2-甲基-2-E-丁烯酸-4-焦磷酸还原酶(HDR)催化下形成IPP。IPP不能离子化,经过异戊烯基焦磷酸异构酶(IPI)的作用,部分转化为双键异构体二甲基丙烯基焦磷酸(DMAPP),并处于一定的化学平衡状态。IPP和DMAPP这两个化合物被更广泛地认为是自然界中构建所有萜类化合物的基本单元[11]。随着大家对植物MEP途径研究的深入,人们越来越多的了解到多种植物的MEP途径的关键酶及调节因素。金蓉[12]等于2007年研究了1-脱氧木酮糖-5-磷酸合酶(DXS)及其编码基因,研究表明DXS是由一到多个基因编码,因生物种类而异,根据同源性,植物的DXS基因可分成两类。Adhikari Megha Nath[13]于2010年研究了阳春砂HMGR,DXS和DXR基因表达及功能分析,研究表明3个基因在根、茎、果皮和种子团中的表达量均高于叶片,DXS在根、茎、叶、果皮和种子团中均有高表达。2012年刘攀峰[14]对杜仲MEP途径系列基因全程cDNA分离鉴定及序列特征进行了详细研究,首次从杜仲叶片中分离和鉴定出MEP途径的系列酶基因,得到了4个限速酶基因和4个相关酶基因cDNA全长,确定了DXR等10个基因推导氨基酸序列的理化性质,一级结构和功能区域,并预测了这10个基因编码蛋白的二级结构特点,包括包括 α-螺旋、β-折叠和螺环结构的比值及结构类型,应用同源建模法预测了这10个基因的三级结构特点,包括亚单位组成、活性区、功能域等一系列结论,为深入研究各相关酶在杜仲萜类合成中所发挥的功能提供了一定参考。
1 材料与方法
1.1 植物材料
分别于杜仲幼果时期(5月28日),在国家林业局泡桐研究中心采集‘华仲6号’杜仲幼果和叶片,成熟果时期(同年10月28日),采集其成熟果实为材料。
1.2 杜仲幼果、叶片和成熟果实RNA的提取
幼果、叶片和成熟果实RNA的提取参照陈建的“几种提取杜仲RNA方法的比较”。
1.3 杜仲幼果、叶片和成熟果实的转录组测序
转录组的测序工作委托深圳华大基因完成。
1.4 杜仲幼果、叶片和成熟果实转录组数据组装及基因功能注释技术路线
本次研究对杜仲幼果、叶片和成熟果实合成调控时期的转录组进行测序,并对数据库中Unigene进行了全面分析和注释。具体流程图如图1所示。

图1 数字化转录组数据库的分析Fig. 1 Data analysis of digital transcriptome
2 结果与分析
在杜仲幼果、叶片和成熟果实转录组数据中共8个基因被KEGG数据库MEP合成途径注释,见图2,幼果和叶片中有19条Unigene被注释,幼果和成熟果实中有23条Unigene被注释。其中1-脱氧-D-木酮糖-5-磷酸合成酶DXS(1-deoxy-D-xylulose-5-phosphate synthase [EC:2.2.1.7])在幼果和叶片中注释Unigene10793等5条Unigene,在幼果和成熟果实中注释Unigene1097等7条Unigene;1-脱氧-D-木酮糖-5-磷酸还原异构酶DXR(1-deoxy-D-xylulose-5-phosphate reductoisomerase [EC:1.1.1.267])在幼果和叶片中注释了Unigene22043等4条Unigene,在幼果和成熟果实中注释了Unigene20455等3条Unigene;2-甲基-D-赤藓醇-4-磷酸胞苷酰转移 酶 MCT(2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase [EC:2.7.7.60])在幼果和叶片中仅注释了Unigene21890,在幼果和成熟果实中仅注释了Unigene21711;4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶CMK(4-diphosphocytidyl-2-C-methyl-D-erythritol kinase [EC:2.7.1.148])在幼果和叶片中仅注释了Unigene8371,在幼和成熟果实中仅注释了Unigene19234;2-甲基-D-赤藓醇-2,4-环焦磷酸合酶MDS(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase [EC:4.6.1.12])在幼果和叶片中仅注释了Unigene12126,在幼果和成熟果实中注释了Unigene19101等2条Unigene;1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶HDS((E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase [EC:1.17.7.1])在幼果和叶片中仅注释了Unigene447,在幼果和成熟果实中仅注释了Unigene20243;1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸还原酶HDR(4-hydroxy-3-methylbut-2-enyl diphosphate reductase [EC:1.17.1.2])在幼果和叶片中注释了Unigene21206等6条Unigene;异戊烯基焦磷酸异构酶IPI(isopentenyl-diphosphate delta-isomerase [EC:5.3.3.2])在幼果和叶片中仅注释了Unigene1194,在幼果和成熟果实中注释了Unigene18246等2条Unigene。
2.1 1-脱氧-D-木酮糖-5-磷酸合成酶(DXS)Unigene表达量分析
DXS在幼果和叶片中有5条Unigene被注释,分别是Unigene10793、13420、18207,、18209、41777,其中Unigene13420和Unigene18207的表达量具有显著差异(见表1);Unigene13420在幼果和叶片中表达量均最高(见表1和图2);以上5条Unigene在幼果中的表达量略高于叶片。

表1 DXS在杜仲幼果和叶片中的表达情况Table 1 Expression of DXS in leaves and young fruits
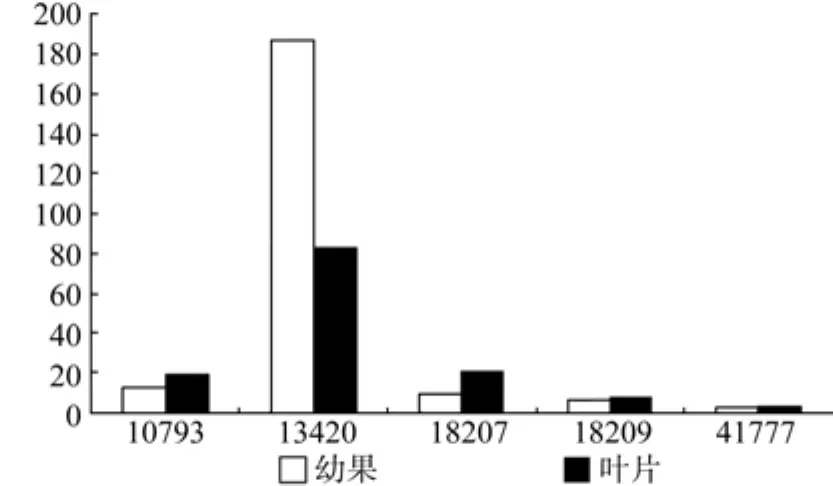
图2 DXS在幼果和叶片中的表达差异Fig.2 Expression of DXS in leaves and young fruits
DXS在幼果和成熟果实中有7条Unigene被注释,分别是Unigene1097、21343、21521、21659、21940、62288、6352,其中Unigene62288在成熟果实中特异表达,Unigene21343、21521、21940、6352的表达量具有显著差异(见表2);Unigene6352在幼果中表达量最高,Unigene21343在成熟果实中表达量最高(见表2和图3);以上7条Unigene在幼果中的表达量明显高于成熟果实。
2.2 1-脱氧-D-木酮糖-5-磷酸还原异构酶(DXR)表达量分析
DXR在幼果和叶片中有4条Unigene被注释,分别是 Unigene22043、27843、43251、9422, 其中Unigene22043、27843、43251的表达量具有显著差异(见表3);Unigene9422在幼果中表达量最高,Unigene22043在叶片中表达量最高(见表3和图4);以上4条Unigene在叶片中的表达量明显高于幼果。

表2 DXS在杜仲幼果和成熟果实中的表达情况Table 2 Expression of DXS in fruits and young fruits

图3 DXS在杜仲幼果和成熟果实中的表达差异Fig.3 Expression of DXS in fruits and young fruits
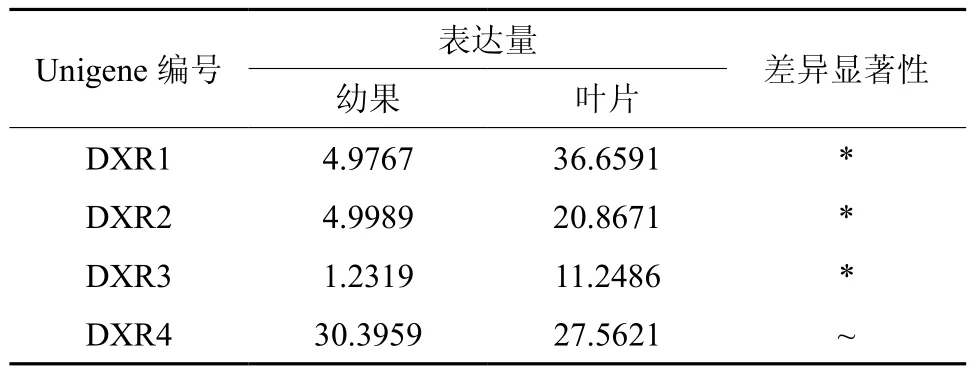
表3 DXR在杜仲幼果和叶片中的表达情况Table 3 Expression of DXR in leaves and young fruits

图4 DXR在杜仲幼果和叶片中的表达差异Fig.4 Expression of DXR in leaves and young fruits
DXR在幼果和成熟果实中有3条Unigene被注 释, 分 别 是 Unigene20455、20568、53879,其中Unigene53879在成熟果实中特异表达,3条Unigene的表达量均无显著差异(见表4);Unigene20455在幼果和成熟果实中表达量均最高(见表4和图5);以上3条Unigene在成熟果实中的表达量略高于幼果。
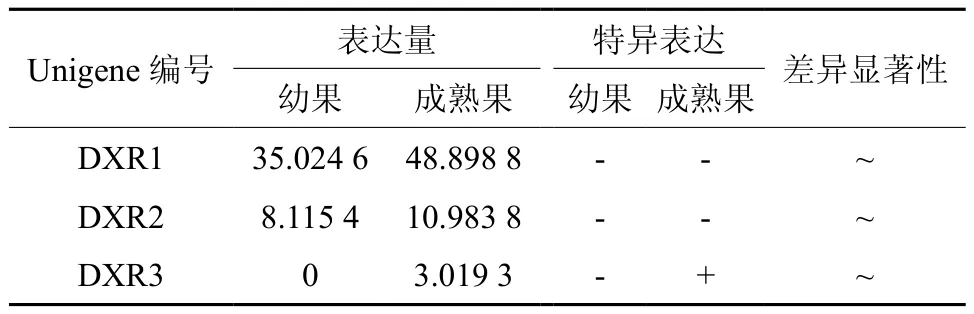
表4 DXR在杜仲幼果和成熟果实中的表达情况Table 4 Expression of DXR in fruits and young fruits

图5 DXR在杜仲幼果和成熟果实中的表达差异Fig.5 Expression of DXR in fruits and young fruits
2.3 2-甲基-D-赤藓醇-4-磷酸胞苷酰转移酶(MCT)表达分析
MCT在幼果和叶片中有1条Unigene被注释,为Unigene21890,均有表达,且表达量差异显著(见表5和图6)。

表5 MCT在杜仲幼果和叶片中的表达情况Table 5 Expression of MCT in leaves and young fruits

图6 MCT在杜仲幼果和叶片中的表达差异Fig.6 Expression of MCT in leaves and young fruits
MCT在幼果和成熟果实中有1条Unigene被注释,为Unigene21711,均有表达,且表达量无显著差异(见表6和图7)。
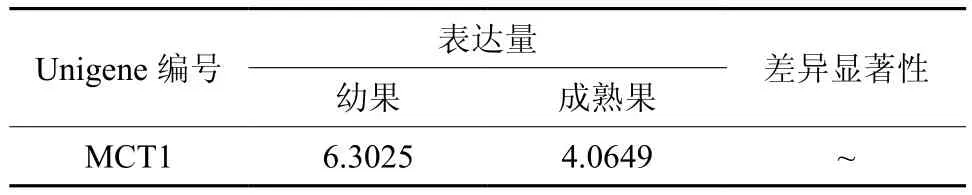
表6 MCT在杜仲幼果和成熟果实中的表达情况Table 6 Expression of MCT in fruits and young fruits
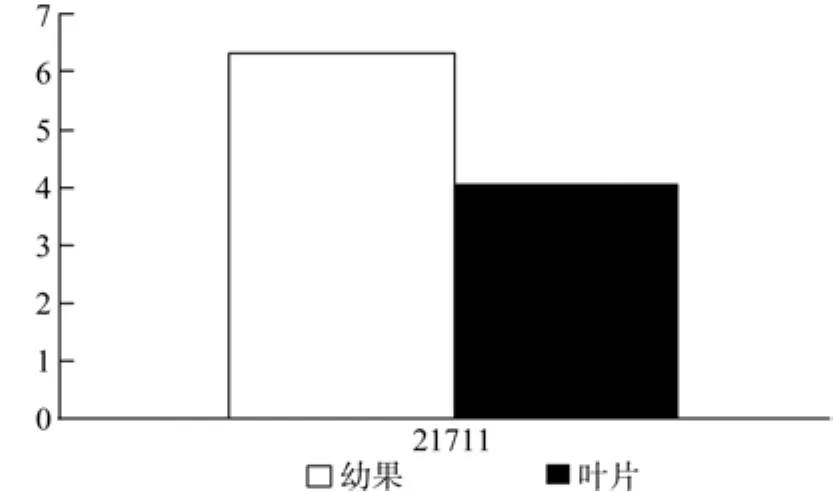
图7 MCT在杜仲幼果和成熟果实中的表达差异Fig.7 Expression of MCT in fruits and young fruits
2.4 4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶(CMK)表达分析
CMK在幼果和叶片中只有1条Unigene得到注释,为Unigene8371,其表达量无显著差异(见表7和图8)。
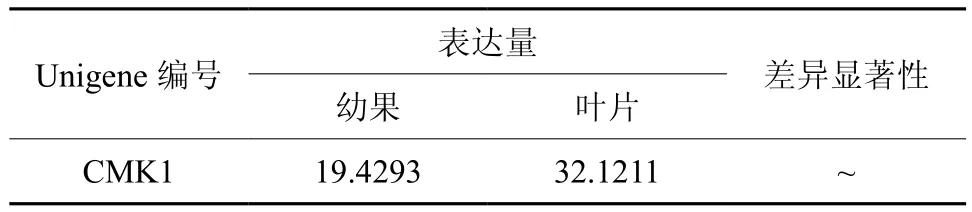
表7 CMK在杜仲幼果和叶片中的表达情况Table 7 Expression of CMK in leaves and young fruits
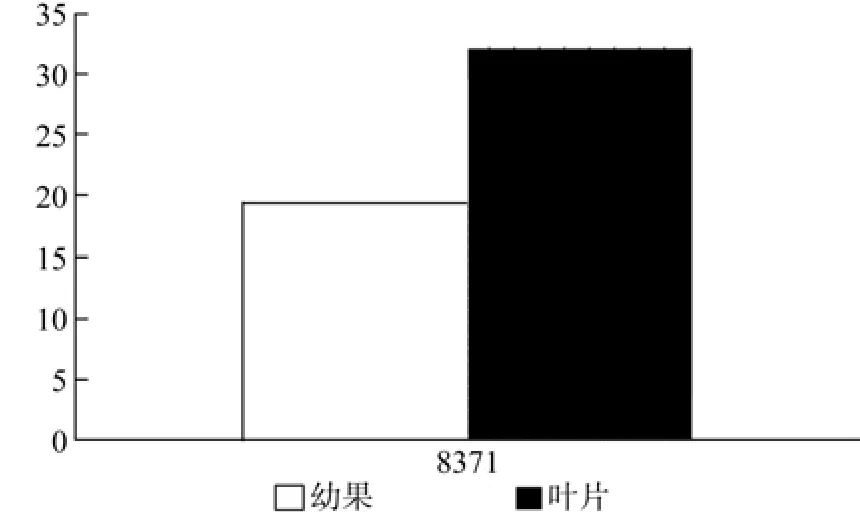
图8 CMK在杜仲幼果和叶片中的表达差异Fig.8 Expression of CMK in leaves and young fruits
在幼果和成熟果实中也只有1条Unigene得到注释,为Unigene19234,其表达量无显著差异(见表8和图9)。

表8 CMk在杜仲幼果和成熟果实中的表达情况Table 8 Expression of CMK in fruits and young fruits
图9 CMK在杜仲幼果和成熟果实中的表达差异Fig.9 Expression of CMK in fruits and young fruits
2.5 2-甲基-D-赤藓醇-2,4-环焦磷酸合酶(MDS)表达分析
MDS在幼果和叶片中仅有1条Unigene被注释,为Unigene12126,其表达量差异显著(见表9和图10)。

表9 MDS在杜仲幼果和叶片中的表达情况Table 9 Expression of MDS in leaves and young fruits
图10 MDS在杜仲幼果和叶片中的表达差异
Fig.10 Expression of MDS in leaves and young fruits
在幼果和成熟果实中有2条Unigene被注释,分别是Unigene19101和Unigene54272, 其中Unigene54272在成熟果实中特异表达,以上2条Unigene表达量无显著性差异(见表10和图11)。
2.6 1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶(HDS)表达分析
HDS在幼果和叶片中只有1条Unigene被注释,为Unigene447,其表达量差异显著(见表11和图12)。

表10 MDS在杜仲幼果和成熟果实中的表达情况Table 10 Expression of MDS in fruits and young fruits

图11 MDS在杜仲幼果和成熟果实中的表达差异Fig.11 Expression of MDS in fruits and young fruits
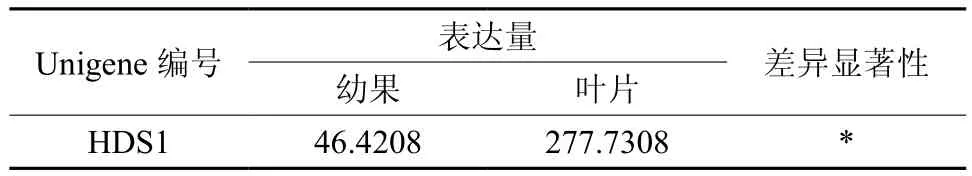
表11 HDS在杜仲幼果和叶片中的表达情况Table 11 Expression of HDS in leaves and young fruits

图12 HDS在杜仲幼果和叶片中的表达差异Fig.12 Expression of HDS in leaves and young fruits
HDS在幼果和成熟果中有1条Unigene被注释,为Unigene20243,其表达量有显著差异(见表12和图13)。

表12 HDS在杜仲幼果和成熟果实中的表达情况Table 12 Expression of HDS in fruits and young fruits
2.7 1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸还原酶(HDR)表达分析
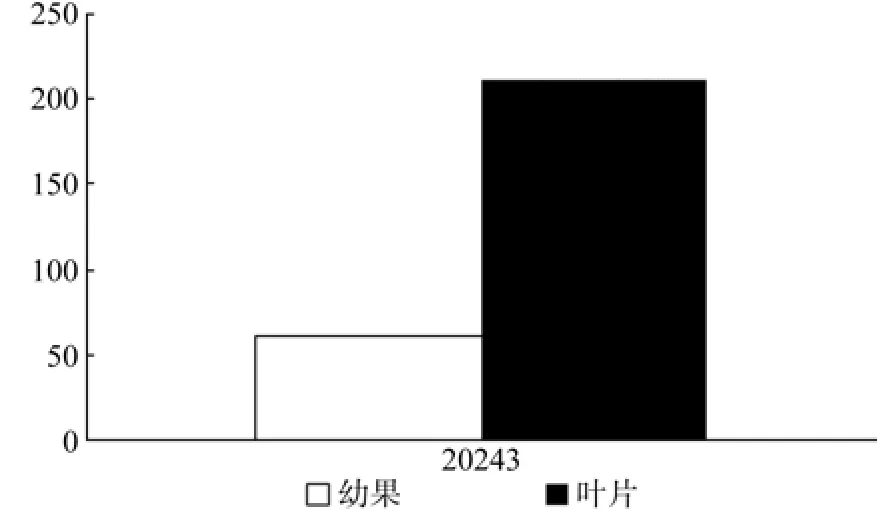
图13 HDS在杜仲幼果和成熟果实中的表达差异Fig.13 Expression of HDS in fruits and young fruits
HDR在幼果和叶片中有5条Unigene被注释,分别为Unigene21206、27419、3128、9279、9944,其中Unigene21206和Unigene9944的表达量有显著性差异(见表13);Unigene21206在幼果和叶片中的表达量均为最高(见表13和图14);整体上叶片中Unigene的表达量明显高于幼果。

表13 HDR在杜仲幼果和叶片中的表达情况Table 13 Expression of HDR in leaves and young fruits

图14 HDR在杜仲幼果和叶片中的表达差异Fig.14 Expression of HDR in leaves and young fruits
HDR在幼果和成熟果中有7条Unegene被注 释, 分 别 为 Uniegen11397、18350、22493、28959、29905、30759, 其 中 Unigene22493、28959、29905、30759的表达量有显著差异(见表14和图15)。
2.8 异戊烯基焦磷酸异构酶(IPI)表达分析
IPI在幼果和叶片中Unigene仅有1条Unigene被注释,为Unigene1194,其表达量无显著差异(见表15)。

表14 HDR在杜仲幼果和成熟果实中的表达情况Table 14 Expression of HDR in fruits and young fruits
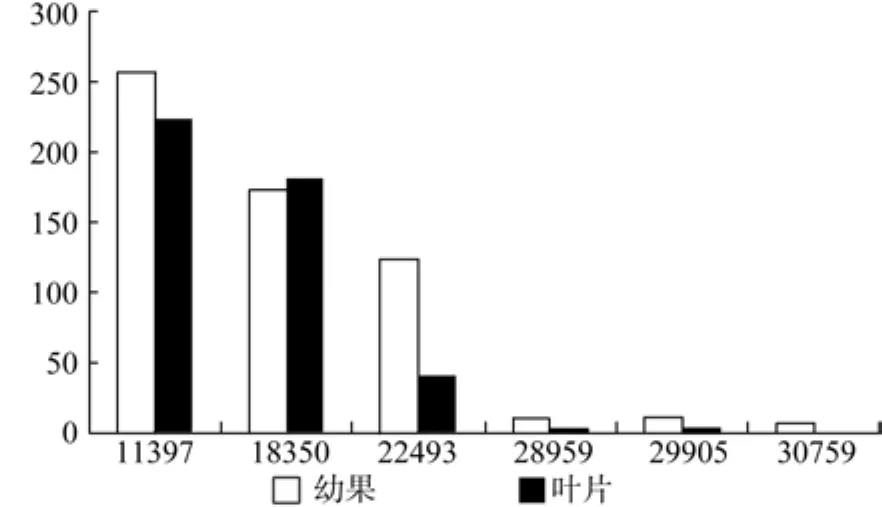
图15 HDR在杜仲幼果和成熟果实中的表达差异Fig.15 Expression of HDR in fruits and young fruits

表15 IPI在杜仲幼果和叶片中的表达情况Table 15 Expression of IPI in leaves and young fruits

图16 IPI在杜仲幼果和叶片中的表达差异Fig.16 Expression of IPI in leaves and young fruits
IPI在幼果和成熟果实中有2条Unigene被注释,分别是Unigene18426和Unigene25112,其中Unigene18416的表达量有显著差异(见表16)。

表16 IPI在杜仲幼果和成熟果实中的表达情况Table 16 Expression of IPI in fruits and young fruits
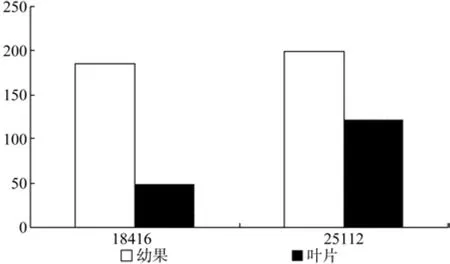
图17 IPIe在杜仲幼果和成熟果实中的表达差异Fig.17 Expression of IPI in fruits and young fruits
3 结论与讨论
本研究首次比较了杜仲MEP途径的8条基因在幼果和叶片以及幼果和成熟果实的表达量,为将来从分子水平上深入研究杜仲MEP途径的调控提供了理论基础。在杜仲幼果、叶片和成熟果实转录组数据中共8个基因被KEGG数据库MEP合成途径注释,幼果和叶片中有19条Unigene被注释,幼果和成熟果实中有23条Unigene被注释。其中1-脱氧-D-木酮糖-5-磷酸合成酶在幼果和叶片中有Unigene10793等5条Unigene被注释,在幼果和成熟果实中有Unigene1097等7条Unigene被注释;1-脱氧-D-木酮糖-5-磷酸还原异构酶在幼果和叶片中有Unigene22043等4条Unigene被注释,在幼果和成熟果实中有Unigene20455等3条Unigene被注释;2-甲基-D-赤藓醇-4-磷酸胞苷酰转移酶在幼果和叶片中仅Unigene21890被注释,在幼果和成熟果实中仅Unigene21711被注释;4-(5’-焦磷酸胞苷)-2-C-甲基-D-赤藓醇激酶在幼果和叶片中仅Unigene8371被注释,在幼和成熟果实中仅Unigene19234被注释;2-甲基-D-赤藓醇-2,4-环焦磷酸合酶MDS在幼果和叶片中仅Unigene12126被注释,在幼果和成熟果实中有Unigene19101等2条Unigene被注释;1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸合酶在幼果和叶片中仅Unigene447被注释,在幼果和成熟果实中仅Unigene20243被注释;1-羟基-2-甲基-2-E-丁烯基-4-焦磷酸还原酶在幼果和叶片中有Unigene21206等6条Unigene被注释;异戊烯基焦磷酸异构酶在幼果和叶片中仅Unigene1194被注释,在幼果和成熟果实中有Unigene18246等2条Unigene被注释。
赵丹[15]于2009年研究了杜仲法尼基焦磷酸合成酶基因超量表达对含胶细胞的影响,通过将与杜仲胶合成相关的法尼基焦磷酸合酶基因转入杜仲,使其在杜仲中超量表达,经与对照比较发现,转EuFPS基因的含胶细胞多于对照的含胶细胞,在电镜下,转EuFPS基因的杜仲叶片中充满了颗粒状物质,细胞结构完全退化,但这些颗粒物质在对照中没有观察到,推断出是法尼基焦磷酸合酶基因的超量表达对杜仲含胶细胞产生了影响。
2012年Ren Chen[16]等通过过量表达来提高EuIPI的表达水平从而提高了转基因杜仲中反式聚异戊二烯的积累量,IPI催化异戊烯基二磷酸转化成其高度亲电的异构体-二甲基丙烯基二磷酸,这是包括异戊二烯在内的所有类异戊二烯的生物合成的第一步,研究结果表明,IPI的表达调控是高产胶杜仲的关键靶点。综上所述,可以在本研究的基础上,借鉴前人的经验更加深入的地研究杜仲MEP生物合成途径的调控[17-18]。
[1] 杜红岩. 杜仲优质高产栽培[M] . 北京: 中国林业出版社,1996.
[2] 李芳东, 杜红岩. 杜仲[M] . 北京: 中国中医药出版社, 2001.
[3] Victor B, Call and David L. Dilcher. The fossil record ofEucommia(Eucommiaceae) in north America[J]. American Journal of Botany, 1997, 84(6): 798-814.
[4] 纪奎江.我国橡胶资源与废橡胶循环利用[J].技术交流,2010,4: 21-24.
[5] 国家药典委员会.中华人民共和国药典一部[M].北京:化学工业出版社,2005.
[6] Jin Nyoung HO, Yoo Hyun LEE, Jong Seok PARK,et al.Protective effects of aucubin isolated fromEucommia ulmoidesagainst UVB-induced oxidative stress in human skin fi broblasts[J]. Biol. Pharm. Bull., 2005, 28(7):1244-1248.
[7] Shinya Takeno, Takeshi Bamba, Yoshihisa Nakazawa,et al.Quantif i cation of trans-1,4-polyisoprene inEucommia ulmoidesby fourier transform infrared spectroscopy and pyrolysis-gas chromatography/mass spectrometry. Journal of Bioscience and Bioengineering[J].2008,105(4):355-359.
[8] Nobuaki Suzuki, Hirotaka Uefuji, Takashi Nishikawa,et al. Construction and analysis of EST libraries of the transpolyisoprene producing plant,Eucommia ulmoidesOliver.Planta[J]. DOI 10.1007/s00425-012-1679-x.
[9] 李铁柱, 杜红岩, 刘慧敏, 等. 杜仲果实和叶片转录组数据组装及基因功能注释[J].中南林业科技大学学报, 2012, 32(11):122-130.
[10] 李铁柱, 杜红岩, 刘慧敏, 等. 杜仲幼果和成熟果转录组数据组装及基因功能注释[J]. 中南林业科技大学学报,2012,32(10): 9-17.
[11] 李 恒.萜类化合物MEP生物合成途径中关键酶1-脱氧-D-木酮糖-5-磷酸合酶和1-脱氧-D-木酮糖-5-磷酸还原异构化酶的研究[D]. 西安:西北大学, 2012.
[12] 金 蓉, 朱长青, 徐昌杰. 1-脱氧木酮糖-5-磷酸合成酶(DXS)及其编码基因[J]. 细胞生物学杂志, 2007, 29: 706-712.
[13] Adhikari Megha Nath. Expressional and functional Analysis of HMGR,DXS and DXR genes from Amomum villosum Lour[D].广州:广州中医药大学, 2010.
[14] 刘攀峰. 杜仲MEP途径系列基因全长cDNA分离鉴定及序列特征研究[D]. 北京:中国林业科学研究院, 2012.
[15] 赵 丹.杜仲法尼基焦磷酸合成酶基因超量表达对含胶细胞的影响研究[D]. 贵阳:贵州大学, 2009.
[16] Ren Chen, Yoko Harada, Takeshi Bamba, et al. Overexpression of an isopentenyl diphosphate isomerase gene to enhance transpolyisoprene production in Eucommia ulmoides Oliver[J]. BMC Biotechnology., 2012, 12:78.
[17] 乌云塔娜,刘慧敏,杜红岩,等. 杜仲MEP 途径系列基因5′ 端非编码区的顺式作用元件预测[J]. 经济林研究,2013,31(4): 9-15.
[18] 刘慧敏,乌云塔娜,杜红岩,等. 杜仲MEP 途径系列基因的基因结构预测[J]. 经济林研究,2013,31(4):39-44.
Expression differences of several genes in Eucommia MEP pathway
LIU Hui-min1a,1b, WUYUN Tana2, WANG Lin1a,1b, XU Jing-shi1a,1b, YE Sheng-jing1a,1b
(1.Central South University of Forestry and Technology, a. Key Laboratory of Cultivation and Protection for Non-Wood Forest Trees,Ministry of Education; b. School of Forestry, Changsha 410004, Hunan, China; 2. Non-timber Research and Development Center of CAF, Zhengzhou 450003, Henan, China)
Based on the transcriptome of Eucommia fruits and leaves, the expression differences of several genes in MEP pathway, thus offering an important basis for gene clone, function identif i cation, molecular accumulation mechanism of important component. The results show that 42 Unigene were annotated by MEP pathway, of them, the expression of DXS2 and DXS3 were signif i cantly different between young fruit and leaf, and the expression of DXS2 was the highest; 7 Unigenes of DXS were annotated in young fruit and mature fruit., of them, DXS6 only was expressed in fruit and the expressions of DXS2, DXS3, DXS5 and DXS7 were with signif i cant differences. 4 Unigenes of DXR were annotated in young fruit and leaf. The expression of DXR1、DXR2、DXR3 were signif i cantly different.3 Unigenes were annotated in young fruit and fruit.DXR3 only expressed in fruit.Expression of all Unigenes were not signif i cantly different.Expression of DXR1 was highest.Only 1 Unigene of MCT was annotated in young fruit and leaf and it’s expression was signif i cantly different.Only 1 Unigene was annotated in young fruit and fruit and it’s expression was not signif i cantly different.Only 1 Unigene of CMK was annotated in young fruit and leaf and it’s expression was not signif i cantly different.Only 1 Unigene was annotated in young fruit and fruit and it’s expression was not signif i cantly different.Only 1 Unigene of MDS was annotated in young fruit and leaf and it’s expression was signif i cantly different.2 Unigenes were annotated in young fruit and fruit and it’s expression was not signif i cantly different.Only 1 Unigene of HDS was annotated in young fruit and leaf and it’s expression was signif i cantly different.Only 1 Unigene was annotated in young fruit and fruit and it’s expression was signif i cantly different.5 Unigenes of HDR were annotated in young fruit and leaf.Expression of HDR1and HDR5 were signif i cantly different.While 7 Unigenes were annotated in young fruit andfruit.Expression of HDR3、HDR4、HDR5、HDR6 were signif i cantly different.Only 1 Unigene of IPI was annotated in young fruit and leaf and it’s expression was not signif i cantly different.While 2 Unigenes were annotated in young fruit and fruit.Expression of IPI1 was signif i cantly different.
Eucommia; young fruit; leaf; fruit; gene expression analysis
S727.3;S603.2
A
1673-923X(2014)02-0026-08
2013-04-12
林业公益性行业科研专项“杜仲育种群体建立与综合利用技术研究”(201004029)
刘慧敏(1989-),女,河南辉县人,硕士研究生,研究方向为林业生物技术
乌云塔娜(1975-),女,内蒙古通辽人,博士, 教授,主要从事经济林育种与栽培的研究;E-mail:tanatana@sina.com
[本文编校:吴 彬]

