艾迪注射液新组方对肝癌荷瘤小鼠扶正作用及其机制初探
孙彦昊 浦 洁 曹 莉 杨世林 崔京浩
(苏州大学 药学院,江苏 苏州 215123)
艾迪注射液是由人参、黄芪、刺五加、斑螯等组成的中药复方抗肿瘤针剂,临床上主要用于原发性肝癌、肺癌、肠癌、鼻咽癌、泌尿系统肿瘤、恶性淋巴瘤和妇科恶性肿瘤的辅助治疗以及肿瘤术后的巩固治疗[1-2]。通过前期有效成分的药效学筛选,我们呢保留了艾迪注射液中的人参皂苷、刺五加皂苷、黄芪皂苷和斑蝥素等成分,并通过正交试验进行了成分间配比的优化,得到了艾迪注射液新组方。
本文通过比较正常小鼠和荷瘤小鼠的耐疲劳和耐缺氧实验,以及荷瘤小鼠免疫器官指数的测定,探讨了艾迪新组方对荷瘤小鼠的扶正作用及其机制。
1 材料与方法
1.1 实验动物与细胞株
ICR小鼠(SPF)260只,体重23±2g,雄性,购自苏州大学实验动物中心;小鼠肝癌H22细胞购自中国科学院上海生物化学与细胞生物学研究所。
1.2 试剂
人参皂苷,黄芪皂苷,刺五加皂苷,(纯度均>80%,苏州大学天然药物教研室自制,批号:20110228);斑蝥素(纯度>90%,南京泽郎医药科技有限公司,批号:ZL20090120);5-氟尿嘧啶(购自上海旭东海普药业有限公司,批号:H31020593)。
1.3 实验方法
1.3.1 实体瘤模型的建立 选取健康雄性ICR小鼠50只,体重23±2g,无菌抽取接种6d生长良好的肝癌H22小鼠腹水,稀释至细胞密度为1×107/mL,以每只0.2 mL无菌接种于小鼠右侧腋窝皮下制造实体瘤模型。
1.3.2 正常与荷肝癌小鼠耐疲劳实验 将接种肝癌H22细胞后的小鼠随机分为5组,每组10只。同时另外选取50只健康雄性ICR小鼠,也随机均分为相对应的5组。(1)模型对照组:生理盐水10 mL·kg-1·d-1;(2)艾迪新组方低剂量组:艾迪新组方 5.5 mg·kg-1·d-1;(3)艾迪新组方中剂量组:艾迪新组方 11 mg·kg-1·d-1;(4)艾迪新组方高剂量组:艾迪新组方 22 mg·kg-1·d-1;(5)阳性对照组:5-氟尿嘧啶 15mg·kg-1·d-1。 肿瘤接种后次日开始腹腔注射给药,给药容积均为0.1mL·10g-1,连续7d。末次给药 30min 后将各组小鼠尾部负重(2g),放入水深 20cm,水温(20±0.5)℃的玻璃缸内游泳。记录小鼠从入水到沉入水底不能再游出水面的时间。
1.3.3 正常与荷肝癌小鼠耐缺氧实验 末次给药30min后将各组小鼠放入容积为150mL的广口瓶中,加入20g变色硅胶,塞紧瓶盖,用凡士林封口后,立即计时,以呼吸停止为指标,观察小鼠存活时间。
1.3.4 艾迪新组方对免疫器官重量的影响 设艾迪新组方低、中、高三个剂量组,并设立正常对照组、模型对照组和阳性对照组。末次给药24h后(禁食10h):称小鼠体重,处死动物,测量和计算脏器系数。胸腺系数(%)=(胸腺重量 g/小鼠体重 g)×100%;脾脏系数(%)=(脾脏重量g/小鼠体重 g)×100%。
1.4 统计分析
数据用SPSS 13.0统计软件分析,计量资料均以x±SEM表示,组间比较采用单因素方差分析和t检验。
2 结果
2.1 艾迪新组方对正常小鼠和肝癌H22荷瘤小鼠耐疲劳的影响
随着艾迪新组方给药剂量的增加,正常小鼠和肝癌荷瘤小鼠的耐疲劳时间均有所延长,其中高剂量组与模型对照组相比具有显著差异。而5-FU组虽可通过对肿瘤的抑制作用,提高肝癌荷瘤小鼠的耐疲劳时间,但却明显缩短了正常小鼠耐疲劳时间(见表1)。
表1 艾迪新组方对正常小鼠和肝癌荷瘤小鼠耐疲劳的影响(±SEM,N=10)
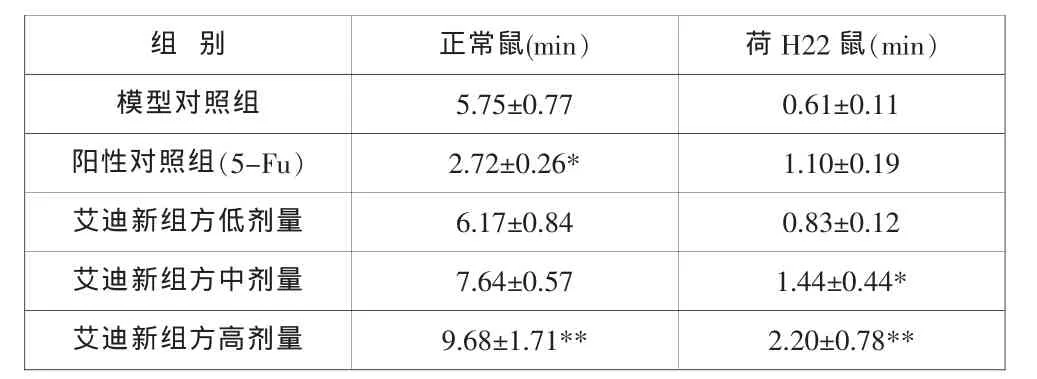
表1 艾迪新组方对正常小鼠和肝癌荷瘤小鼠耐疲劳的影响(±SEM,N=10)
与模型对照组比较:*P<0.05, **P<0.01.
?
2.2 艾迪新组方对正常小鼠和肝癌H22荷瘤小鼠耐缺氧实验结果
艾迪新组方各给药组正常小鼠和肝癌荷瘤小鼠的耐缺氧时间均有所延长,且呈明显的剂量依赖性,特别是提高肝癌荷瘤小鼠的耐缺氧能力,其与模型对照组比较均显著提高。高剂量也可显著延长正常小鼠的耐缺氧时间。而5-FU却缩短了正常小鼠的耐缺氧时间(见表2)。
表2 艾迪新组方对正常小鼠和肝癌荷瘤小鼠耐缺氧的影响(±SEM,N=10)
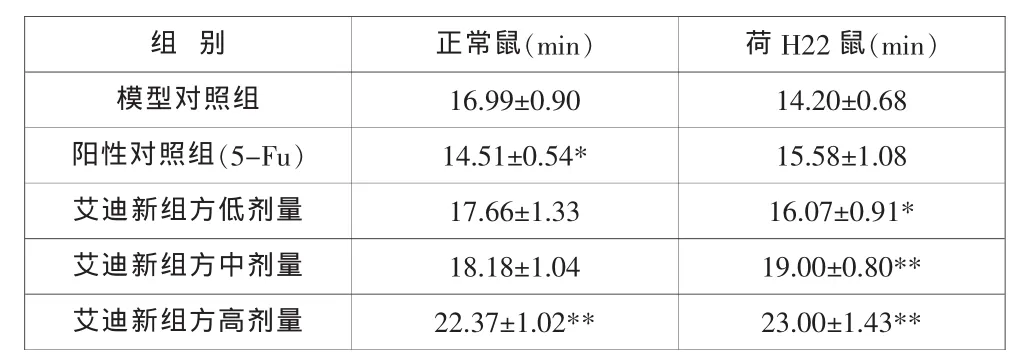
表2 艾迪新组方对正常小鼠和肝癌荷瘤小鼠耐缺氧的影响(±SEM,N=10)
与模型对照组比较:*P<0.05, **P<0.01.
组 别 正常鼠(min) 荷H22鼠(min)模型对照组 16.99±0.90 14.20±0.68阳性对照组(5-Fu) 14.51±0.54* 15.58±1.08艾迪新组方低剂量 17.66±1.33 16.07±0.91*艾迪新组方中剂量 18.18±1.04 19.00±0.80**艾迪新组方高剂量 22.37±1.02** 23.00±1.43**
2.3 艾迪新组方对肝癌H22荷瘤小鼠免疫器官的影响
小鼠荷肝癌实体瘤后胸腺系数明显减小,而脾脏系数却显著增大。肝癌荷瘤小鼠的脾脏肿大的原因,可能是由于移植性癌肿刺激机体的免疫反应,也可能是由于癌细胞虽淋巴转移侵润脾脏[3]。阳性对照的5-FU组小鼠表现胸腺和脾脏系数均显著下降,体现了其对免疫系统的抑制作用。艾迪新组方中小剂量组动物脾脏系数接近正常对照组,而艾迪新组方高剂量下则可显著增加肝癌荷瘤小鼠脾脏系数。艾迪新组方对肝癌荷瘤小鼠的胸腺系数影响不大。
表3 艾迪新组方对肝癌H22荷瘤小鼠抑瘤率和脏器系数的影响(±SEM,N=10)
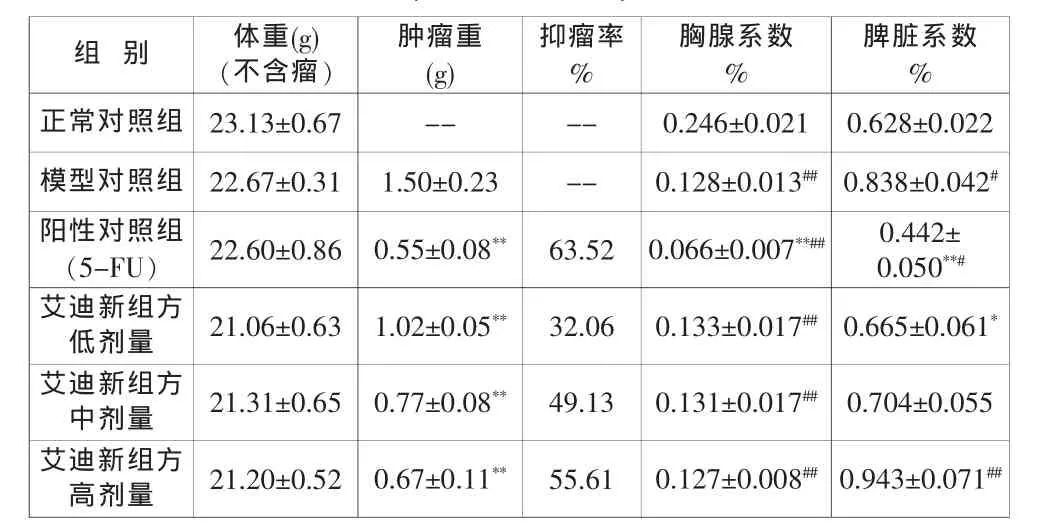
表3 艾迪新组方对肝癌H22荷瘤小鼠抑瘤率和脏器系数的影响(±SEM,N=10)
与模型对照组比较:*P<0.05, **P<0.01;与正常对照组比较:#P<0.05,##P<0.01.
组 别 体重(g)(不含瘤)肿瘤重(g)抑瘤率%胸腺系数%脾脏系数%正常对照组 23.13±0.67 -- -- 0.246±0.021 0.628±0.022模型对照组 22.67±0.31 1.50±0.23 -- 0.128±0.013##0.838±0.042#阳性对照组(5-FU) 22.60±0.86 0.55±0.08** 63.52 0.066±0.007**## 0.442±0.050**#艾迪新组方低剂量 21.06±0.63 1.02±0.05** 32.06 0.133±0.017##0.665±0.061*艾迪新组方中剂量 21.31±0.65 0.77±0.08** 49.13 0.131±0.017## 0.704±0.055艾迪新组方高剂量 21.20±0.52 0.67±0.11** 55.61 0.127±0.008##0.943±0.071##
2 讨论
中医认为肿瘤的发病是由于机体的正气不足,导致邪毒留聚而成,而疾病的最终转归由正邪交争的结果而定。因此,中医治疗肿瘤,特别重视正邪之间的关系处理。现代医学研究证明,斑蝥素可通过破坏线粒体膜、下调抗凋亡蛋白Bcl-2水平、上调凋亡前蛋白Bax等机制促进肿瘤细胞凋亡[4]。人参皂苷对肝癌有一定的治疗效果,其机制可能与抑制端粒酶、抑制自噬及诱导凋亡有关[5]。黄芪皂苷可下调肝癌细胞中致癌基因的高表达[6]。刺五加皂苷可抑制肝癌细胞DNA合成[7]。此外,人参皂苷、黄芪皂苷和刺五加皂苷除能直接作用于肿瘤细胞抑制其生长外,均具有促进机体免疫功能和通过提高网状内皮系统吞噬功能,增强T细胞、NK细胞和IL-II的抗癌话性,增强对肿瘤细胞的杀伤能力的作用[8]。
本研究结果表明,艾迪注射液新组方可显著延长正常小鼠和肝癌荷瘤小鼠耐疲劳和耐缺氧时间,高剂量时可明显增加肝癌H22荷瘤小鼠脾脏系数,但对胸腺系数的影响不明显。
[1]Xu XM,Ge W,Yuan GJ.Effects of Aidi injection on vinorelbine plus cisplatin chemotherapy for advanced non-small cell lung cancer[J].Chinese-German J Clin Oncol,2008,7(10):560.
[2]楼海舟,潘宏铭,金伟,等.艾迪注射液联合冷循环射频消融术治疗肝癌的研究[J].中国中西医结合杂志,2007,27(5):393.
[3]Kawaguchi T,Honda T,Nishihara M,Yamamoto T,Yokoyama M.Histological study on side effects and tumor targeting of a block copolymer micelle on rats[J].J Control Release,2009,136(3):240.
[4]Chang C,Zhu YQ,Mei JJ,Liu SQ,Luo J.Involvement of mitochondrial pathway in NCTD-induced cytotoxicity in human hepG2 cells[J].J Exp Clin Cancer Res,2010,29(1):145.
[5]Zheng LH,Bao YL,Wu Y,et al.Cantharidin reverses multidrug resistance of human hepatoma HepG2/ADM cells via down-regulation of P-glycoprotein expression[J].Cancer Lett,2008,272(1):102.
[6]Qi H,Wei L,Han Y,et al.Proteomic characterization of the cellular response to chemopreventive triterpenoid astragaloside IV in human hepatocellular carcinoma cell line HepG2[J].Int J Oncol,2010,36(3):725.
[7]叶红军,叶炯贤,房家智.刺五加皂甙对肝癌细胞动力学的影响[J].中华肝脏病杂志,2000,8(3):134.
[8]Kaskiw MJ,Tassotto ML,et al.Structural analogues of diosgenyl saponins:synthesis and anticancer activity[J].Bioorg Med Chem,2009,17(22):7670.

