应用ISSR 技术鉴定杭白菊对叶斑病的抗性
郭庆海, 李丹霞, 王康才, 薛友荣, 周雪松, 陈志祥
(1.江苏省滨海县植保植检所,江苏 滨海224500;2.南京农业大学园艺学院,江苏 南京210095;3.江苏省滨海县农业科学研究所,江苏 滨海224500;4.江苏省射阳县盛大药材有限公司,江苏 盐城224300)
杭菊花是中国传统的药食兼用药用植物,随着人们生活水平提高,保健意识加强,其市场需求逐年增加,种植面积也随之扩大,但在老产区调查发现,由于连作,菊花病害尤其是菊花叶斑病等病害成为限制农民增产增收的障碍[1]。病害的判断诊治主要靠常规手段,用分子手段进行病害的鉴定分类则较少,张欣[2]应用RAPD 技术区别芒果抗炭疽病品种,李海生[3]利用ISSR 分子标记技术进行了植物遗传多样性的分析应用,高山等以ITS1 和ITS4 为 引 物扩增病原菌的ITS 片段,对叶斑病进行分子鉴定[4]。张正光等进行ITS 序列分析确定了根腐病的病原菌[5]。ISSR 简单序列重复区间(Inter-simple sequence repeat,ISSR )是一种基于微卫星(Simple sequence repeat,SSR)序列发展起来的、利用PCR 扩增进行检测的、十分有效的分子标记技术,广泛应用于植物遗传关系及遗传多样性、品种鉴定、系统演化等方面研究。作为一种新型的分子标记,ISSR 标记结合了RAPD 和SSR 的优点,具有模版需要量少,多态性丰富,无需试剂盒,结果记录方便,试验成本低,操作简单,实验稳定性较高等优点,但目前未见利用ISSR 技术鉴别菊花抗叶斑病品种的相关报道。为此,本试验采用ISSR 技术对20 个杭白菊材料(其中10 个材料为抗病材料)的抗病性育成品种的早期确定、抗病品种的鉴定及抗病机理等进行研究,以期为菊花抗叶斑病品种筛选、品种鉴定提供一种有效的辅助手段。
1 材料与方法
1.1 材料
20 种材料采自南京农业大学园艺学院实验基地,均为江苏省滨海县植保植检所菊花课题组前期选育,由南京农业大学中药材系王康才教授鉴定。品种名、田间抗性见表1。试验材料包括杭白菊的2个品系新白品系(新白)和红心品系(其他19 个品种),其中新×香、红心11×香菊和红心11×菊花脑3个材料为杂交材料。
1.2 方法
采用改良的CTAB 法提取菊花基因组DNA[6],1%琼脂糖凝胶电泳检测DNA 质量和浓度,稀释至50 ng/μl。ISSR-PCR 反应体系总体积为20 μl,其中包括200.0 μmol/L dNTP、0.5 μmol/L primer、10×PCR buffer、50 ng DNA template、1.5 U DNA polymerase、无菌水。PCR 扩增反应在BIO-RAD 公司MJ Mini 48 孔梯度PCR 仪上进行。扩增程序为:94 ℃预变性5 min;94 ℃变性45 s,45 ~55 ℃复性1 min,72 ℃延伸1 min 30 s,39 个循环;72 ℃延伸7 min,4 ℃保存。扩增后每管加入6×溴酚蓝1 μl,混匀后取10 μl 扩增产物在2.0%琼脂糖凝胶上电泳,凝胶中含有1% 的4S Green。电泳缓冲液为1×TAE,电压5 V/cm。在上海培青科技有限公司生产的JS-380 型凝胶成像系统上观测并照相。

表1 试验材料及其田间抗性Table 1 Accessions used in the study and their field resistance
1.3 数据统计及分析
根据PCR 扩增产物的电泳结果,在凝胶的某个相同迁移位置上有DNA 条带的记为1,无DNA 条带的记为0,采用POPGENE32 软件计算多态位点百分率(PPB)、平均有效等位基因数(Effective number of alleles,Ne)、Nei’s 基因多样性指数(Nei’s gene diversity,He)和 Shannon 信 息 多 样 性 指 数(Shannon’s information index,I);用DPS 分析软件的非加权配对类平均法(UPGMA)进行聚类分析。
2 结果
2.1 DNA 提取、引物筛选及多态性分析
提取并纯化材料DNA,琼脂糖凝胶电泳确定DNA。
利用3 个表型差异大的材料对100 条ISSR 引物进行筛选,确定23 条带型清晰、多态性较好的引物对20 个试验材料进行多态性分析。淘汰扩增效果差、带型模糊、对个别材料扩增不出条带的引物,最终筛选出10 条引物用于20 份材料的遗传分析。共扩增出168 条清晰可辨谱带,其中多态性带135条;平均多态位点百分率为80.36%,多态性较高。扩增条带集中在200 ~2 000 bp(表2)。如表2 所示在综合比较各引物扩增效果后发现165 号引物多态性条带百分率达100.00%,故选取165 号引物作为最理想的引物。图1 为ISSR 引物165 的扩增结果。

表2 有效ISSR 引物序列及其多态性Table 2 Efficient ISSR primer sequences and their polymorphisms
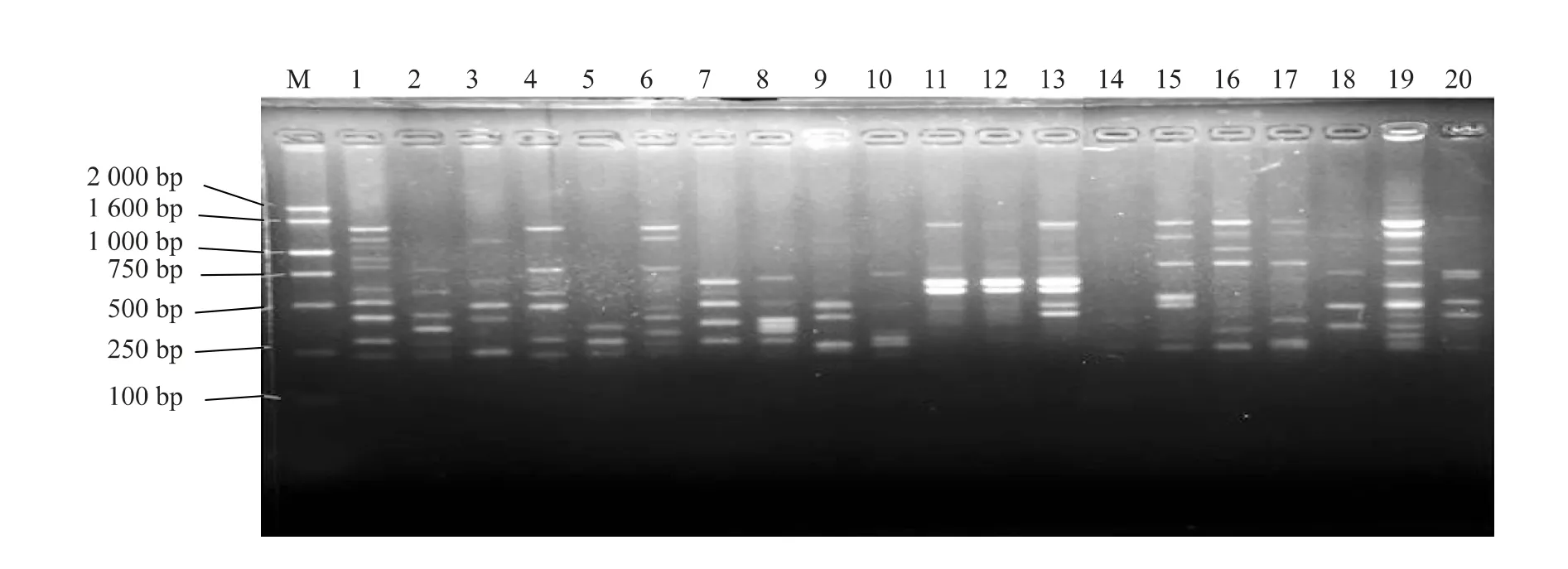
图1 ISSR 引物165 对供试材料的PCR 扩增图谱Fig.1 PCR amplified pattern of Dendranthema morifolium with ISSR 165
2.2 20 个菊花品种ISSR 遗产多样性分析
平均有效等位基因数(Ne)和Nei’s 基因多样性指数(Nei’s gene diversity,He)是衡量遗传变异最常用的2 个遗传指标,具有明显的遗传学意义[6]。Shannon 信息指数方便与同类研究进行比较[7]。利用软件包POPGENE32 对各位点的Ne、He以及Shannon 信息指数进行计算,结果显示,20 个品种平均有效等位基因数为1.549 1,平均Nei’s 基因多样性 指 数 为0.312 9,平 均 Shannon 信 息 指 数为0.458 8。本研究扩增的ISSR 片段多态性较高,说明在进化过程中,菊花栽培品种在DNA 分子水平上形成并保持了较高的遗传变异,还可能与菊花品种存在自交不亲和性[8-9]及无性繁殖有关。
2.3 菊花对叶斑病抗性与其ISSR 聚类组的相关性分析
由图2 可以看出,以遗传距离为0.38 处划分,20 个菊花品种聚类为3 个ISSR 组:第1 组包括大花2 号、大花4 号、优单4 号、优单6 号、红心9 号、红心13 号、红心19 号、红心1 号、红心20 号、单瓣2号,这一组均是高感、中感品种;第2 组包括NJK1、NJK2、NJK3、似贡3 号、红心11 号、新×香、红心11×香、红心11×脑、NJK4,具有抗叶斑病的品种都聚在这一类;第3 组只有一个品种,是新白。
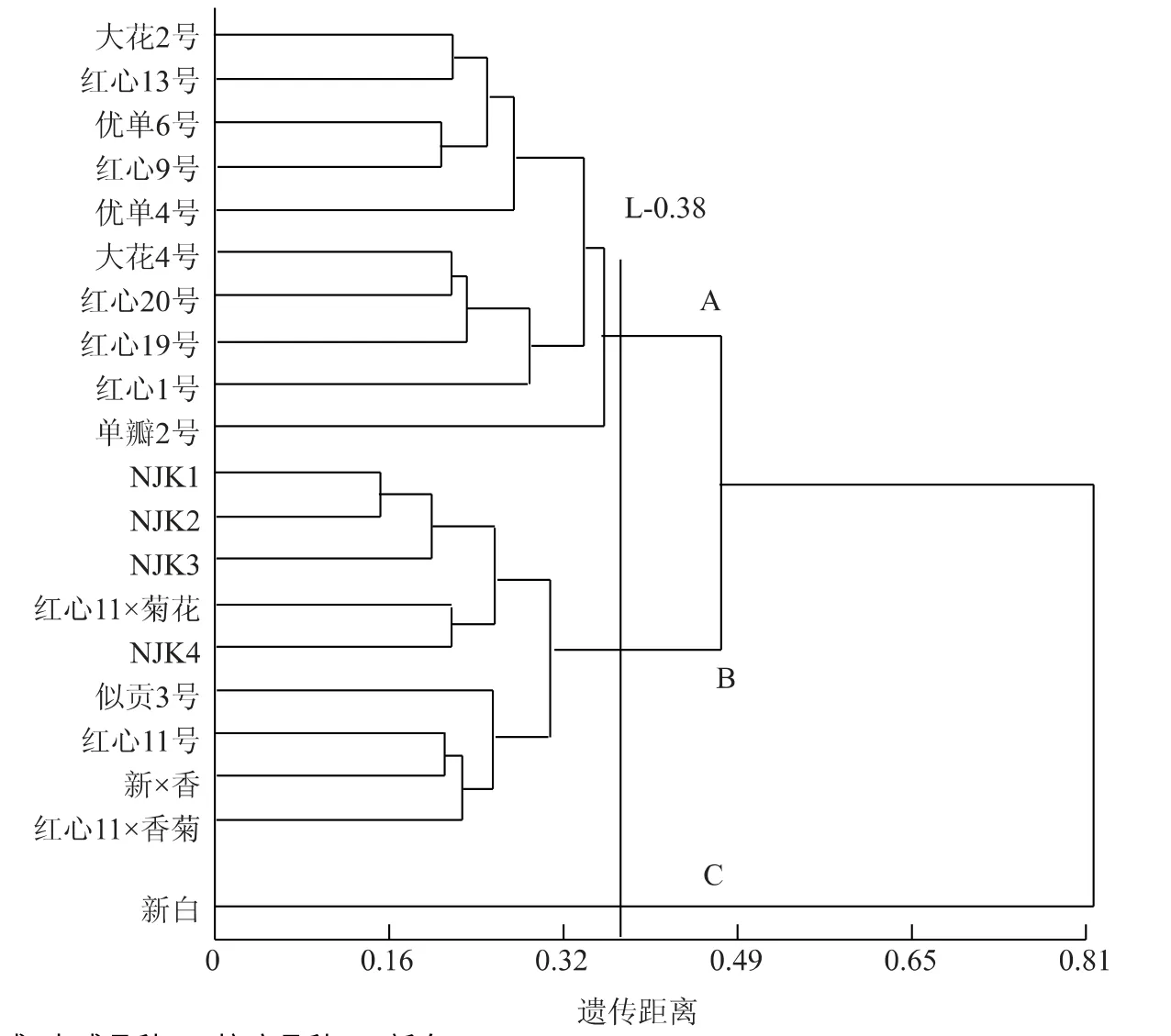
图2 20 个菊花品种ISSR 标记的UPGMA 聚类图Fig.2 Dendrogram of 20 Dendranthema morifolium cultivars based on ISSR markers by UPGMA
对20 种菊花材料运用POPGENE 软件进行分析,结果(表3)显示,在20 种菊花材料中,H最大值为0.498 7,最小值为0.05;I最大值为0.693 1,最小值为0.119 3。这些结果显示出试验材料存在着丰富的遗传变异,推测与菊花长期的自然杂交、自然选择和人工选育造成的复杂的遗传背景有关,这说明菊花具有极其丰富品种的分子基础。在分成2 个类群的基础上,比较抗性材料与感病材料可知:抗性材料的Ne、H及I值均高于感病材料,说明抗性材料之间比易感病材料之间基因差异显著,抗性材料的遗传多样性比感病材料高。
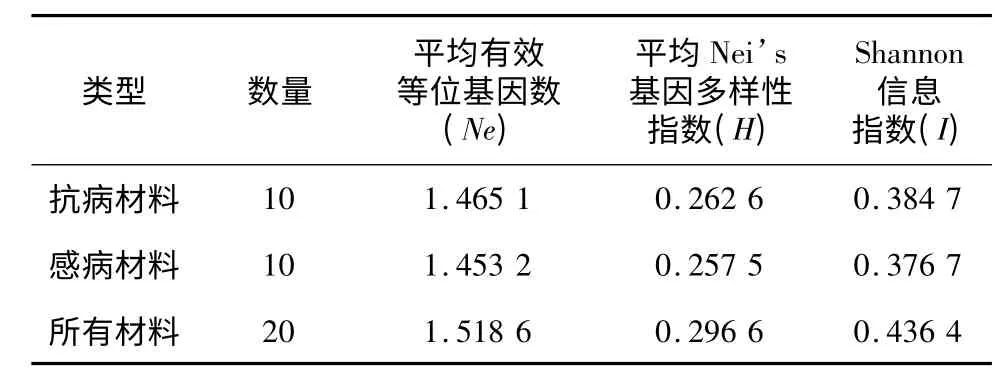
表3 POPGENE 软件分析结果Table 3 The results analyzed by POPGENE software
从ISSR 标记聚类结果来看,聚类结果与杭菊花对叶斑病的田间抗性有明显的相关性,基本能够区分抗性品种和易感品种。
3 讨论
从ISSR 标记聚类结果来看,聚类结果与菊花对叶斑病的田间抗性有明显的相关性。所有抗性材料除了新白全部聚为抗叶斑病品种,除此之外,3 个杂交品种也聚到这一大组中,这个结果也说明了杂交技术在培育抗病新品种中的优势[10],而所有易感病材料聚为高感、中感品种。新白是另一个品系的品种,在这里单独聚为一类。
对易感和具有抗性的2 组试验材料统计的结果显示,抗性材料的平均有效等位基因数、平均Nei’s基因多样性指数及Shannon 信息指数均高于感病材料,表明抗性材料的遗传多样性比感病材料高。可能是因为抗性的遗传多样性丰富,包括的抗病基因相对感病组较多,所以具有抗病性,其具体抗病基因位点仍需要继续研究。本研究因时间和条件限制仅应用ISSR 技术对菊花抗叶斑病进行鉴定,是否可以应用ISSR 技术鉴定菊花甚至其他植物的其他病害仍需继续研究。
ISSR 标记聚类结果表明,利用ISSR 技术可以鉴定菊花是否抗叶斑病,该技术可以作为早期筛选抗叶斑病品种的辅助手段。
[1] 陈长军,刘德辉,王康才.江苏省药用菊花病害普查[R].沈阳:第六届中国植物病害化学防治学术研讨会,2008.
[2] 张 欣.应用RAPD 技术区别芒果抗炭疽病品种的研究[J].中国生态农业学报,2005,13(4):20-21.
[3] 李海生.ISSR 分子标记技术及其在植物遗传多样性分析中的应用[J].生物学通报,2004,39(2):19-20.
[4] 高 山,王孟飞,胡 平,等.基于ITS 序列对万寿菊叶斑病病原菌的分子鉴定[J].湖 北 农 业 科 学,2013,52(9):2074-2076.
[5] 张正光,郭成宝,王源超,等.非洲菊根腐病病原的鉴定与ITS序列分析[J].植物病理学报,2005,35(5):392-396.
[6] 肖 军,杨立国,杨 涛,等.两种提取菊花总DNA 方法的比较[J].辽宁农业科学,2005(1):40-41.
[7] 缪恒彬,陈发棣,赵宏波.85 个大菊品种遗传关系的ISSR 分析[J].园艺学报,2007,34(5):1243-1248.
[8] 黄建安,李家贤,黄意欢,等.茶树品种资源遗传多样性的AFLP 研究[J].园艺学报,2006,33(2):317-322.
[9] DREWLOW L W,ASCHER P D,WIDMER R E.Rapid method of determining pollen incompatibility inChrysanthemum morifoliumRamat.[J].Euphytica,1975,24(1):29-32.
[10] GRONALD W,ASCHER P D.Effects of high temperature treatments on seed yield and self incompatibility inChrysanthemum[J].Euphytica,1975,24(2):317-322.

