外源氯对甘薯幼苗生长及养分吸收的影响
戚冰洁, 曹月阳, 张珮琪, 汪吉东, 张永春, 徐阳春
(1.江苏省农业科学院农业资源与环境研究所,农业部江苏耕地保育科学观测实验站,江苏 南京210014;2.南京农业大学资源与环境科学学院,江苏 南京210095;3.中国农业大学农学与生物技术学院,北京100193)
世界上约20%的可耕地以及近一半的灌溉田都受到盐胁迫的影响[1]。土壤中可溶性盐主要由Na+、Ca2+、Mg2+、Cl-等离子组成[2],其中主要由Na+、对植株生长造成不利影响。有研究结果[3-4]表明Cl-对植物的影响大于Na+和Moya 等[5]对柑橘的研究结果表明,其耐盐性取决于根系外排Cl-的能力。也有研究结果表明对NaCl 处理的植株添加外源氯可促进植物对氧化胁迫的积极响应[6]。
甘薯具有一定的耐盐性,在0.5%盐分条件下仍具有一定的产量,但品种间差异较大[7-8]。传统上认为甘薯属于忌氯作物[9],氯会导致品质和产量的降低。Cl-毒害现象非常普遍,如小麦、大豆、菜豆、棉花以及多数果树等敏感品种叶片积累过量Cl-就会产生毒害作用[10-11]。但也有研究结果表明,适当范围内施用氯化钾可以提高甘薯产量,且对品质和鲜薯干丝率无显著影响[12-13]。本试验研究外源氯胁迫对甘薯生长及氮代谢的影响,以期为甘薯耐氯机制研究以及耐盐新品种选育提供理论基础。
1 材料与方法
1.1 供试品种
选取淀粉加工型品种徐薯22(X22)、苏薯11(S11),以及紫心品种宁紫1 号(NZ1),材料由江苏省农业科学院粮食作物研究所提供。
1.2 试验设计
剪心叶以下3 ~4 茎节处甘薯苗,扦插在有孔隙的泡沫板中固定。将泡沫板置于57 cm×39 cm×10 cm(长×宽×高)的周转箱上,每箱18 株。箱中装入14 L 去离子水配成的1/4 Hoagland 完全营养液(液面高6.3 cm),于温室中培养。培养条件为昼、夜温度分别为(26±2)℃、(17±2)℃,相对湿度60%±5%。
待发根正常后,转入1/2 Hoagland 营养液进行培养。5 ~7 d 后选取生长良好、长势基本一致的幼苗,转入含Cl-浓度为0 mmol/L、42.2 mmol/L、84.4 mmol/L、168.8 mmol/L、211.0 mmol/L 的Hoagland 营养液进行处理。整个培养过程自然光照,每天补充去离子水至标记液面刻度,用H2SO4调节培养液pH 5.5 ~6.0,每隔3 d 更换1 次营养液,并早晚各通气0.5 h。处理7 d 和21 d 后测定相关指标。
外源氯处理配方[14]为CaCl2∶MgCl2∶KCl ∶NH4Cl=36 ∶38 ∶54 ∶9。
1.3 测定指标及方法
1.3.1 鲜质量、叶绿素含量指数和丙二醛含量的测定 从周转箱中取植株用自来水冲洗,再用蒸馏水将植株洗净,用吸水纸吸干,称鲜质量。选取第3 ~4 叶序处的功能叶,用CCM-200 叶绿素测定仪测定叶片叶绿素含量指数。参考Azevedo 等[15]的方法测定丙二醛含量。
1.3.2 硝酸还原酶活性和硝酸盐含量的测定 活体法测定硝酸还原酶活性[16],410 nm 处比色测定硝酸盐含量[17]。
1.3.3 甘薯氮、磷、钾含量的测定 植株样品经H2SO4-H2O2消煮,用凯氏定氮仪(K9840,济南海能仪器公司生产)测定全氮,钼锑抗比色法测定全磷,用火焰光度计(FP6410,上海欣益仪器公司生产)测定全钾。并计算N、P、K 的积累值[18],N(P 或K)积累值=植株N(P 或K)含量×植株干物质积累量。
1.4 数据统计分析
使用SPSS16.0 对测定结果进行统计分析,Microsoft Excel 2010 作图。
2 结果与分析
2.1 外源氯胁迫对甘薯幼苗生长的影响
不同品种间生物量对外源氯的响应存在差异(图1)。处理7 d 甘薯幼苗鲜质量受外源氯的影响显著低于对照;处理21 d 苏薯11 和宁紫1 号鲜质量在低浓度(Cl-浓度≤84.4 mmol/L)处理下显著高于对照,而徐薯22 随浓度升高而降低,但维持在一定水平。三个品种相比较,宁紫1 号受外源氯影响最大,幼苗鲜质量最小。
2.2 外源氯胁迫对甘薯幼苗叶绿素和丙二醛含量的影响
42.2 ~168.8 mmol/L 外源氯处理促进各品种的叶绿素合成(图2)。氯处理21 d 84.4 mmol/L处理的叶绿素含量指数(CCI)最高,徐薯22、苏薯11 和宁紫1 号分别比对照增加了50.7%、23.6%和13.9%。3 个品种的叶绿素含量相比:徐薯22 大于苏薯11 大于宁紫1 号。Cl-处理甘薯幼苗7 d,除宁紫1 号MDA 含量在低浓度(Cl-浓度小于等于84.4 mmol/L)处理下显著高于对照,另外两个品种变化不大(图2);经过21 d 处理,各品种MDA 含量随Cl-浓度升高而增加,其中徐薯22 和苏薯11 在Cl-浓度大于等于84.4 mmol/L处理下MDA含量显著高于对照,而宁紫1 号在Cl-浓度大于等于168.8 mmol/L 处理下显著高于对照。
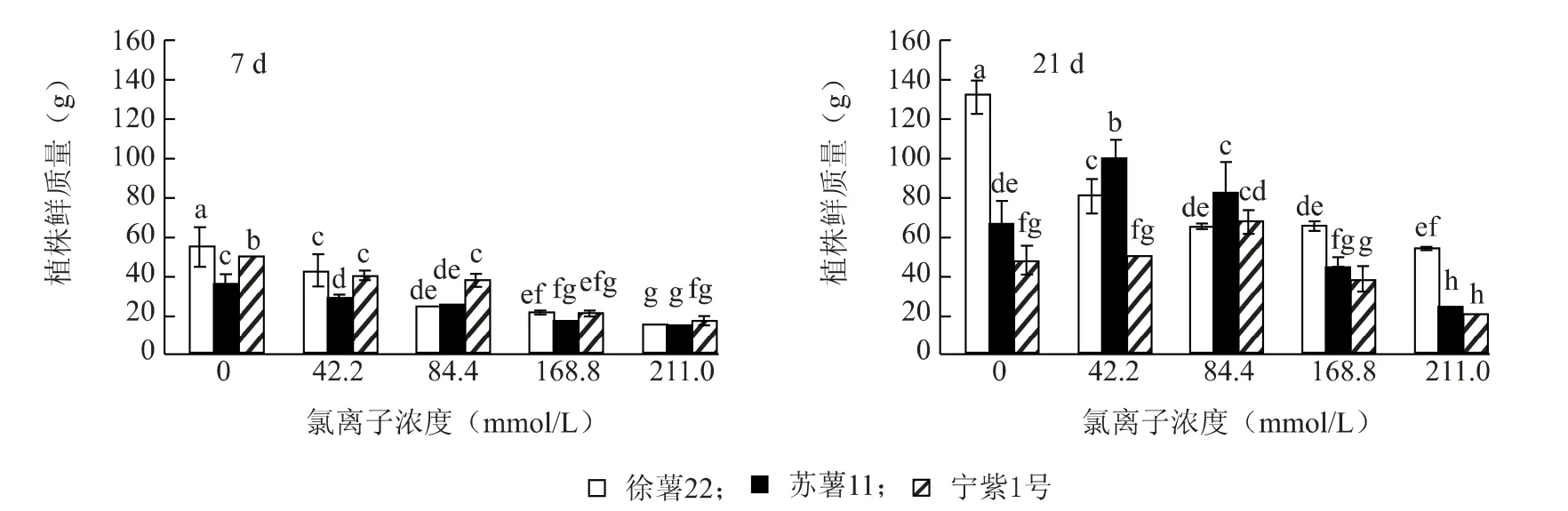
图1 不同浓度外源氯对甘薯幼苗植株鲜质量的影响Fig.1 Effects of different concentrations of exogenous chlorine on fresh weight of sweet potato seedlings

图2 不同浓度外源氯对甘薯幼苗叶绿素含量指数和丙二醛含量的影响Fig.2 Effects of different concentrations of exogenous chlorine on chlorophyll content index and MDA content in sweet potato seedlings
2.3 外源氯胁迫对甘薯幼苗硝酸还原酶活性和硝酸盐含量的影响
外源氯处理7 d,苏薯11 和宁紫1 号的硝酸还原酶(NR)活性逐渐降低,徐薯22 在低浓度(Cl-浓度小于等于84.4 mmol/L)处理下NR活性显著高于对照;在Cl-浓度小于等于84.4 mmol/L 条件下处理21 d 徐 薯22 和 苏 薯11 的NR活 性 升 高,在84.4 mmol/L 浓度下达到显著水平,分别增高15.9%和51.9%(图3)。由图3 可以看出,外源氯处理7 d 徐薯22 硝酸盐含量显著高于对照,而宁紫1 号在Cl-浓度大于等于84.4 mmol/L 处理下显著低于对照;Cl-处理21 d 后,徐薯22 和宁紫1 号在Cl-浓度大于等于84.4 mmol/L 处理下NO-3 含量均显著低于对照,而苏薯11呈低浓度促进高浓度抑制NO-3 积累的变化趋势。
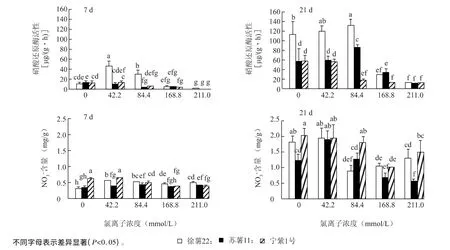
图3 不同浓度外源氯对甘薯幼苗硝酸还原酶活性和NO-3 含量的影响Fig.3 Effects of different concentrations of exogenous chlorine on nitrate reductase activity and NO-3 content in sweet potato seedlings
2.4 外源氯胁迫对甘薯幼苗养分吸收及累积值的影响
由图4 可看出,根系氮含量高于地上部。外源氯处理7 d,除宁紫1 号地上部氮含量逐渐降低,其他品种地上部与根系受外源氯影响差异不大。处理21 d,徐薯22 地上部含氮量除211.0 mmol/L 处理低于对照外,其他处理均显著高于对照。苏薯11 和宁紫1 号地上部含氮量在低浓度(Cl-浓度≤84.4 mmol/L)处理下显著高于对照。3 个品种外源氯处理21 d 根系含氮量测定结果与地上部类似:徐薯22 在低浓度(Cl-浓度≤84.4 mmol/L)处理下显著高于对照,苏薯11 和宁紫1号在42.2 mmol/L 处理下根系含氮量显著上升。
外源氯处理7 d,各品种地上部和根系磷含量随Cl-浓度增大而降低(图4)。处理21 d,不同品种磷含量对Cl-响应各不相同:地上部P 的吸收,徐薯22处理 间 差 异 不 明 显,苏 薯11 在42.2 ~168.8 mmol/L 处理下均高于对照,宁紫1 号在42.2 mmol/L 处理下显著高于对照;根系磷的积累,3 个品种在42.2 ~168.8 mmol/L 处理下均高于对照,其中苏薯11 在84.4 mmol/L 处理下达到显著水平。由图4 可看出根系钾含量高于地上部,Cl-浓度≥84.4 mmol/L 处理7 d 各品种地上部钾含量显著低于对照;根系钾含量测定结果表明,外源氯处理7 d 促进钾的积累,但处理21 d 时差异不明显。
外源氯处理21 d 后各品种养分累积出现明显差异(表1),3 个甘薯品种养分累积量为钾>氮>磷,地上部养分累积高于根系,且受外源氯影响变化趋势相同。方差分析结果显示,徐薯22 幼苗养分累积值随外源氯浓度升高而逐渐降低,且在Cl-浓度≥84.4 mmol/L 处理下显著低于对照;苏薯11 和宁紫1 号在低浓度(Cl-浓度≤84.4 mmol/L)处理下养分累积增加,在211.0 mmol/L 处理下养分累积显著低于对照。苏薯11 和宁紫1 号分别在42.2 mmol/L 和84.4 mmol/L 处理下养分累积量最高。
3 讨论
3.1 外源氯对甘薯幼苗生长的影响
有研究结果表明,Cl-会导致植株生物量、光合活性和光合色素含量的降低[19];而胡小婉等[20]的研究结果表明,适当浓度的Cl-处理可以增加油菜的干物质积累速率和叶绿素含量。本试验结果表明,低浓度(Cl-浓度≤84.4 mmol/L)外源氯处理21 d 可以增加苏薯11 和宁紫1 号幼苗生物量,徐薯22 植株鲜质量则随着Cl-浓度升高而降低但仍可维持在一定水平。
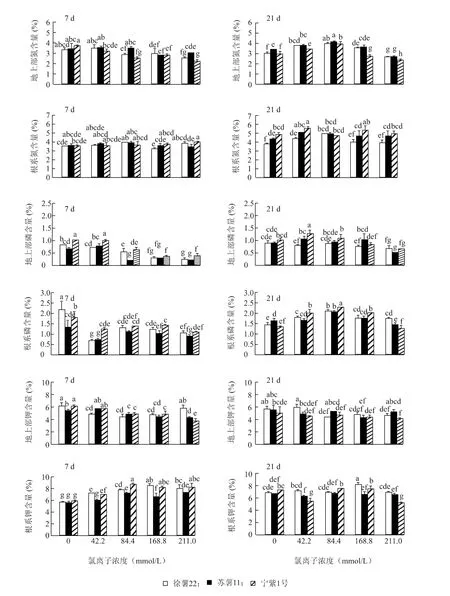
图4 不同浓度外源氯对甘薯幼苗地上部和根系N 含量、地上部和根系P 含量、地上部和根系K 含量的影响Fig.4 Effects of different concentrations of exogenous chlorine on nitrogen content in shoot and root,phosphorus content in shoot and root,potassium content in shoot and root of sweet potato seedlings
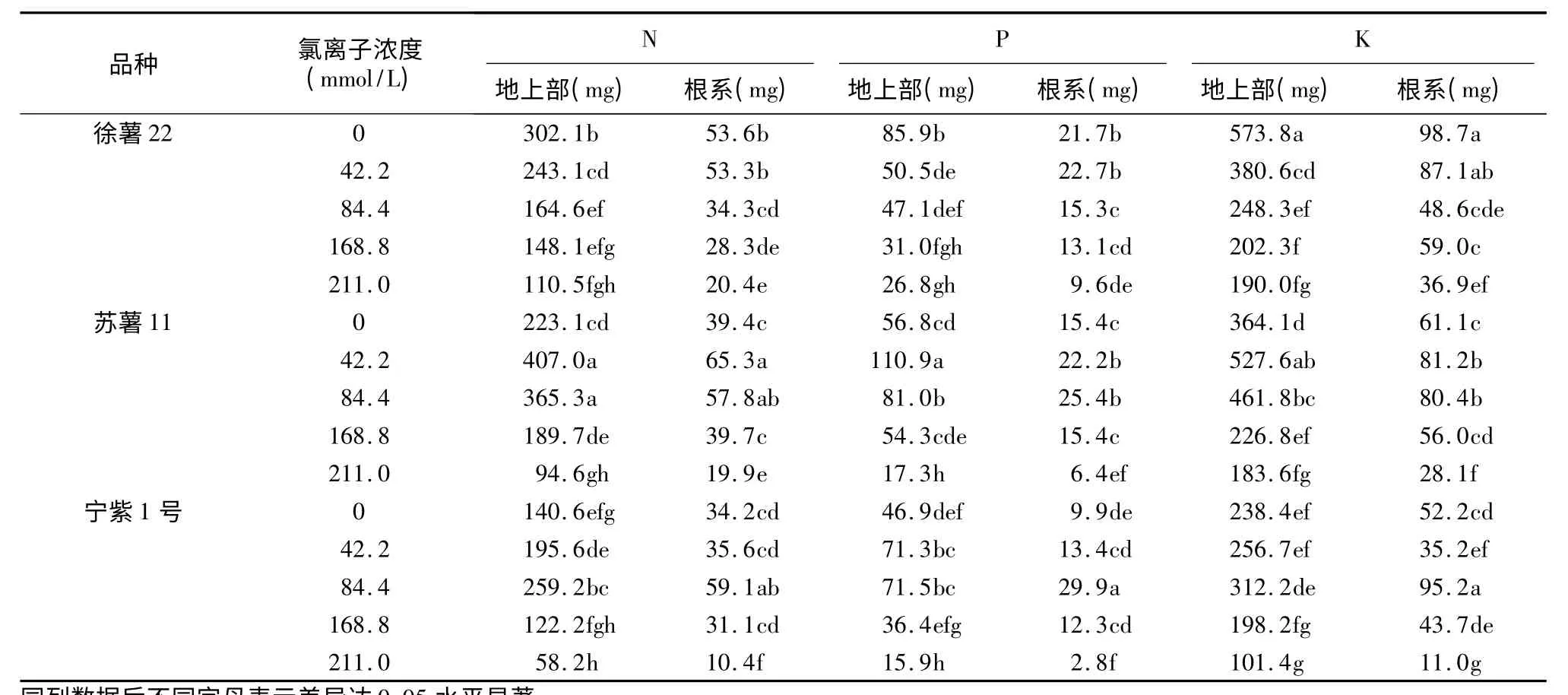
表1 外源氯处理21 d 对甘薯幼苗N、P、K 累积值的影响Table 1 Effects of exogenous chlorine treatment for 21 d on NPK-accumulations in sweet potato seedlings
许多研究结果表明盐胁迫会造成植株光抑制和光损伤[21],从而导致活性氧(ROS)的产生。活性氧能通过氧化蛋白质、核酸及脂质改变细胞内代谢,在这些过程中出现了脂质过氧化现象[22]。丙二醛(MDA)为多不饱和脂肪酸的分解产物,其含量水平通常被当做脂质过氧化程度的指标[23]。通常人们认为MDA 含量越高脂质过氧化程度越大,也即细胞氧化受损程度越严重。但有研究结果表明MDA可以触发相关基因的表达,从而激活植株对非生物胁迫早期防御响应[24]。Tounekti 等[6]也提出叶片中MDA 短暂的上升现象,可能是迷迭香对盐胁迫的一种保护机制,而不会造成植株损伤。本研究中,外源氯处理21 d 各品种MDA 含量随Cl-浓度上升而增加,MDA 含量徐薯22>苏薯11>宁紫1 号。而甘薯幼苗叶绿素含量在低浓度(Cl-浓度≤84.4 mmol/L)处理下显著高于对照,在该浓度范围内甘薯可以维持其生长以及叶绿素含量,表明它可以抵御逐渐增强的氧化胁迫,避免一些不可逆的伤害。
3.2 外源氯对甘薯幼苗氮代谢及营养吸收的影响
植物中的硝酸盐(NO-3)储存在液泡里,在细胞质中被硝酸还原酶(NR)降解成亚硝酸盐;亚硝酸盐进入叶片的叶绿体或非绿色组织的质体中,通过亚硝酸还原酶(NiR)还原成铵,之后再通过一系列代谢反应转化成蛋白质[25]。植物硝酸还原酶受很多因素的调节,例如NO-3、光照、碳源、叶绿体功能等[26]。本试验中外源氯处理21 d 时徐薯22 和苏薯11 在低浓度(Cl-浓度≤84.4 mmol/L)处理下NR活性上升,宁紫1 号在42.2 mmol/L 处理下NR活性高于对照;各品种含量在Cl-浓度≤42.2 mmol/L 处理下高于对照。这表明在42.2 mmol/L处理下可能由于含量升高激活NR基因的表达提高NR活性,在更高浓度(84.4 mmol/L)处理下被NR分解,从而浓度降低。
有研究结果表明,Cl-会降低NR活性[27],抑制的吸收[28]。郑青松等[29]的研究结果表明一定范围的外源氯处理,可以有效提高向日葵的氮素利用率。本试验对甘薯全氮的测定结果显示,根系氮含量高于地上部,且外源氯处理21 d 三个品种地上部与根系含氮量均有不同程度的上升。植株全氮的测定采用H2SO4-H2O2-扩散法,测得的是植株中有机氮和铵态氮[30]。甘薯NR活性和含量在42.2 mmol/L 处理下高于对照,而植株全氮在42.2 ~168.8 mmol/L 处理下均呈上升趋势,表明幼苗内的可能进一步转化成了铵或有机氮。
Chapagain 等[31]用不同浓度KCl 和MgCl2处理西红柿106 d,结果显示植株P 含量降低,但在146 d处理下P 含量与对照无显著差异。本试验中Cl-浓度≤168.8 mmol/L 处理21 d 各品种根系P 含量均高于对照,且宁紫1 号P 含量高于另外两个品种。三个品种对于钾的吸收根系高于地上部,且品种间差异不明显,说明外源氯对钾吸收影响不大。将外源氯处理21 d 各品种间N、P、K 累积量进行方差分析,结果显示徐薯22 受Cl-影响累积量逐渐降低,苏薯11 和宁紫1 号则在42.2 mmol/L 和84.4 mmol/L 处理下显著高于对照,这与甘薯幼苗鲜质量测定结果相同。
[1] MUNNS R,TESTER M.Mechanism of salinity tolerance[J].Annual Review of Plant Biology,2008,59:651-681.
[2] GAO Y,LI D Y,CHEN Y J.Differentiation of carbonate,chloride,and sulfate salinity responses in tall fescue[J].Scientia Horticulturae,2012,139(18):1-7.
[3] COLLA G,ROUPHAEL Y,REA E,et al.Grafting cucumber plants enhance tolerance to sodium chloride and sulfate salinization[J].Scientia Horticulturae,2012,135(24):177-185.
[4] NAVARRO J M,GARRIDO C,CARVAJAL M,et al.Yield and fruit quality of pepper plants under sulphate and chloride salinity[J].Journal of Horticultural Science&Biotechnology,2002,77:52-57.
[5] MOYA J L,TADEO F R,GÓMEZ-CADENAS A,et al.Transmissible salt tolerance traits identified through reciprocal grafts between sensitiveCarrizoand tolerantCleopatra citrusgenotypes[J].Journal of Plant Physiology,2002,159(9):991-998.
[6] TOUNEKTI T,VADEL A M,OÑATE M,et al.Salt-induced oxidative stress in rosemary plants:damage or protection?[J].Environmental and Experimental Botany,2011,71(2):298-305.
[7] 郭小丁,邬景禹,钮福祥,等.在滨海盐渍地鉴定甘薯品种耐盐性[J].江苏农业科学,1993(6):17-18.
[8] 李百伟,孙存华,王 丹.CaCl2对NaC1 胁迫下甘薯幼苗叶片渗透调节物质的影响[J].江苏农业科学,2012,40(10):84-85.
[9] 鲁剑巍,陈兰祥,许幼生,等.甘薯施用钾肥研究[J].湖北农业科学,1998(6):41-44.
[10] WHITE P J,BROADLEY M R.Chloride in soils and its uptake and movement within the plant:a review[J].Annals of Botany,2001,88:967-988.
[11] XU G H,MAGEN H,TARCHITZKY J,et al.Advances in chloride nutrition of plant[J].Advances in Agronomy,2000,68:97-110.
[12] 侯庆山,庄倩梅.氯化钾对夏甘薯产质量和土壤性质的影响[J].土壤,1995,27(4):213-215.
[13] 刘汝亮,李友宏,王 芳,等.两种钾源对马铃薯养分积累和产量的影响[J].西北农业学报,2009,18(1):143-146.
[14] KINGSBURY R W,EPSTEIN E.Salt sensitivity in wheat[J].Plant Physiology,1986,80:651-654.
[15] AZEVEDO N A D,PRISCO J T,ENÉAS-FILHO J,et al.Effect of salt stress on antioxidative enzymes and lipid peroxidation in leaves and roots of salt-tolerant and salt-sensitive maize genotypes[J].Environmental and Experimental Botany,2006,56(1):87-94.
[16] 葛文婷,金喜军,马春梅,等.大豆硝酸还原酶活性及其与施氮关系的研究[J].核农学报,2011,25(5):1036-1041.
[17] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:123-124.
[18] MELVIN S G,LU G Q,ZHOU W J.Genotypic variation for potassium uptake and utilization efficiency in sweet potato(Ipomoea batatasL.)[J].Field Crops Research,2002,77(1):7-15.
[19] GARCÍA-SÁNCHEZ F,JIFON J L,CARVAJAL M,et al.Gas exchange,chlorophyll and nutrient contents in relation to Na+and Cl-accumulation in‘Sunburst’mandarin grafted on different rootstocks[J].Plant Science,2002,162(5):705-712.
[20] 胡小婉,刘兆普,郑青松,等.外施氯对油菜幼苗生长和光合特征影响的研究[J].植物营养与肥料学报,2012,18(4):932-940.
[21] BELKHODJA R,MORALES F,ABADIA A,et al.Chlorophyll fluorescence as a possible tool for salinity tolerance screening in barley (Hordeum vulgareL.)[J].Plant Physiology,1994,104(2):667-673.
[22] OSMOND B,BADGER M,MAXWELL K,et al.Too many photons:photorespiration,photoinhibition and photooxidation [J].Trends in Plant Science,1997,2:119-120.
[23] MITTLER R.Oxidative stress,antioxidants and stress tolerance[J].Trends in Plant Science,2002,7(9):405-410.
[24] WEBER H,CHÉTELAT A,REYMOND P,et al.Selective and powerful stress gene expression inArabidopsisin response to malondialdehyde[J].The Plant Journal,2004,37(6):877-888.
[25] 张珍华,徐恒玉.植物氮素同化过程中相关酶的研究进展[J].北方园艺,2011(20):180-183.
[26] CRAWFORD N M,WILKINSON J Q,LABRIE S T.Control of nitrate reduction in plants[J].Australian Journal of Plant Physiology,1992,19(4):377-385.
[27] SAVVAS D,LENZ F.Influence of NaCl concentration in the nutrient solution on mineral composition of eggplants grown in sand culture[J].Angew Bot,1996,70:124-127.
[28] FLORES P,BOTELLA M A,MARTÍNEZ V,et al.Ionic and osmotic effects on nitrate reductase activity in tomato seedlings[J].Journal of Plant Physiology,2000,156(4):552-557.
[29] 郑青松,杨文杰,刘兆普,等.外源氯处理对向日葵幼苗生长、养分吸收及植株硝态氮含量的影响[J].植物营养与肥料学报,2007,13(6):1161-1165.
[30] 鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:308-311.
[31] CHAPAGAIN B P,WIESMAN Z.Effect of potassium magnesium chloride in the fertigation solution as partial source of potassium on growth,yield and quality of greenhouse tomato[J].Scientia Horticulturae,2004,99(3-4):279-288.

