“活性”/可控自由基聚合在蛋白质杂化体制备中的应用研究进展
赵伟刚,鹿振武,逯盛芳,何乃普
(兰州交通大学 功能高分子研究所,甘肃 兰州 730700)
蛋白质-高分子聚合物的耦合物被广泛应用在医药、生物技术和纳米技术中。聚合物以共价键结合到蛋白质上,可提高蛋白质的稳定性,溶解性和生物相容性。此外,给合成聚合物赋予新的属性,如自组装和相位行为[1-3]。
基于修饰蛋白质赖氨酸侧链的蛋白质-高分子结合体,例如蛋白质-聚乙二醇(PEG)结合体,被广泛应用于临床医疗,生物亲和力分离,微蛋白分析和捕获,分子传感器,以及作为交换器来控制蛋白质活性等[4-8]。该聚合物在通常情况下是可溶于水的[4],当受到外部刺激,例如光照、温度和pH 值,能够发生构象变化从而实现相分离。附着的聚乙二醇(PEG)蛋白质或肽的结合物在医疗上的应用,被称为聚乙二醇化,是一个应用非常成功的例子,其产生了几个好处包括增加的生物利用度和血浆半衰期,降低免疫原性,减少蛋白水解,增强溶解性和稳定性[9]。
“活性”/可控自由基聚合(LRP)技术是分子设计的重要途径[10-15],在制备窄的分子量分布(MWD)聚合物,分子量(MW)符合理论计算值的聚合物,以及各种嵌段共聚物和复杂大分子结构等方面有广泛应用。“活性”/可控自由基聚合反应制备聚合物-蛋白质生物结合体的研究领域主要集中在利用引发转移终止剂法(Iniferter)、氮氧自由基聚合(NMP)、原子转移自由基聚合(ATRP)和可逆加成-断裂链转移活性自由基聚合(RAFT)4 种“活性”/可控自由基聚合体系来合成聚合物-蛋白质生物结合体[9],以及对生物结合体共价键连接方式及所需的官能性引发剂的研究。
1 “活性”/可控自由基聚合物接枝蛋白质
“活性”/可控自由基聚合结合了活性聚合与自由基聚合的各种优势,美国科学家Szwarc[16-18]在1956 年提出了活性聚合的概念,自从有了“活性”/可控自由基聚合后,高分子领域得到了突飞猛进的发展,因为“活性”/可控自由基聚合与传统自由基聚合相比,具有无终止、无转移、引发速率远远大于链增长速率等特点,能更好地实现对分子结构的控制,是实现分子设计、合成具有特定结构和性能聚合物的重要手段。但离子型活性聚合反应条件比较苛刻、适用单体较少,且只能在非水介质中进行,导致工业化成本居高不下,难以广泛用于工业化。鉴于活性聚合和自由基聚合各自的优缺点,高分子合成化学家们联想到将二者结合,即“活性”/可控自由基聚合[19-20]。目前,将“活性”/可控自由基聚合应用到蛋白质结合物的研究很多,已成为医学界与高分子界交叉的热门研究。
1.1 Iniferter 在蛋白质-高分子结合体制备中的应用
引发转移终止剂法(Iniferter)是指那些同时集引发剂、转移剂和终止剂作用于一身的物质[21]。1982 年Otus 发现Iniferter 以来,其文献报道较少,其分类很多,按其引发类型主要分为光引发和热引发两类,据相关文献报道[22]其光引发Iniferter 比热引发Iniferter 更有效。引发转移终止剂引发的活性自由基聚合机理是,当体系中稳定存在的自由基的浓度远大于链自由基的浓度时,促使平衡正向移动,形成的休眠种大幅度降低链自由基的浓度,以减少链终止反应。Iniferter“活性”自由基聚合的特点是聚合产物的分子量随聚合时间的增加而增大,分子量随单体转化率的增大而增大;当转化率不大于40%时,聚合反应的转化率和分子量随反应时间成较好的线性关系,但分子量分布可控性不好,分子量分布(PDI)一般在2.0 左右[23]。目前已经合成了许多结构新颖的引发转移终止剂,并将其用于制备端基功能化聚合物、遥爪聚合[24]、大分子单体[25-26]、嵌段和接枝共聚物[27]等。近十年来,这类研究在基因转导剂、药物载体等领域得到了迅速发展[28]。
Wootthikanokkhan J[28]用N,N-二乙基二硫代氨基甲酸苄酯(BDC)为引发剂,先聚合异戊二烯单体;以此为巨型引发剂与MMA 光聚合制备了线型PI/PMMA 两嵌段共聚物[29];以自合成的1,3,5-(N,N-二甲基二硫代氨基甲酸)-2,4,6-均苯三甲基苄酯为多臂引发剂,合成了星型二嵌段共聚物PI/PMMA,PI/PS 和星型三嵌段共聚物PI/PMM/PS。合成的星型多嵌段共聚物通过引入生物活性基团或环境友好单体可以用作潜在药物载体。Miyamoto等[30-31]首先也用N,N-二乙基二硫代氨基甲酸苄酯(BDC)为光引发剂,聚合单体2-甲基丙烯酰氧基乙基磷酰胆碱(MPC),在N,N-二环己基碳酰亚胺(DCC)存在的条件下,合成了末端带有羧基的MPC的共聚物PMPC-COOH(如图1 所示)而将木瓜蛋白酶固定在PMPC-COOH 上。对比实验发现:未结合的木瓜酶在一周内失去活性,用PEO 键合的木瓜蛋白酶的活性一周后降低50%,而用PMPC-COOH 修饰的木瓜蛋白酶的活性4 周后无降低。所以,可以通过控制PMPC-COOH 的摩尔质量和对酶的修饰程度来稳定酶的活性,得到具有良好生物相容性的蛋白质-高分子结合体。Ishihara 等[31-32]用光引发聚合的PMPC 接枝得到水溶性纤维素MGC,用MGC 修饰的中空纤维微透析探头(mi-crodialysis probe)长期植入体内不会引发明显的炎症反应,表现出良好的生物相容性和稳定性。Bai 等[31,33]将具有高灵敏度的电化学发光物质固定在光引发聚合的PMPC 材料上,动物实验表明这种发光装置具有良好的抗生物污染性能,可以用于研制各种与生物监测有关的传感器。
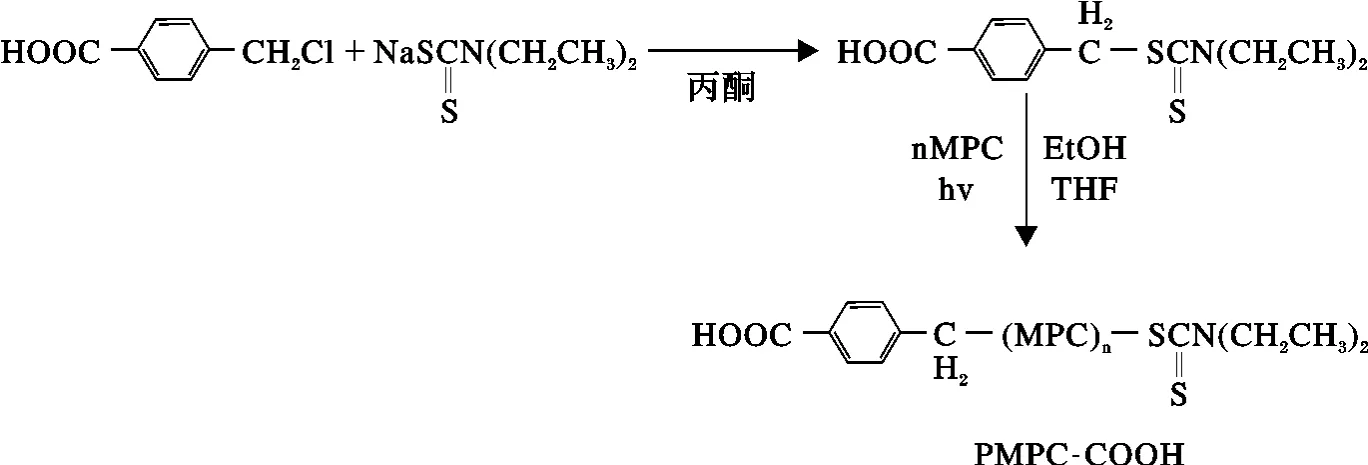
图1 PMPC 的Iniferter 活性聚合Fig.1 PMPC’s Iniferter living polymerization
1.2 NMP 在蛋白质-高分子结合体制备中的应用
NMP 活性自由基聚合属于非催化性体系,是利用氮氧稳定自由基来控制自由基聚合[34]。其机理是利用氮氧自由基与链增长自由基之间的结合和可逆分解来实现单体的活性可控聚合,NMP 典型的引发剂是2,2,6,6-四甲基哌啶氮氧自由基(TEMPO),TEMPO 作为稳定自由基,只与增长自由基发生偶合形成共价键,而这种共价键在高温条件下又可以分解产生增长自由基和稳定自由基,通过这种可逆的链终止反应实现了单体(M)的活性自由基聚合。
Rutger 等[35-37]利用N-羧酸酐(NCA)开环后形成一个双头引发剂,运用NMP 法聚合成多肽-聚合物结合物,其反应如图2 所示。研究表明,在利用这种合成方法合成由多肽组成的嵌段共聚物的过程中,每个链段中多肽的化学计量和区域选择性是可控的。
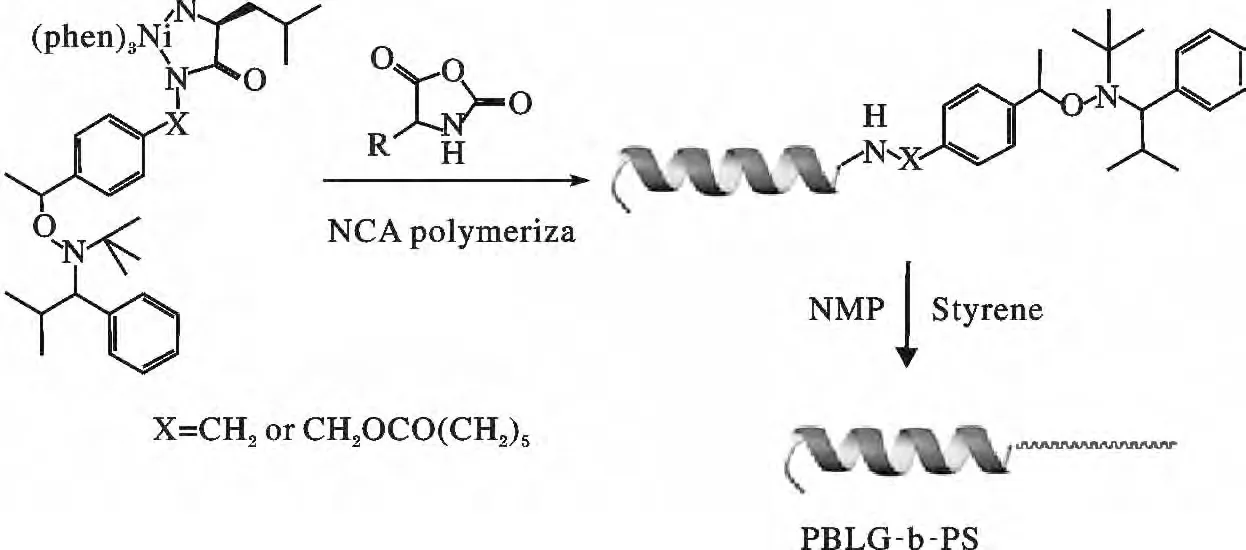
图2 通过NCA 聚合生物聚合物的NMP 聚合形成多肽嵌段共聚物Fig.2 A block copolymer was obtained by polymerization of NCA polypeptide biopolymers polymerized to form NMP
Chenal 等[38]利用带有N-羟基琥珀酰亚胺基团的链段(SG1)的烷氧基胺为引发剂,实现了聚甲基丙烯酸乙二醇甲基醚酯(MePEGMA)的NMP 聚合,得到了一种基于氮氧SG1α-功能化的带有聚乙二醇侧链的梳状聚甲基丙烯酸酯的聚乙二醇化聚合物。另外,以溶菌酶作为模型蛋白与其结合,进一步证明了上述合成路径的高效性。NMP 在活性聚合反应中虽然分子量控制很好,可是其反应温度较高,合成过程较复杂,产率低,并且氮氧自由基的价格昂贵等这些因素限制了NMP 活性自由基聚合的广泛研究。
1.3 ATRP 在蛋白质-高分子结合体制备中的应用
ATRP 法是1995 年由王锦山和Matyjaszewski[39-41]发现的。ATRP 聚合反应以过渡金属作为催化剂,使卤原子实现可逆转移,包括卤原子从烷基卤化物到过渡金属络合物(盐),再从过渡金属络合物(盐)转移至自由基的反复循环的原子转移过程,伴随着自由基活性(增长链自由基)种和大分子有机卤化物休眠种之间的可逆转换平衡反应,从而控制自由基活性种保持较低的浓度,减少了增长链自由基之间的不可逆双分子终止副反应,使聚合反应得到有效的控制。但其缺点就是后处理比较繁琐,不易从产物中提取出Cu 离子。
ATRP 自发现以来,由于其反应条件温和,在室温,水溶剂中可反应,所以这方面的聚合物和蛋白质结合体的研究大量而详尽。ATRP 聚合制备生物蛋白质或肽结合物时,需要聚合物末端(或中间)链上有一个能与蛋白质上的胺基(─NH2)或巯基(─SH)特异性结合的功能性官能团。而这些功能基团是通过使用一些含这些功能基团的引发剂/转移剂来接枝到聚合物末端(或中间)的。在ATRP 中具有功能性基团的引发剂主要有以下图3 所示的这些。
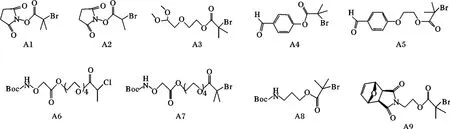
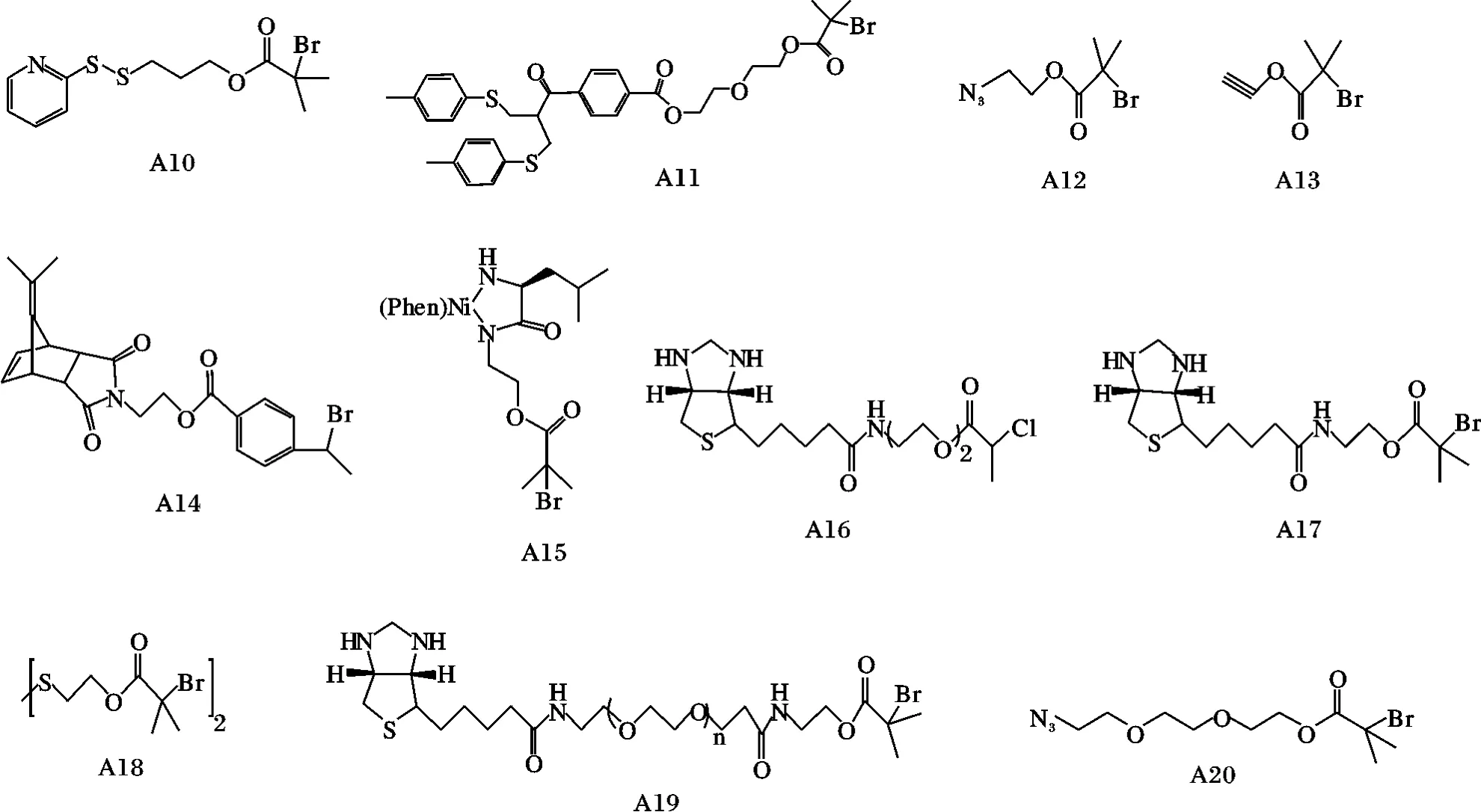
图3 ATRP 中具有功能性的基团的引发剂[37]Fig.3 The functional initiator groups of ATRP[37]
1.3.1 与蛋白质胺基相接形成聚合物-蛋白质结合体 Haddleton 等研究组[42]利用N-羟基琥珀酰胺引发剂(A1,A2,图3)引发单体聚乙烯基乙二醇甲基醚(PEGMA)的ATRP 聚合,而后将聚合物PEGMA以共价键接枝到蛋白质上,如图4 所示,并通过SDS-PAGE 电泳分析得知,每个蛋白质上大约共轭了6 ~7 个高分子链。
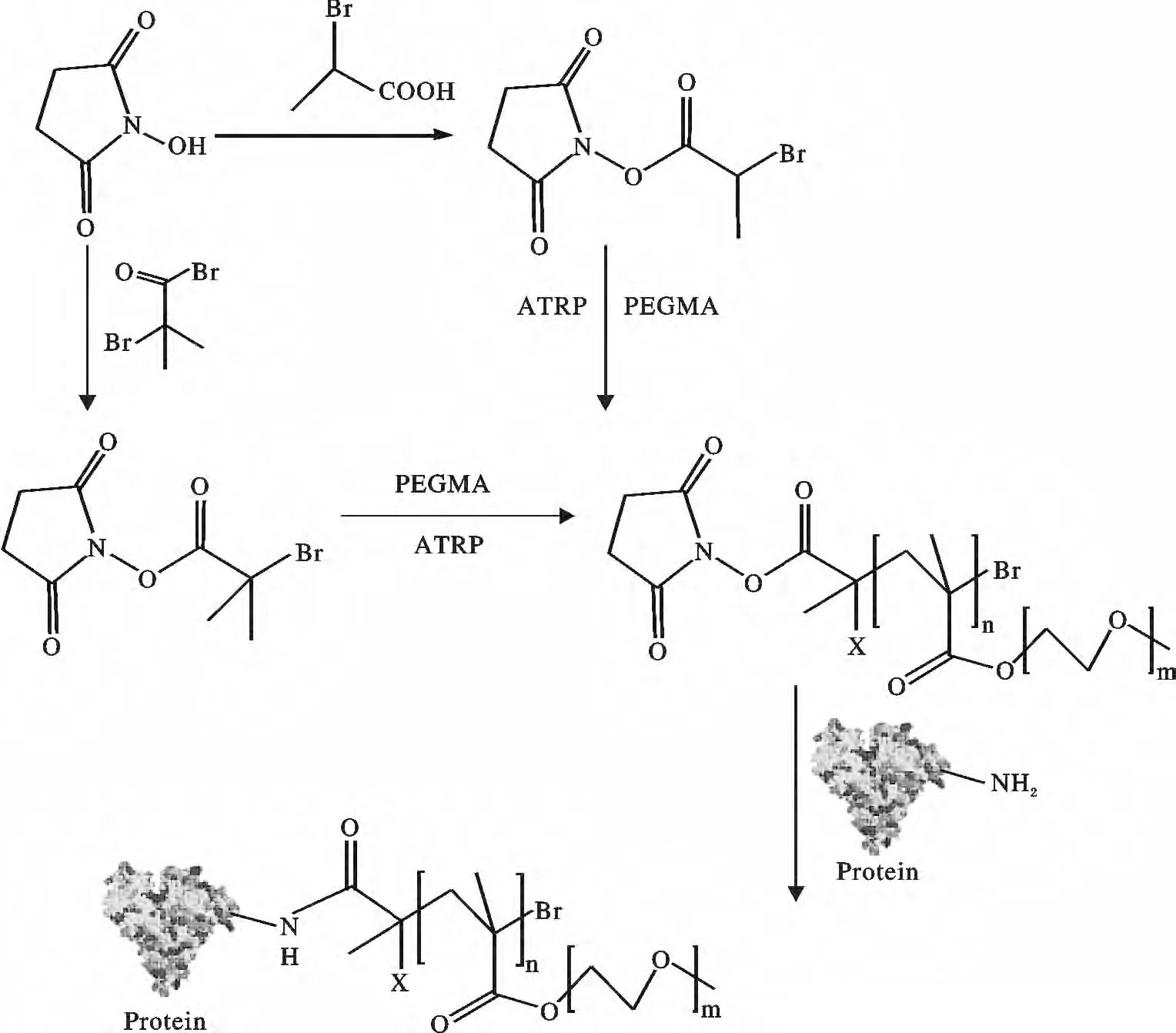
图4 ATRP 聚合物的N-羟基琥珀酰胺与蛋白质的胺基偶联Fig.4 The polymer of ATRP amine of N-hydroxysuccinimide and protein coupling
Haddleton 等研究组[43-44]又利用一个缩酮保护醛基的引发剂(A3,图3),通过ATRP 的方法实现了PEGMA 的聚合,然后又在酸性条件下(pH=5 或6)将聚合物端基的缩酮水解掉,从而得到端基醛,而此端基醛又能和蛋白质的胺基发生偶联,从而实现了聚合物-蛋白质的结合,如图5 所示。
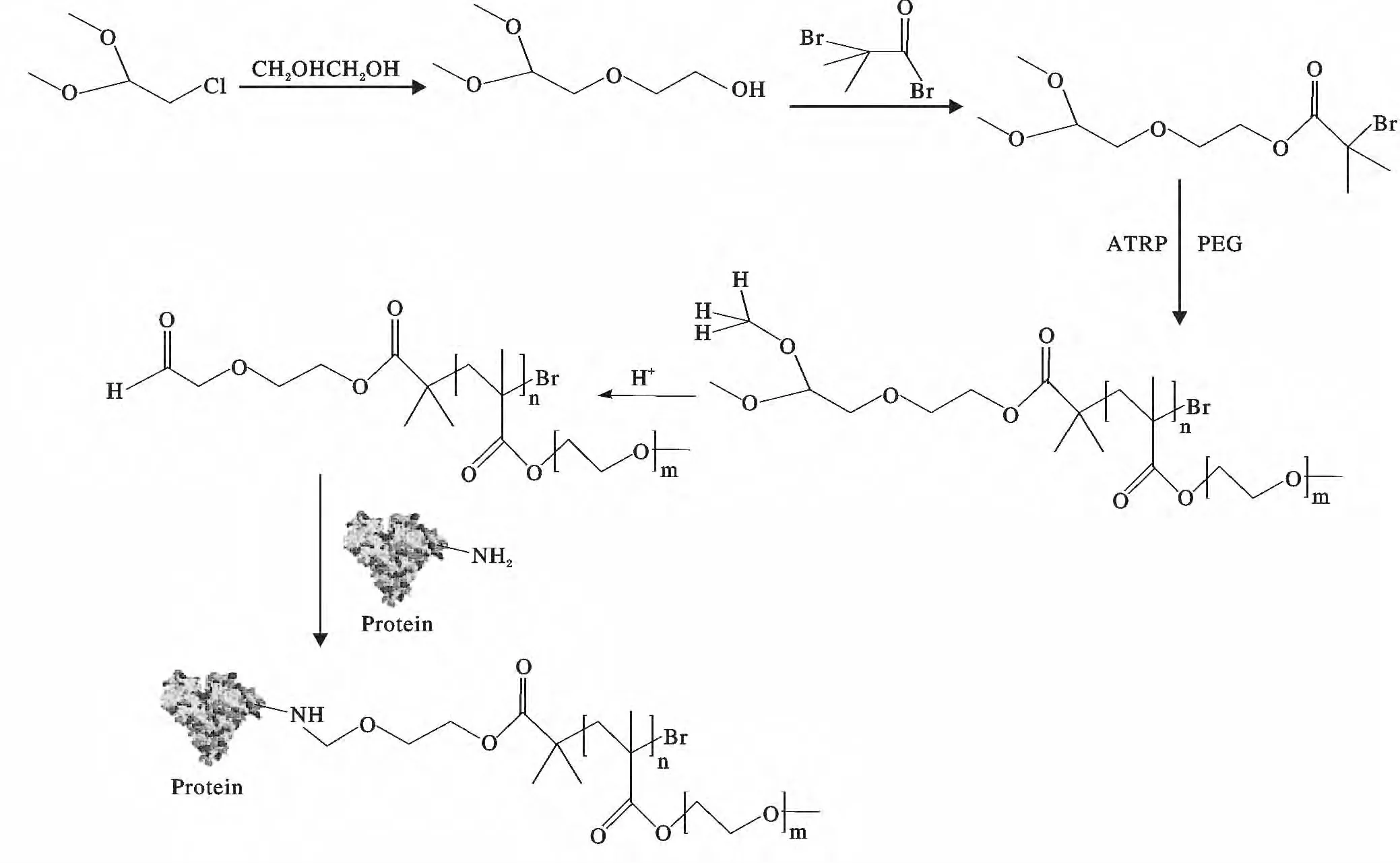
图5 ATRP 聚合物的醛基与蛋白质的胺基偶联Fig.5 The polymer of ATRP of aldehyde and protein coupling
Hui Jiang 等[45]先通过ATRP 制得含有羧基的聚丙烯酸聚合物刷,而─COOH 在中性的pH 值和室温条件下可以很容易地与N-羟基琥珀酰亚胺(NHS)反应形成琥珀酰亚胺酯,琥珀酰亚胺酯和蛋白质的胺基耦合形成蛋白质-聚合物刷。
1.3.2 与蛋白质巯基相接形成聚合物-蛋白质结合体在与蛋白质巯基相接的这种蛋白质-高分子结合体在制备过程中,通常会用到马来酰亚胺作为ATRP 引发剂,但是不能直接用带有马来酰亚胺基团的ATRP 引发剂引发聚合单体,因为直接使用会同时引发马来酰亚胺中可聚合部分发生聚合作用使其失去接枝蛋白质巯基的活性。所以通常在这种反应中有两种设计方案:①高聚物接枝蛋白质(“grafting to”)法[46-48]:用叔丁氧羰保护的带有氨基的引发剂(A8,图3)先与单体发生ATRP 聚合,其聚合物中叔丁氧羰保护的氨基再与3-马来酰亚胺丙酰氯在N,N-二异丙基乙基胺的存在下通过酰胺化反应引入马来酰亚胺部分,或用呋喃保护的带有马来酰亚胺基团的引发剂(A9,图3)先与单体发生ATRP 聚合,然后去除呋喃的保护获得马来酰亚胺部分,再与蛋白质巯基耦合相接。②蛋白质引发剂引发ATRP聚合(“grafting from”)法[49-50]:先利用蛋白质巯基与马来酰亚胺引发剂反应,生成蛋白质引发剂,再进行ATRP 反应,其反应机理见图6。
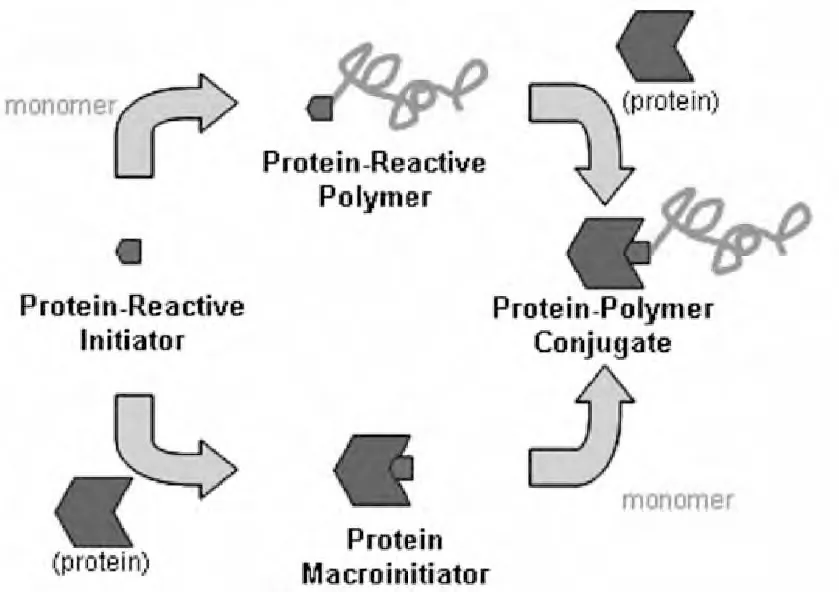
图6 “grafting to”和“grafting from”的反应机理Fig.6 The reaction mechanisms of“grafting to”and“grafting from”
Kelly Velonia 等[46]利用呋喃保护的马来酰亚胺引发剂(A9,图3)通过ATRP 聚合形成端基带有呋喃保护的马来酰亚胺的聚合物,反应掉呋喃的保护,得到端基带有马来酰亚胺的聚合物,再与蛋白质巯基通过共价键耦合,形成蛋白质-高分子的结合物,接着通过“点击”化学(“click”)在蛋白质-聚合物的结合物上形成1,2,3-三唑。反应见图7。
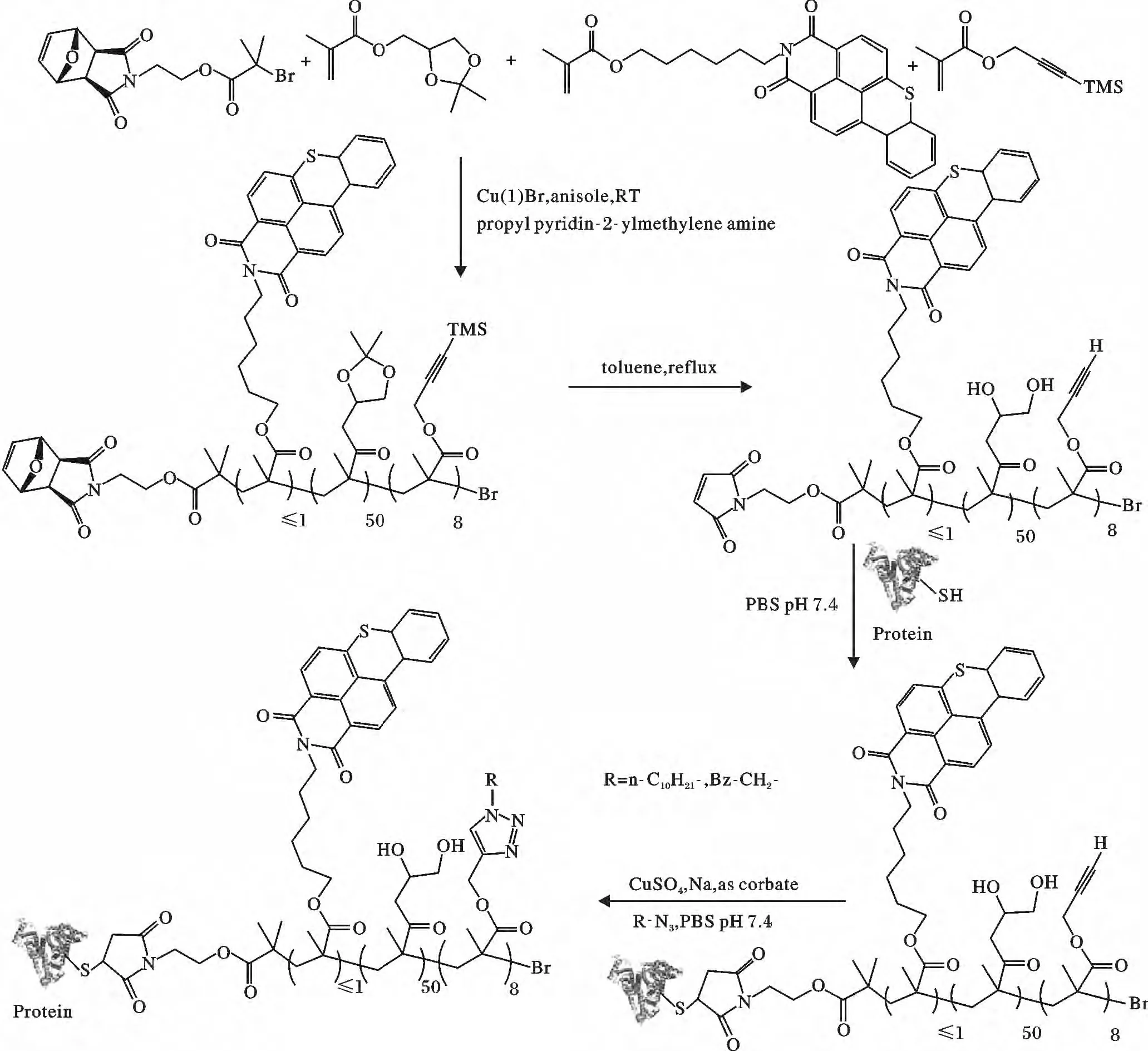
图7 “grafting to”的ATRP 聚合物偶联蛋白质巯基Fig.7 The polymer by ATRP and the thiol group of protein was conjugated by“grafting to”
Maynard 等[50]利用马来酰亚胺先通过与蛋白质巯基偶联接枝到蛋白质上形成蛋白质引发剂,随后利用蛋白质引发剂引发单体N-异丙基丙烯酰胺(NIPAAm)进行ATRP 聚合,从而生成蛋白质-高分子的结合体,见图8。以蛋白质作为引发剂合成聚合物-高分子生物结合体的最大的优点是不需要多步反应就能实现蛋白质与聚合物结合。
1.4 RAFT 在蛋白质杂化体制备中的应用
1998 年Rizzardo 等[51-53]将双硫酯类衍生物加入到传统的自由基体系中,通过链段的加成和断裂动态平衡实现活性可控的[54-55]。
近年来,RAFT 的研究比较成熟,发展迅速,通常采用单官能度、双官能度和多官能度的双硫代酯类化合物作链转移剂,从而成功地制备了嵌段[56],接枝[57],星型[58]高聚物。由于RAFT 聚合反应条件温和,后处理简单,产物的分子量分布较窄,并可合成复杂结构的聚合物。近年来特别是利用RAFT活性聚合制备蛋白质杂化体结合物成为科学研究的一个广阔领域。但其所用链转移剂双硫酯的制备过程相对复杂的缺点使这一反应略慢于ATRP 活性聚合的研究。在RAFT 活性聚合中引发聚合反应又与蛋白质耦合接枝的官能化的引发剂见图9,这些引发剂都是与蛋白质的巯基以共价键耦合相接。
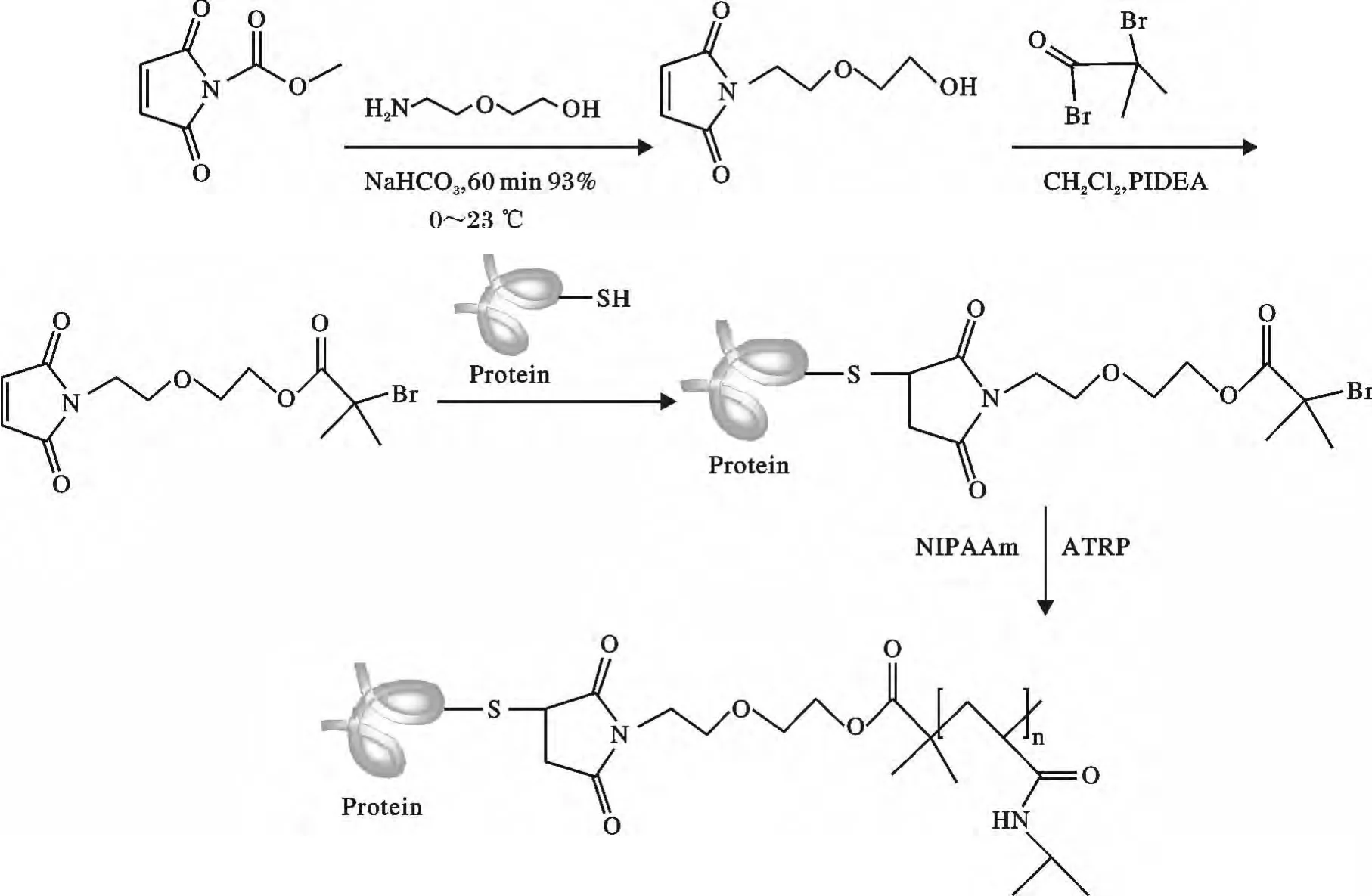
图8 “grafting from”的ATRP 聚合物偶联蛋白质巯基Fig.8 The conjugate polymer and the thiol group of protein by“grafting from”ATRP

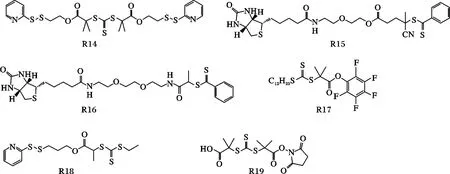
图9 RAFT 中具有功能性的基团的引发剂[37]Fig.9 The functional initiator groups of RAFT
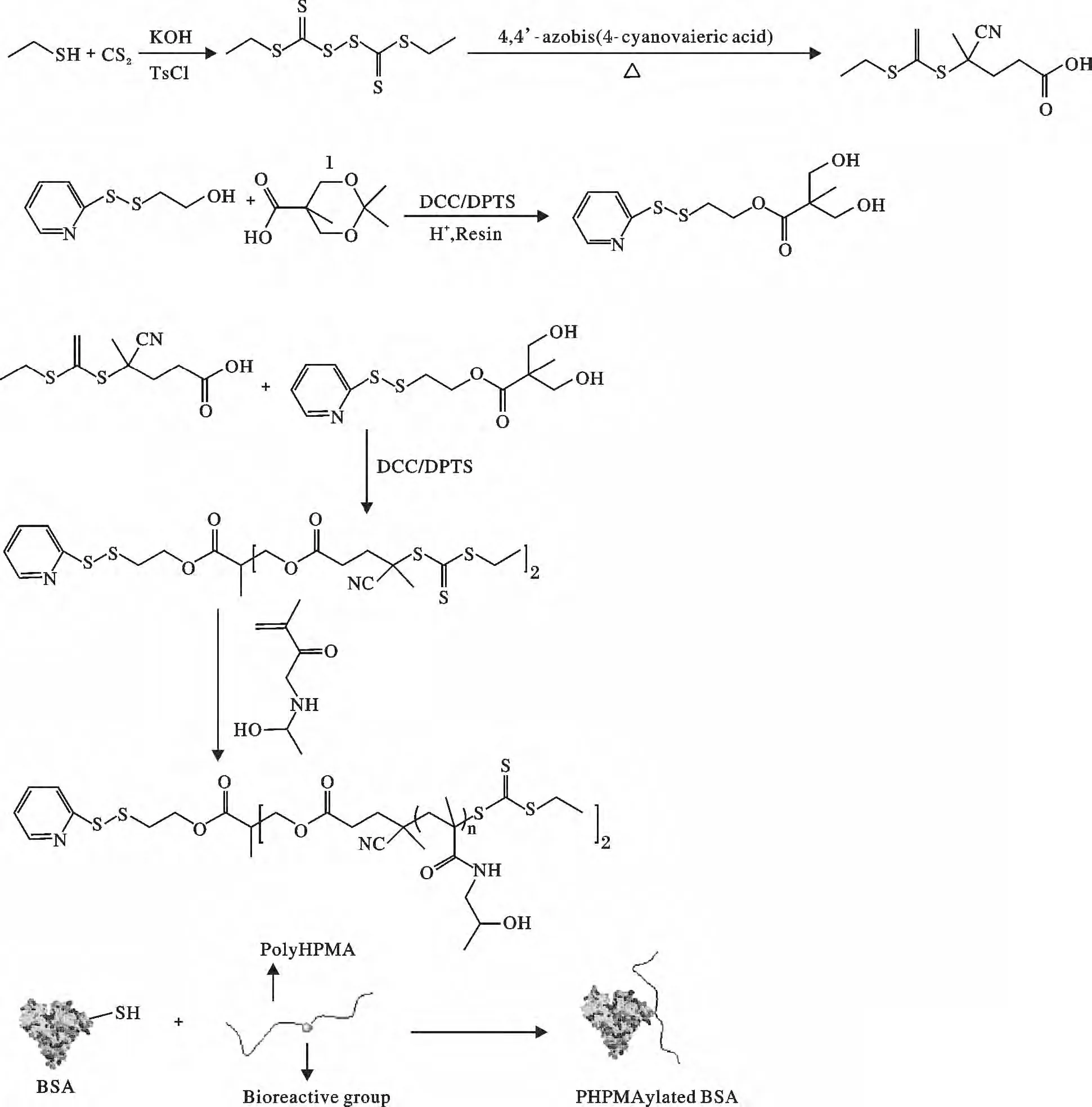
图10 利用“grafting to”法的RAFT 聚合物接枝蛋白质Fig.10 Grafted the polymer to protein by RAFT“grafting to”
1.4.1 “grafting to”的RAFT 聚合物-蛋白质结合体
Davis 等[59-60]研究组以吡啶二硫化RAFT 的引发剂(R11,图9)引发单体N-(2-羟丙基)甲基丙烯酰胺(HPMA)进行RAFT 活性聚合,形成聚合物P(HPMA),但在此聚合物中它不同于ATRP 聚合所生成的聚合物的是它的接枝蛋白质的官能化的吡啶二硫基团在此聚合物的中间,见图10。
1.4.2 “grafting from”的RAFT 聚合物-蛋白质结合体 Sumerlin 等[61]运用带有马来酰亚胺基团的RAFT 引发剂先与牛血清白蛋白(BSA)的巯基以共价键相耦合形成蛋白质的RAFT 引发剂(R13,图9),接着引发RAFT 活性聚合单体N-异丙基丙烯酰胺(NIPAM)聚合生成蛋白质高分子结合体,见图11。
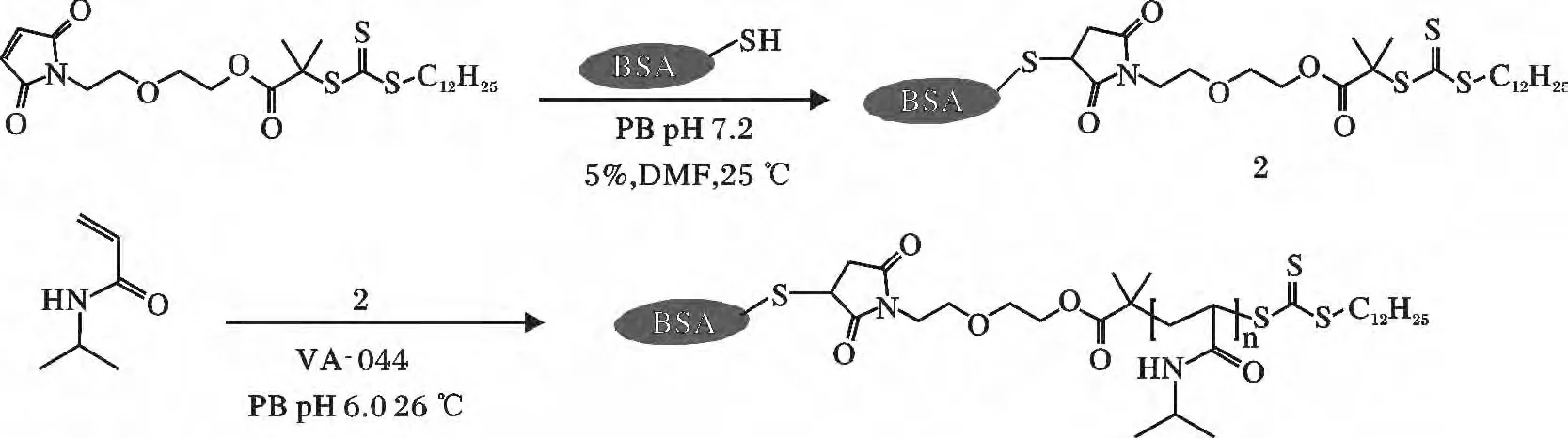
图11 利用“grafting from”法的RAFT 聚合物接枝蛋白质Fig.11 Grafted the polymer to protein by RAFT“grafting from”
2 结论
“活性”/可控自由基聚合技术集自由基聚合与活性聚合的优点于一体,能够设计制备符合理论计算值的分子量(MW)和窄的分子量分布(MWD)的聚合物,这一优点使得“活性”/可控自由基聚合被广泛应用在高分子化合物和生物高分子材料等领域。近年来,特别是对ATRP 和RAFT 这两种“活性”/可控自由基聚合的研究相对较多。ATRP 反应条件简单,制备容易,但是由于产物中除去催化剂铜离子较困难,所以这方面的研究朝着无铜化且具有生物相容性催化剂的方向发展。RAFT 虽然反应条件温和且产物处理简单,但是RAFT 的二硫引发剂的制备困难成为它致命的缺点,所以RAFT 引发剂制备的研究有待发展。
[1] Abuchowski A,McCoy J R,Palczuk N C,et al. Effect of covalent attachment of polyethylene glycol on immunogenicity and circulating life of bovine liver catalase[J].Biol Chem,1977,252(11):3582-3586.
[2] Maynard H D,Heredia K L. Synthesis of protein-polymer conjugates[J].Org Biomol Chem,2007,5(1):45-53.
[3] Abuchowski A,Es van T,Palczuk N C,et al.Alteration of immunological properties of bovine serum albumin by covalent attachment of polyethylene glycol[J]. J Biol Chem,1977,252(11):3578-3581.
[4] Hoffman A S. Bioconjugates of intelligent polymers and recognition proteins for use in diagnostics and affinity separations[J].Clin Chem,2000,46(9):1478-1486.
[5] Stayton P S,Hoffman A S,El-Sayed M,et al. Intelligent biohybrid materials for therapeutic and imaging agent delivery[J].Proc IEEE,2005,93(4):726-736.
[6] Alarcon C D H,Pennadam S,Alexander C. Stimuli responsive polymers for biomedical applications[J]. Chem Soc Rev,2005,34(3):276-285.
[7] Hoffman A S,Stayton P S,Bulmus V,et al. Really smart bioconjugates of smart polymers and receptor proteins[J].J Biomed Mater Res,2000,52(4):577-586.
[8] Zarafshani Z,Obata T,Lutz J F.Smart PEGylation of trypsin[J].Biomacromolecules,2010,11(8):2130-2135.
[9] Veronese F M.Peptide and protein PEGylation:A review of problems and solutions[J]. Biomaterials,2001,22(5):405-417.
[10]Hawker C J,Bosman A W,Harth E.New polymer synthesis by nitroxide mediated living radical polymerizations[J].Chem Rev,2001,101(12):3661-3688.
[11]Braunecke A W,Matyjaszewski K.Controlled/living radical polymerization:Features,developments,and perspectives[J].Prog Polym Sci,2007,32(1):93-146.
[12]Kamigaito M,Ando T,Sawamoto M.Metal-catalyzed living radical polymerization[J]. Chem Rev,2001,101(12):3689-3746.
[13] Favier A,Charreyre M T. Experimental requirements for an efficient control of free-radical polymerizations via the reversible addition-fragmentation chain transfer (RAFT)Process[J].Rapid Commun,2006,27:653-692.
[14]Ouchi M,Terashima T,Sawamoto M.Transition metal-catalyzed living radical polymerization:toward perfection in catalysis and precision polymer synthesis[J].Chem Rev,2009,109:4963-5050.
[15] Yamago S. Precision polymer synthesis by degenerative transfer controlled/living radical polymerization using organotellurium,organostibine,and organobismuthine chaintransfer agents[J].Chem Rev,2009,109:5051-5068.
[16] Szawarc M.“Living”polymers[J]. Nature,1956,172:1168-1169.
[17] Matyjaszewski K. Controlled radical polymerization[J].Current Opinion in Solid State & Materials Science,1996,1(6):769-776.
[18]Szawarc M,Lery M,Milkovich R. Polymerization initiated by electron transfer to monomer.A new method of formation of block polymers[J]. J Am Chem Soc,1956,78(11):2656-2657.
[19]Szwarc M. Living polymers[M]. New York:Interscience Publishers,1968.
[20] Matyjaszewski K. Cationick ploymerizations:mechanism[M].New York:Marcel Dekker,1996.
[21]Otsu T,Yoshida M,Makromol J. Role of initiator-transfer agent-terminator (iniferter)in radical polymerizations:Polymer design by organic disulfides as iniferters[J].Chemistry Rapid Communication,1982,3(2):127-132.
[22]Otsu T,Yoshida M,Tazaki T J.A model for living radical polymerization[J]. Macromolecular Rapid Communications,2003,2(2):133-140.
[23] Ward J H,Shahar A,Peppas N A. Kinetics of“living”radical polymerizations of multifunctional monomers[J].Polymer,2002,43(6):1745-1752.
[24]Nair C P R,Clouet G,Chaumont P J.Functionalization of PMMA by a functional“iniferter”:Kinetics of polymerization of MMA using N,N'-diethyl-N,N'-bis(2-hydroxyethyl)thiuram disulfide[J]. Polym Sci,1989,A27(6):1795-1809.
[25]Kerehhoven C V,Vanden B H,Smets G.Dithiocarbamate telechelic polymers:Synthesis and block copolymerization[J].Macromol Chem,1991,192(1):101-114.
[26] Niwa M,Sako Y,Shimizu M J. Block polymerizations of vinyl monomers initiated by telechelic isopropyl xanthateterminated polymers as macrophotoinitiator. design of block copolymers. 2[J].Macromol Sci Chem,1987,A24(11):1315-1332.
[27]Otsu T,Yamashita K,Tsuda K J.Synthesis,reactivity,and role of 4-vinylbenzyl N,N-diethyldithiocarbamate as a monomer-inifer in radical polymerizations[J].Macromolecules,1986,19(2):287-290.
[28] Nakayayma Y,Masuda T,MakotoNagaishi J. High performance gene delivery polymeric vector:nano-structured cationic star polymers star vectors[J]. Current Drug Delivery,2005,2(1):53-55.
[29] Kongaew A,Wootthikanokkhan J J. Synthesis of polyisoprene-poly(methyl methacrylate)block copolymers by using polyisoprene as a macro-iniferter[J]. Polymer Bullitin,1999,43(4):327-332.
[30]Miyamoto D,Watanabe J,Ishihara K.Highly stabilized papain conjugated with water-soluble phospholipid polymer chain having a reacting terminal group[J]. Appl Polym,2004,91(2):827-832.
[31]Miyamoto D,Watanabe J,Ishihara K.Effect of water-soluble phospholipid polymers conjugated with papainon the enzymatic stability[J]. Biomaterials,2004,25(1):71-76.
[32] Ishihara K,Iwasaki Y,Nakabayashi N. Biocompatible phospholipid polymers for prevention of unfavorable bioreactions on the surface of medical devices[J].Biomedical Diagnostic Science and Technology,2003,367-379.
[33]Bai C X,Zhong W,Song Y L. Electrochemical luminescence composite material with anti-biofouling properties:US,2006029979[P].2006.
[34]Georges M K,Veregin R P N,Kazmaier P M.Narrow molecular weight resins by a free-radical polymerization process[J].Macromolecules,1993,26(11):2987-2988.
[35]Steig S,Cornelius F,Heise A,et al. Synthesis of rod-coil block copolymers using two controlled polymerization technique[J].Macromol Symp,2007,248(1):199-206.
[36]Knoop R J I,Habraken G J M,Gogibus N,et al.Synthesis of poly(benzyl glutamate-b-styrene)rod-coil block copolymers by dual initiation in one pot[J].Polym Sci Part A:Polym Chem,2008,46(9):3068-3077.
[37] Benjamin L,Droumaguet,Julien N. Recent advances in the design of bioconjugates from controlled/living radical polymerization[J].Polym Chem,2010,1(5):563-598.
[38] Chenal M,Boursier C,Guillaneuf Y,et al. First peptide/protein PEGylation with functional polymers designed by nitroxide-mediated polymerization[J]. Polym Chem,2011,2(7):1523-1530.
[39] Wang J S,Matyjaszewski K. Controlled/“living”radical polymerization atom transfer radical polymerization in the presence of transition-metal complexes[J]. J Am Chem Soc,1995,117(20):5614-5615.
[40] Wang J S,Matyjaszewski K. Controlled/“living”radical polymerization halogen atom transfer radical polymerization promoted by a Cu(I)/Cu(II)redox process[J].Macromolecules,1995,28(23):7901-7910.
[41]Wang J S,Matyjaszewski K.Living/controlled radical polymerization.Transition-metal-catalyzed atom transfer radical polymerization in the presence of a conventional radical initiator[J]. Macromolecules,1995,28(1):7572-7573.
[42]Lecolley F,Tao L,Mantovani G,et al.A new approach to bioconjugates for proteins and peptides(“pegylation”)utilising living radical polymerization[J]. Chem Commun,2004,18(28):2026-2027.
[43]Tao L,Mantovani G,Lecolley F,et al.Alpha-aldehyde terminally functional methacrylic polymers from living radical polymerization:application in protein conjugation“pegylation”[J]. J Am Chem Soc,2004,126(41):13220-13221.
[44]Ryan S M,Wang X X,Mantovani G,et al.Conjugation of salmon calcitonin to a combed-shaped end functionalized poly(poly (ethylene glycol)methyl ether methacry[J].J Controlled Release,2009,135(1):51-59.
[45]Jiang H,Xu F J.Biomolecule-functionalized polymer brushes[J].Chem Soc Rev,2013,42(8):3394-3426.
[46] Droumaguet Le B,Mantovani G,Haddleton D M,et al.Formation of giant amphiphiles by post-functionalization of hydrophilic protein-polymer conjugates [J]. J Mater Chem,2007,17(19):1916-1922.
[47]Fan X,Lin L,Dalsin J,et al.Biomimetic anchor for surface-initiated polymerization from metal substrates[J]. J Am Chem Soc,2005,127(45):15843-15847.
[48]Klok H A J.Biological-synthetic hybrid block copolymers:Combining the best from two worlds[J]. Polym Sci Part A:Polym Chem,2005,43(1):1-17.
[49]Bontempo D,Maynard H D.Streptavidin as a macroinitiator for polymerization:in situ protein-polymer conjugate formation[J]. J Am Chem Soc,2005,127(18):6508-6509.
[50]Heredia K L,Bontempo D,Ly T,et al.In situ preparation of protein-“smart”polymer conjugates with retention of bioactivity[J].J Am Chem Soc,2005,127(48):16955-16960.
[51]Mayadune R T,Rizzardo E,Chiefari J.Living radical polymerization with reversible addition fragmentation chain transfer(RAFT):Direct ESR observation of intermediate radicals[J].Macromolecules,1999,32(16):6977-6980.
[52]Moad G,Chong Y K,Postma A,et al.Advances in RAFT polymerization:the synthesis of polymers with defined end-groups[J].Polymer,2005,46(19):8458-8468.
[53]Moad G,Rizzardo E,Thang S H.Living radical polymerization by the raft process[J]. Chem J J,2005,58(6):379-410.
[54]Chiefari J,Chong Y K,Ercole F,et al.Living free-radical polymerization by reversible addition fragmentation chain transfer:The RAFT process[J]. Macromolecules,1998,31(16):5559-5562.
[55]Mayadunne R T A,Rizzardo E,Chiefari J J. Living polymers by the use of trithiocarbonates as reversible additionfragmentation chain transfer (RAFT) agents:ABA triblock copolymers by radical polymerization in two steps[J].Macromolecules,2000,33(2):243-245.
[56]Shi L,Chapman T M,Beckman E J. Poly(ethylene glycol)-block-poly(N-vinylformamide)copolymers synthesized by the RAFT methodology[J]. Macromolecules,2003,36(7):2563-2567.
[57]Mayadunne R T A,Jeffery J,Moad G,et al. Living free radical polymerization with reversible addition-fragmentation chain transfer (RAFT polymerization):Approaches to star polymers[J].Macromolecules,2003,36(5):1505-1513.
[58] Petersen H,Fechner P M,Fischer D,et al. Synthesis,characterization,and biocompatibility of polyethyleniminegraft-poly(ethylene glycol)block copolymers[J].Macromolecules,2002,35(18):6867-6874.
[59]Tao L,Liu J,Davis T P.Branched polymer-protein conjugates made from mid-chain-functional P(HPMA)[J].Biomacromolecules,2009,10(10):2847-2851.
[60] Tao L,Xu J,Davis T P. Synthesis,characterization,and bioactivity of mid-functional polyhpma-lysozyme bioconjugates[J].Biomacromolecules,2010,43(8):3721-3727.
[61] Priyadarsi D,Ming L,Sudershan R,et al. Temperatureregulated activity of responsive polymer-protein conjugates prepared by grafting-from via RAFT polymerizatio[J]. J Am Chem Soc,2008,130(34):11288-11289.

