正交实验优选水杨梅中总黄酮的提取工艺
陈程,冯锁民
(西安医学院 药学院,陕西 西安 710021)
水杨梅(Geum aleppicum)为蔷薇科(Rosace-ae)水杨梅属(Geum)多年生草本植物,主要分布于我国西北、华北、东北等地区[1]。民间以其全草或根入药,具有清热解毒、利尿、消肿止痛之功效[2]。水杨梅醇提物对白血病和宫颈癌细胞有一定抑制作用[3]。从该属植物中分离到的化合物有鞣质、三萜、黄酮等[4]。筛选抗氧化活性中药的研究表明,水杨梅的总酚和总黄酮含量较高,体外消除自由基能力强,对CCl4所致小鼠急性肝损伤具有一定的保护作用[5-6]。本文采用正交实验法对水杨梅中黄酮类化学成分的提取工艺进行优选,为水杨梅中黄酮类化合物的利用与开发提供科学依据。
1 实验部分
1.1 材料与仪器
水杨梅,采自陕西秦岭山区红河谷,经西安医学院药学院生药教研室鉴定为蔷薇科(Rosace-ae)水杨梅属(Geum)植物水杨梅(Geum aleppicum),植物经阴干后粉碎备用;芦丁(批号100080-200707,中国药品生物制品鉴定所);蒸馏水;乙醇,分析纯。
UV-2102PCS 型紫外可见分光光度计;RE-2000A 型旋转蒸发器;BP211D 天平。
1.2 分析方法[7]
1.2.1 对照品溶液的制备精密称取芦丁对照品适量,加入70%乙醇溶解并定容,制成0.234 mg/mL的对照品溶液,放置4 ℃保存。
1.2.2 标准曲线的制备分别精密取对照品溶液0.5,1.0,1.5,2.0,2.5,3.0 mL 于25 mL 容量瓶中,分别加70%乙醇5 mL。精密加入5% NaNO2溶液0. 3 mL,摇匀,放置5 min。精密加入 10%Al(NO3)3溶液0.3 mL,摇匀,放置5 min。再加4%NaOH 溶液4 mL,分别用70%乙醇定容至刻度,摇匀,放置5 min。在520 nm 处测定吸光度,以芦丁溶液浓度C(mg/mL)为横坐标,吸光度A 为纵坐标绘制标准曲线。线性回归得方程Y = 20. 012 7X-0.010 11,r2=0.999 3(n=6),说明线性关系良好。
1.3 实验方法[8]
称取药材10 g,置于500 mL 圆底烧瓶中,加入70%乙醇100 mL 提取1 h,测定总黄酮含量。
1.4 总黄酮含量测定
回收提取液中的乙醇,水浴蒸干,精密称取残渣30 mg,置于100 mL 容量瓶中,加70%乙醇超声处理30 min,取出,冷却,用70%乙醇定容,摇匀。在520 nm 处测定吸光度,并计算总黄酮含量。
2 结果与讨论
2.1 乙醇浓度对总黄酮含量的影响
按1.3 条件实验,乙醇浓度的影响见图1,70%乙醇提取时总黄酮含量最大。

图1 乙醇浓度对总黄酮含量的影响Fig.1 Effect of ethanol concentration on the yield of total flavones
2.2 提取时间对总黄酮含量的影响
称取药材4 份,每份10 g,分别置于500 mL 圆底烧瓶中,加入60%乙醇100 mL 进行提取,测定总黄酮含量,结果见图2。提取时间为2.5 h 时总黄酮含量最大。

图2 提取时间对总黄酮含量的影响Fig.2 Effect of time on the yield of total flavones
2.3 溶剂用量对总黄酮含量的影响
分别称取药材5 份,每份10 g,分别置于500 mL圆底烧瓶中,加入60%乙醇,提取时间1 h,测定总黄酮含量,结果见图3。溶剂用量为10 倍时总黄酮含量最大。

图3 溶剂用量对总黄酮含量的影响Fig.3 Effect of volume on the yield of total flavones
2.4 提取次数对总黄酮含量的影响
分别称取药材5 份,每份10 g,分别置于500 mL圆底烧瓶中,加入60%乙醇100 mL 提取1 h,测定总黄酮含量,结果见图4。提取3 次时总黄酮含量最大。
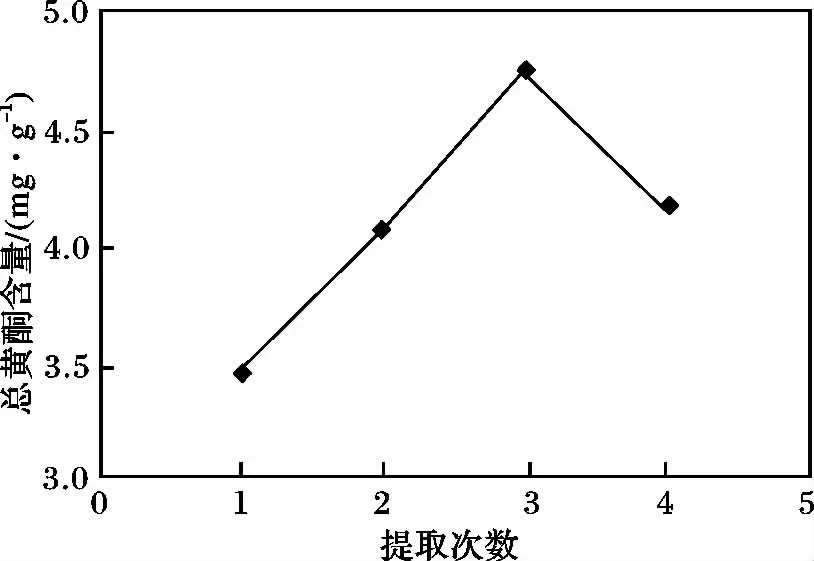
图4 提取次数对总黄酮含量的影响Fig.4 Effect of times on the yield of total flavones
2.5 正交实验[9]
根据单因素考察结果,进行L9(34)正交实验,因素水平见表1,结果见表2,方差分析见表3。
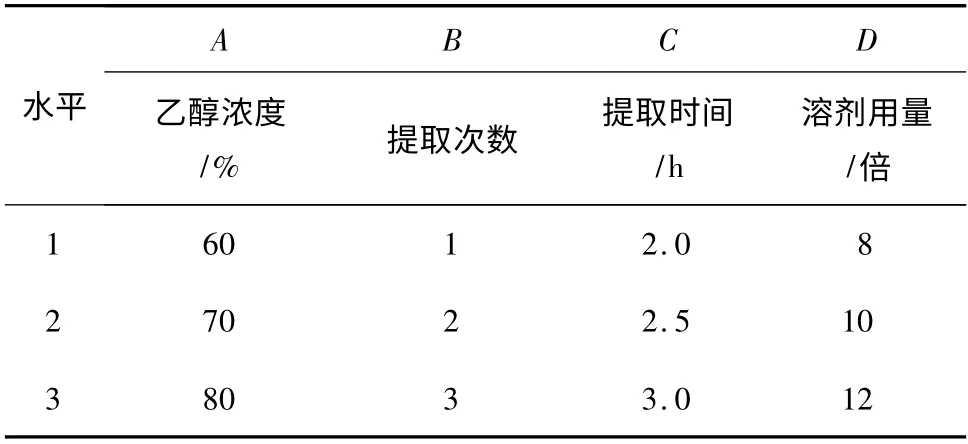
表1 因素水平Table 1 Factors and levels
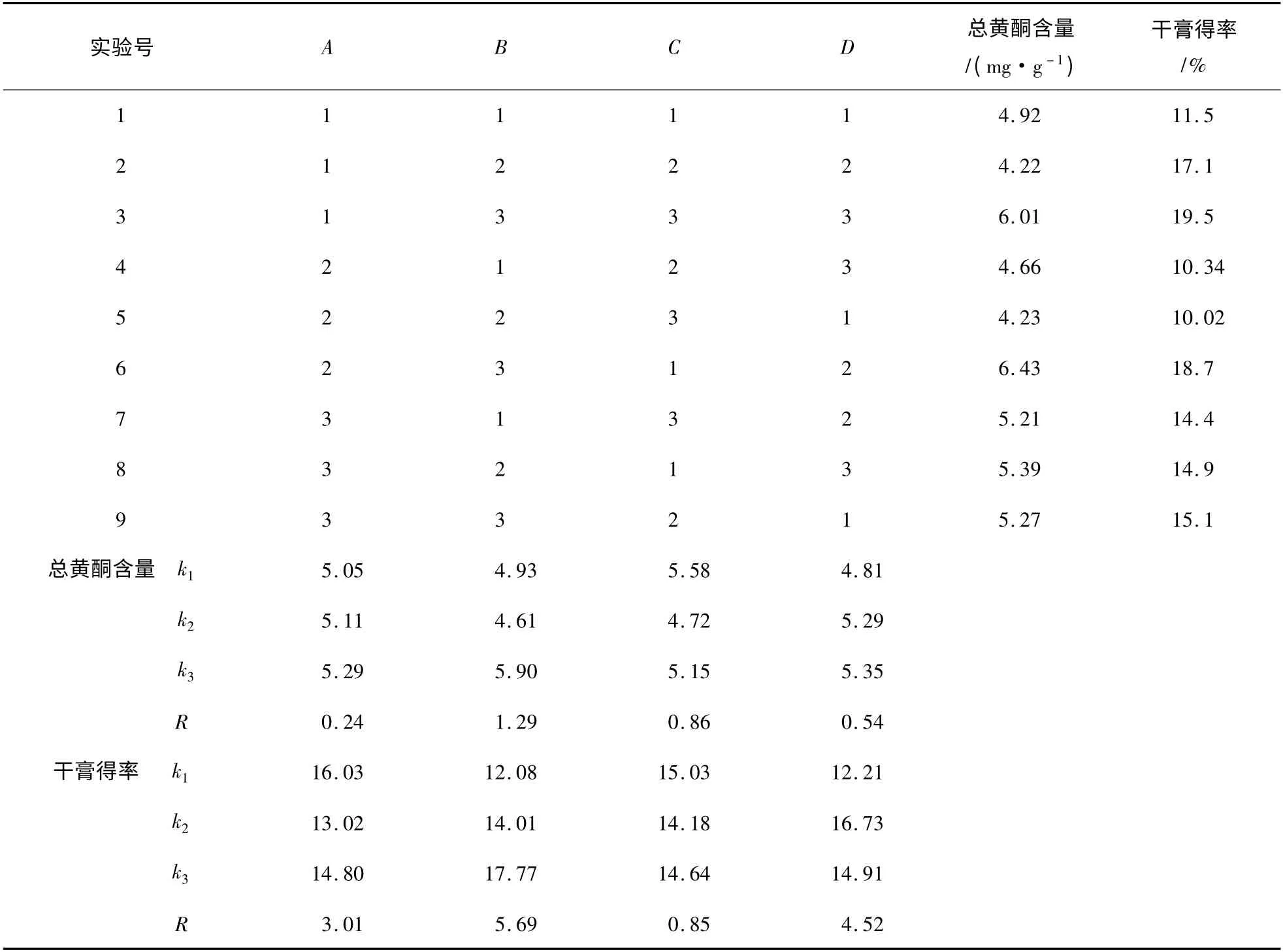
表2 L9(34)正交实验结果Table 2 Results of L9(34)orthogonal test
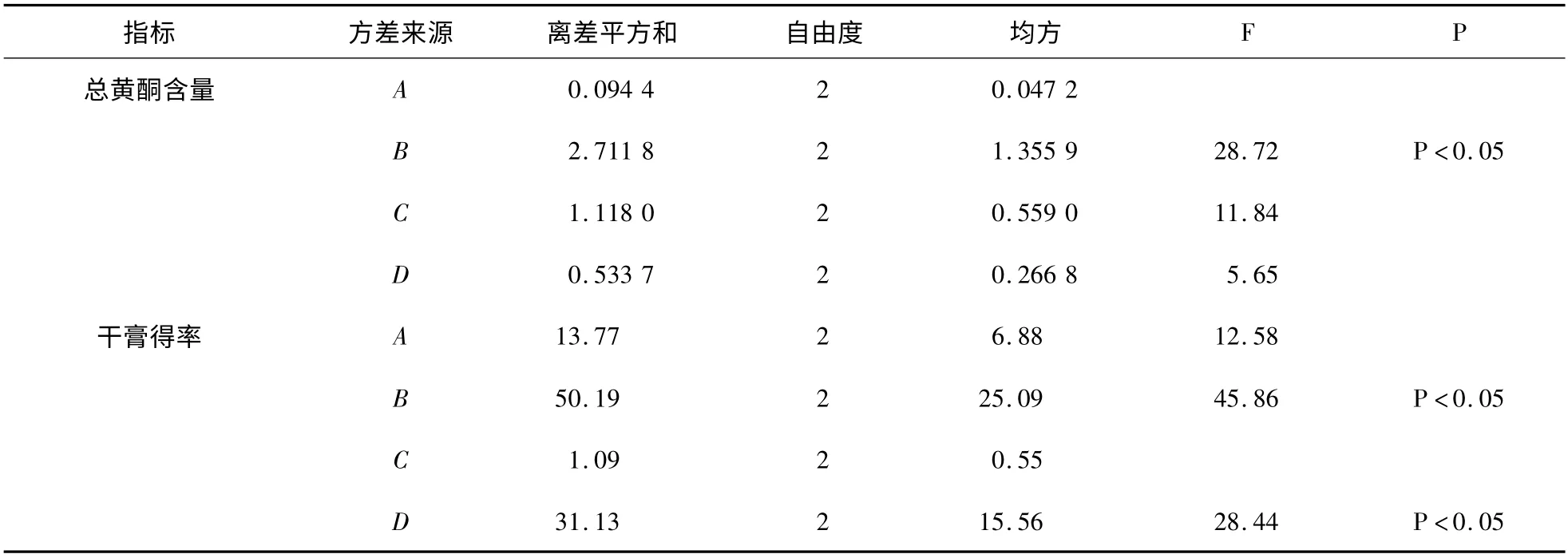
表3 方差分析表Table 3 Analysis of variance
由表2 可知,各因素对总黄酮含量的影响程度依次为B(提取次数)>C(提取时间)>D(溶剂用量)>A(乙醇浓度),各因素对干膏得率的影响程度依次为B(提取次数)>D(溶剂用量)>A(乙醇浓度)>C(提取时间)。由表3 可知,提取次数(B)对总黄酮和干膏得率有显著性影响(P <0.05),且提取次数的第3 水平均较第1、2 水平更优,故选用B3。溶剂用量(D)对干膏得率有显著性影响(P <0.05),且溶剂用量的第2 水平较第1、3 水平更优,故选择D2。乙醇浓度(A)和提取时间(C)对总黄酮和干膏得率均无显著性影响,出于节省考虑,选择A1C1。综上所述,确定最佳提取工艺为A1B3C1D2,即10 倍量的60%乙醇提取3 次,每次2 h。
按照上述最佳提取工艺进行3 次平行实验,结果见表4。
由表4 可知,总黄酮平均含量为6.58 mg/g,高于正交实验结果的最大值,干膏得率平均值18.83%,与正交实验结果的最大值相当,说明最佳工艺合理可行。
3 结论
采用正交实验法对水杨梅中黄酮类化学成分的提取工艺进行优选,确定最佳提取工艺为10 倍量的60% 乙醇提取3 次,每次2 h。为水杨梅中黄酮类化合物的利用与开发提供科学依据。
[1] 中国科学院中国植物志编辑委员会. 中国植物志:37 卷[M].北京:科学出版社,1985:221-223.
[2] 《全国中草药汇编》编写组. 全国中草药汇编[M]. 北京:人民卫生出版社,1975:608-609.
[3] 白雪,林晨,李药兰,等.水杨梅和水团花萃取物体外抑菌活性的实验研究[J]. 中草药,2008,39(10):1532-1535.
[4] Liu H W,Li J K,Zhao W H,et al.Fatty acid synthese inhibitors from Geum japonicum Thunb. var. chinense[J].Chemis & Biodiversity,2009,6(3):402-410.
[5] Xu H X,Zeng F Q,Wan M,et al.Anti-HIV iterpeneacids from Geum japonicum[J].J Nat Prod,1996,59(7):643-645.
[6] 张培成.黄酮化学[M]. 北京:化学工业出版社,2008:364-377.
[7] 冉晓燕,胡德禹,薛伟.槐角中总黄铜的提取工艺研究[J].贵州教育学院学报,2009,20(6):22-24.
[8] 唐前,罗燕英,唐玲,等.正交实验优选金花茶种子总多酚的最佳提取工艺[J]. 时珍国医国药,2010,21(4):792-793.
[9] 贺红军,邱宗荫.正交实验优选茅莓总皂苷的提取工艺[J].中国药房,2012,23(7):611-613.

