鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解
徐慧敏 ,闫 海 ∗,马 松 ,王华生 ,2,尹春华 ,刘晓璐 (.北京科技大学化学与生物工程学院,北京00083;2.江西理工大学建筑与测绘工程学院,江西 赣州 34000)
鞘氨醇单胞菌USTB-05对微囊藻毒素的生物降解
徐慧敏1,闫 海1∗,马 松1,王华生1,2,尹春华1,刘晓璐1(1.北京科技大学化学与生物工程学院,北京100083;2.江西理工大学建筑与测绘工程学院,江西 赣州 341000)
研究了云南滇池水华蓝藻细胞中微囊藻毒素(MCs)的分析和鞘氨醇单胞菌USTB-05在细胞水平和酶水平下对MC-YR、RR和LR的生物降解.结果表明,云南滇池水华蓝藻细胞中 MC-YR、RR和 LR的含量分别为 0.16, 0.96, 0.47mg/g.在初始浓度分别为 19.5mg/L MC-YR、79.5mg/L MC-RR和43.6mg/L MC-LR下,鞘氨醇单胞菌USTB-05在2d内可将上述3种MCs全部降解,鞘氨醇单胞菌USTB-05粗酶液可以以更快的速率对 MC-YR、MC-RR和 MC-LR进行高效酶催化降解,在 10h内可以将初始浓度分别为 14.8mg/L MC-YR、28.4mg/L MC-RR和19.5mg/L MC-LR全部降解.同时发现了MC-YR降解过程中的2个中间和1个最终代谢产物.
微囊藻毒素;鞘氨醇单胞菌USTB-05;酶;生物降解
在淡水蓝藻水华产生的不同藻毒素中,微囊藻毒素(MCs)是出现频率最高、产生量最大和造成危害最严重的藻毒素种类,肝脏是其作用的主要靶器官[1-3].MCs是一类化学性质非常稳定的化合物,在300℃高温下还能维持长时间不分解[4].目前,国内外虽然发现有80多种不同类型的MCs,但在我国主要以MC-RR和MC-LR为主[5-6].
生物降解是目前发现最有效去除MCs的方法,Jones等[7]从天然水体中首次分离出了对MC-LR有降解能力的鞘氨醇单胞菌ACM-3962,随后 Bourne等[8-9]研究了鞘氨醇单胞菌 MJ-PV酶催化降解 MC-LR的途径与分子机理,发现至少有4种酶参与了MC-LR的代谢过程.本课题组从云南滇池底泥中成功筛选出了能够高效降解 MCs的菌株鞘氨醇单胞菌 USTB-05[10],并系统地研究了其降解MCs的动力学过程与优化控制条件[11-13].目前关于MCs生物降解的研究已进入分子水平,降解基因已经成功克隆和表达[14-15],生物降解MC-RR和MC-LR的途径与分子机理已经基本搞清楚[8,16].关于 MC-YR的研究报道,有优化 MC-YR的高效液相色谱检测法并对某水库 MC-YR的污染水平及环境因子进行春、夏、秋、冬 4个季节的监测,分析了水体中微囊藻毒素(MC-YR)质量浓度的季节变化特征及其与水体中总氮、总磷、CODMn和浮游藻类等富营养化指标的相关关系[17-19].也有报道利用二氧化氯氧化方法和紫外-微臭氧工艺去除水体中MC-YR及其氧化机理研究[20-21].但利用生物法高效降解 MC-YR及其降解途径与分子机理研究方面报道相比较少.
本文在发现云南滇池蓝藻细胞不仅产生常见的MC-RR和MC-LR,还发现具有2个苯环结构更复杂的 MC-YR.大多数情况下,一种菌只能降解一种藻毒素,但本研究发现可降解多种藻毒素的菌种,USTB-05不仅能够降解 MC-RR和MC-LR,而且对MC-YR也具有很强的降解能力.研究了在鞘氨醇单胞菌USTB-05细胞和酶水平生物降解上述3种MCs的动力学过程,旨在为生物法降解MC-YR提供参考.
1 材料与方法
1.1 MCs
标准品 MC-YR(分子式:C52H72N10O13,分子量:1045.19)、MC-RR(分子式:C49H75N13O12,分子量:1038.2)和 MC-LR(分子式:C49H74N10O12,分子量:995.2)均购自美国 Sigma公司,纯度>95%.生物降解实验所用的 MC-YR、MC-RR和MC-LR采用文献[22]方法从云南滇池水华蓝藻细胞中提取获得.
1.2 菌种、培养基及培养条件
鞘氨醇单胞菌降解菌株(USTB-05)系本实验室筛选保存[10],采用文献[23]的方法培养.
1.3 USTB-05降解MCs的动力学
分别吸取 0.1mL USTB-05菌液接种到含MC-YR、MC-RR和 MC-LR的培养基[24]中;用NaOH和HCl调节初始pH值[25]分别为5.0, 6.0,7.0, 8.0和9.0,研究USTB-05菌在不同pH值下对 MCs的降解效应.实验在温度 30℃,摇床转速200r/min下进行.实验过程中每12h 取样,经离心(12000r/min, 10min)后取上清液用 HPLC检测MCs浓度变化[26].
1.4 酶催化降解MCs
离心(12000r/min,10min)收获USTB-05细胞,采用文献[27]方法制备粗酶液(CE).MCs的酶催化降解反应在50mmol/L的磷酸盐缓冲液体系中进行,条件为温度 30℃,摇床转速 200r/min.样品经12000r/min、10min离心后取上清液在HPLC上测定[26].
2 结果与讨论
2.1 MC-YR、MC-RR和MC-LR的提取

图1 滇池蓝藻细胞提取液中MC-YR、MC-RR和MC-LR的HPLC图谱Fig.1 HPLC Spectrum of Extracted MC-YR, MC-RR and MC-LR from Dianchi cyanobacterial cells
标准品 MC-YR、MC-RR和 MC-LR在HPLC上出峰的保留时间分别为 13.21,6.98,15.89min,滇池蓝藻细胞提取液同样在保留时间13.21,6.98,15.89min左右(图1)也有对应出峰,其在 200~300nm 的紫外扫描图谱分别与标准品MC-YR、MC-RR和MC-LR扫描图谱一致,只是其浓度较低,均在 238nm 左右处有最大吸收峰.另外,通过改变流动相后发现样品中的 MCs与标准品中3种MCs的出峰时间、扫描吸收峰形和最大吸收峰的波长范围完全一致.研究结果表明,采集的滇池水华蓝藻细胞中所含的化合物是MC-YR、MC-RR和MC-LR3种类型的MCs,其中 MC-RR的含量远高于 MC-YR和MC-LR.根据 MC-YR、MC-RR和 MC-LR的标准曲线方程计算出蓝藻细胞干重中MC-YR、MC-RR和 MC-LR的含量分别为 0.16, 0.96,0.47mg/g,可作为降解底物进行进一步的降解活性研究.因国内外至今尚未研究确定适合不同藻类提取 MCs的最有效提取方法,所以很难确定藻细胞中 MCs的准确含量.目前,我国和世界的各大湖泊水库的蓝藻水华样品中,发现有MC-RR和 MC-LR的报道较多,而发现有MC-YR的报道相比较少.本研究成功从云南滇池水华蓝藻细胞中提取出 MC-YR并定量,为MC-YR的生物降解理论和降解饮用水中MC-YR提供依据.
2.2 USTB-05降解 MC-YR、MC-RR和MC-LR的动力学
在MCs为唯一碳源和氮源条件下,USTB-05在 2d内能够将初始浓度分别为 19.5,79.5,43.6mg/L的MC-YR、MC-RR和MC-LR全部降解(图 2),日均降解能力分别为 9.8,39.8,21.8mg/L,说明USTB-05对MCs具有很强的生物降解能力.USTB-05系本课题组筛选的3种菌株中生物降解MCs能力最强的菌株,其第1个降解基因已成功克隆和表达,降解 MC-RR和MC-LR的途径与分子机理已经基本确定[15,28-29].本研究在对目前国内外研究报道较多的MC-RR和 MC-LR降解的同时,尤其对研究报道还不广泛的MC-YR进行了高效的生物降解.

图2 USTB-05降解MCs 的动力学Fig.2 Kinetics of MCs biodegradation by USTB-05
2.3 初始pH值对USTB-05降解MCs的影响
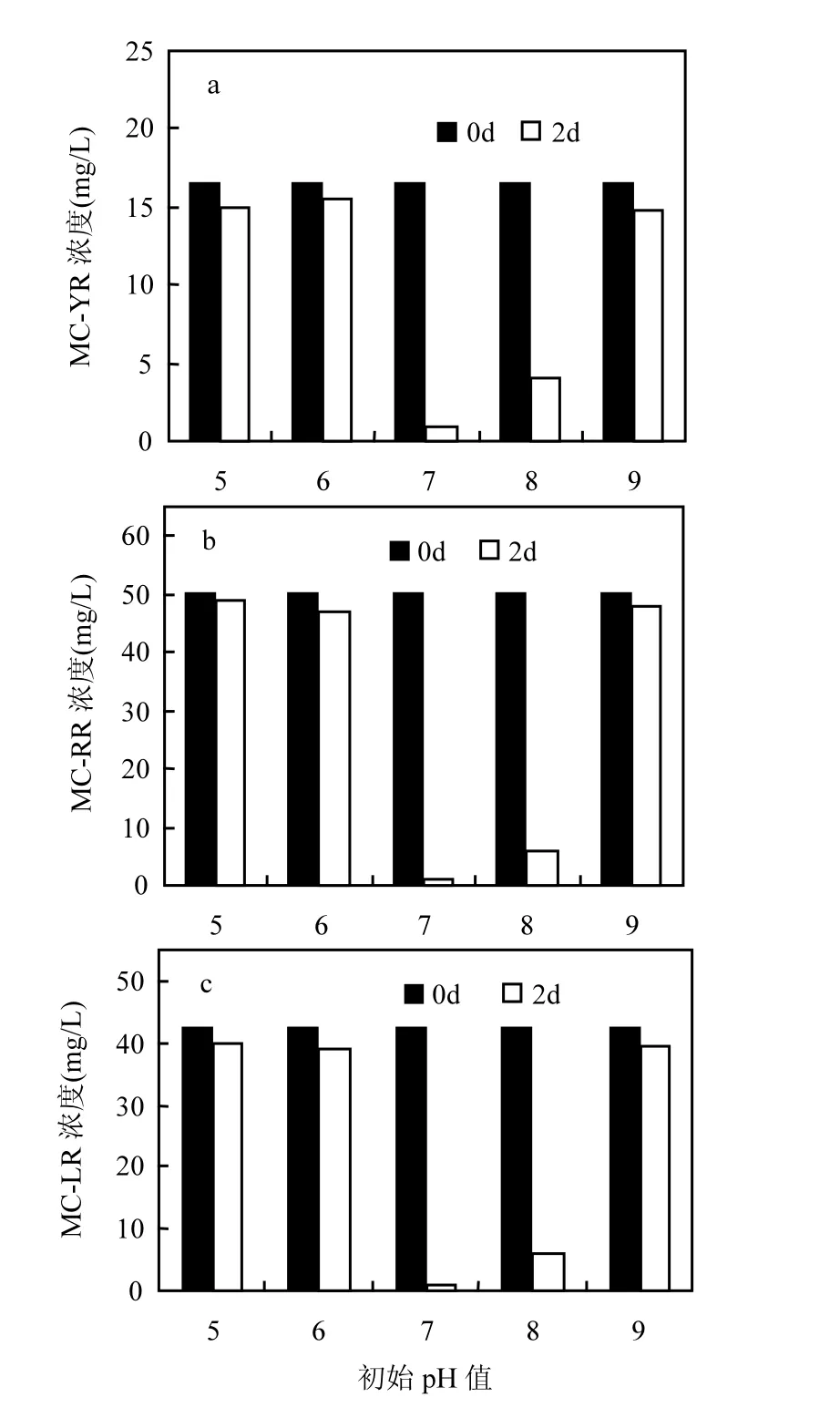
图3 pH值对USTB-05降解MCs的效应Fig.3 Effects of pH on the biodegradation of MCs by USTB-05
大多数情况下,一种菌只能降解一种藻毒素,但本研究发现可降解多种藻毒素的菌种,USTB-05不仅能够降解MC-RR和MC-LR,而且对MC-YR也具有很强的降解能力.温度和pH值是影响USTB-05对MCs降解活性的重要因素,温度约 30℃,pH值中性或弱碱性,具有高降解活性[30].图3中,MC-YR、MC-RR和MC-LR的浓度在2d内基本没有变化,而当初始pH值7.0和8.0时, MC-YR、MC-RR和MC-LR浓度均明显降低,2d内可基本全部降解,特别是当初始pH值7.0时降解速率更快.采用r检验法来验证该结果是否具有显著性.初始pH值对MC-YR降解效应,其检验显著水平值 r3,0.01=0.9912<11.65;初始 pH值对 MC-RR降解效应,其检验显著水平值r3,0.01= 0.9912<6.08;初始pH值对MC-LR降解效应,其检验显著水平值 r3,0.01=0.9912<12.73.所以认为初始pH值对USTB-05降解3种MCs效应都具有显著性影响,且置信度为95%.
本研究结果说明,该菌在降解MCs过程中对环境的酸碱度有一定要求,中偏碱性条件更适合MCs的生物降解,这和已报道的几株MCs降解细菌相似.假单胞菌M-6的胞内粗酶受pH值影响显著,在pH6~8中性范围内降解MC-LR速率较快[31],此报道与本研究结果相似,说明 USTB-05降解MCs对pH值变化比较敏感,在稍偏碱性条件下活性较高(图3).蓝藻水华发生的水体上层因蓝藻的光合活性 pH值呈较强碱性[32-33],而在处理池中藻水混合物 pH值相对较低,一般在6.9~8.5,这与USTB-05对MCs高降解活性的pH值区间大致是相吻合的,因此蓝藻死亡裂解后释放的MCs可以被更快速降解.本研究结果也显示在pH值较高(>9)的水体暴发蓝藻水华时,其产生的MCs不易发生生物降解,这也是造成MCs积累引起危害的重要原因之一.
2.4 USTB-05酶促MCs降解反应动力学
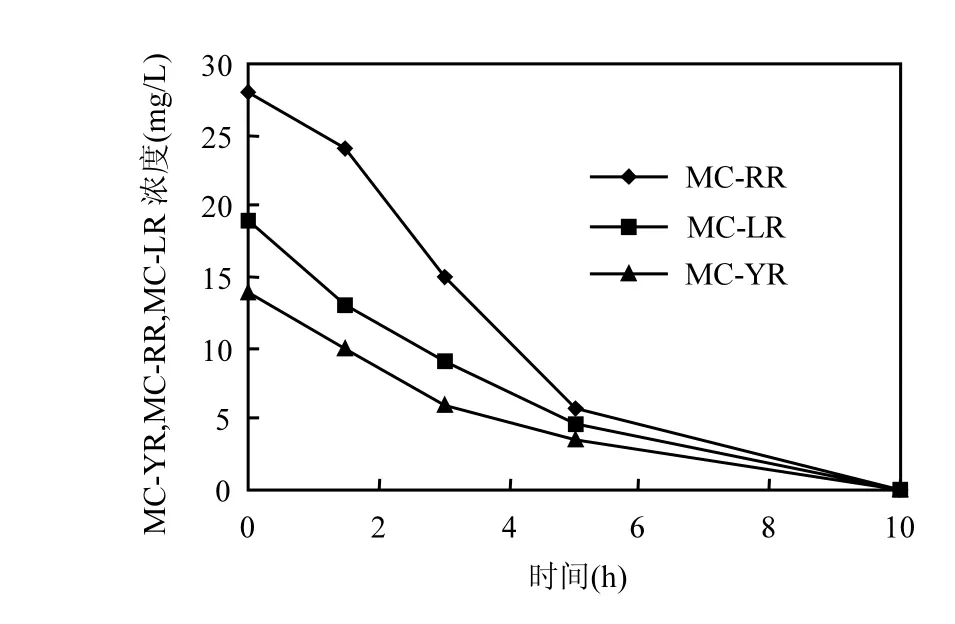
图4 USTB-05酶催化降解MCs的动力学Fig.4 Biodegradation kinetics of MCs catalyzed by enzymes of USTB-05
利用USTB-05菌粗酶液对标准品MC-YR、MC-RR和MC-LR进行酶催化降解,发现在10h内可将初始浓度分别为14.8,28.4,19.5mg/L的标准品MC-YR、MC-RR和MC-LR全部降解(图4),与USTB-05细胞水平 (图2)相比具有更强的降解能力.酶催化降解是高效去除 MC-RR和MC-LR2种MCs的有效途径之一[16,27],本研究发现,USTB-05粗酶液同样可以高效降解结构更复杂带有 2个苯环的 MC-YR.因此可直接采用微生物酶作为一种可生长或不可生长的生物催化剂,通过投加达到高效去除 MCs污染的目的,这可能是进行原位生物修复高效去除饮用水源地中MCs的优化控制方法.
2.5 USTB-05菌酶催化降解MC-YR
图 5中,初始时只有在保留时间 12.4min的MC-YR出峰,反应 1.5h MC-YR峰高明显降低,说明 USTB-05酶中存在能够催化代谢 MC-YR的酶,另外在保留时间 5.5, 9.2min处分别出现了产物 1和产物 2的出峰.进一步延长反应时间到3h,发现MC-YR峰消失,产物1峰降低,但在保留时间12.1min处出现了产物3的出峰.反应3~24h,产物1和2的峰高逐渐降低并消失,而产物3的峰高逐渐增加.Bourne等[8,27]对鞘氨醇单胞菌的MC-LR和MC-RR降解途径进行了研究,首先第1个酶打开连接Adda与精氨酸之间的肽键,催化环状MC-LR和MC-RR变成线状的MC-LR和MC-RR;然后第 2个酶进一步断裂线型 MC-LR和MC-RR肽链上丙氨酸与亮氨酸的肽键,生成四肽化合物;再经第 3个酶降解为小分子多肽和氨基酸.并证明了这 3种代谢产物的毒性明显低于MC-LR和MC-RR本身,降解过程是一个解毒的过程.本研究结果与Bourne等的研究结果相似,说明USTB-05同样至少有3种酶参与了MC-YR的催化降解反应,出现了3个降解产物,其中产物1和 2分别是由第 1个酶和第 2个酶催化降解MC-YR产生的中间代谢产物,而产物3为第3个酶催化降解MC-YR产生的最终产物.3种代谢产物结构正在进一步的研究和测定中.
本课题组曾经分别研究USTB-05酶催化降解MC-RR和MC-LR,分别观察到了2个中间代谢产物和 1个最终产物[27,34],与本研究的结果基本一致,说明 USTB-05很可能以类似的途径对MC-YR进行生物降解.尽管国内外在MC-RR和MC-LR降解途径与分子机理方面有很多研究报道[8,15,28-29],但对于结构更为复杂的MC-YR的生物降解途径的文献相对较少.本研究发现,我国云南滇池水华蓝藻中存在MC-YR,在USTB-05生物降解MC-YR产物结构鉴定、基因克隆表达、降解途径与分子机理方面还需进一步研究.

图5 USTB-05粗酶催化降解MC-YR的HPLC图谱Fig.5 HPLC chromatograms of the enzymatic biodegradation of MC-YR by the crude enzymes of USTB-05
3 结论
3.1 采自云南滇池的藻样细胞中 MC-YR、MC-RR和 MC-LR的含量分别为 0.16, 0.96,0.47mg/g.
3.2 在初始浓度分别为 19.5mg/L MC-YR、79.5mg/L MC-RR和43.6mg/L MC-LR下,鞘氨醇单胞菌USTB-05在2d内可将上述3种MCs全部降解.鞘氨醇单胞菌USTB-05粗酶液可以以更快的速率对标准品 MC-YR、MC-RR和MC-LR进行高效酶催化降解,在10h内可以将初始浓度分别为 14.8mg/L MC-YR、28.4mg/L MC-RR和19.5mg/L MC-LR全部降解.当pH 值7.0和8.0中性偏碱时,降解酶活性较高.
3.3 在USTB-05酶催化降解MC-YR过程中,发现2个中间和1个最终代谢产物.
[1] Honkanen R E, Zwiller J, Moore R E, et al. Characterization of microcystin-LR, a potent inhibitor of type 1and 2a protein phosphatases [J]. Biological Chemistry, 1990,265:1940-1944.
[2] 杨晓红,蒲朝文,张仁平,等.水体微囊藻毒素污染对人群的非致癌健康风险 [J]. 中国环境科学, 2013,33(1):181-185.
[3] 王伟琴,金永堂,吴 斌,等.水源水中微囊藻毒素的遗传毒性和健康风险评价 [J]. 中国环境科学, 2010,30(4):468-476.
[4] Duy T N, LamP K S, Shaw G R, et al. Toxicology and risk assessment of fresh water cyanobacterial (Blue-green Algae)toxins in water [J]. Reviews of Environmental Contamination and Toxicology, 2000,163(3):113-186.
[5] Matthiensen A, Beattie K A, Yunes J S, et al. Microcystin-LR,from the cyanobacterium microcystis RST 9501and from a microcystis bloom in tne patos lagoon Estuary [J]. Brazil.Phytochemistry, 2000,55(4):383-387.
[6] 周宏敏,欧惠超,任 鹏,等.利用 SPR技术测定湖水中微囊藻毒素 [J]. 中国环境科学, 2012,32(7):1284-1287.
[7] Jones G J, Bourne D G, Blakeley R L, et al. Degradation of the cyanobacterial hepatotoxin microcystin by aquatic bacteria [J].Natural Toxins, 1994,2(4):228-235.
[8] Bourne D G, Jones G J, Blakeley R L, et al. Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR [J]. Applied and Environ. Microbiology,1996,62(11):4068-4094.
[9] 袁 媛,吴 涓,李玉成,等.活性炭纤维固定化菌对微囊藻毒素MC-LR的去除研究 [J]. 中国环境科学, 2014,34(2):403-409.
[10] Wang J F, Wu P F, Chen J, et al. Biodegradation of Microcystin-RR by a New Isolated Sphingopyxis sp. USTB-05 [J]. Chinese Journal of Chemical Engineering, 2010,1(18):108-112.
[11] Xiao C B, Yan H, Wang J F, et al. Microcystin-LR biodegradation by Sphingopyxis sp. USTB-05 [J]. Frontiers of Environmental Science, and Engneering in China, 2011,5(4):526-532.
[12] Zhang M L, Pan G, Yan H. Microbial biodegradation of microcystin-RR by bacterium Sphingopyxis sp. USTB-05 [J].Journal of Environmental Sciences, 2010,22(2):168-175.
[13] Yan H, Wang J F, Chen J, et al. Biodegradation of Microcystin-RR extracted from cyanobacterial blooms by Sphingopyxis sp. USTB-05 [R]. Second International Conference on Digital Manufacturing and Automation, 2011.
[14] Kazuya Shimizu, Hideaki Maseda, Kunihiro Okano, et al.Enzymatic pathway for biodegrading microcystin LR in Sphingopyxis sp. C-1 [J]. Journal of Bioscience and Bioengineering, 2012,114(6):630-634.
[15] Yan H, Wang J F, Chen J, et al. Characterization of the first step involved in enzymatic pathway for microcystin-RR biodegraded by Sphingopyxis sp. USTB-05 [J]. Chemosphere, 2012,87(1):12-18.
[16] 闫 海,张 超,魏 巍,等.微囊藻毒素生物降解的研究进展[J]. 环境工程学报, 2007,1(10):8-12.
[17] 朱美洁.水库型水源地微囊藻毒素污染现状及环境影响因素研究一以山仔水库为例 [D]. 福州:福建师范大学, 2008.
[18] 高振美,赵中华,张 波,等.太湖梅梁湾水体微囊藻毒素含量的季节变化特征及其影响因素研究 [J]. 生态环境学报, 2011,20(6/7):1063-1067.
[19] 朱光灿.饮用水中微囊藻毒素降解机理与去除技术研究 [D].南京:河海大学, 2004.
[20] 季 颖.二氧化氯去除水中微囊藻毒素及氧化动力学的研究[D]. 哈尔滨:哈尔滨工业大学, 2007.
[21] 朱光灿,吕锡武.紫外一微臭氧工艺降解微囊藻毒素的动力学特性 [J]. 东南大学学报, 2005,35(3):438-411.
[22] 闫 海,潘 纲,张明明,等.微囊藻毒素的提取和提纯研究 [J].环境科学学报, 2004,24(2):355-359.
[23] 徐春霞,何宏胜,张 超,等.高效降解微囊藻毒素食酸戴尔福特菌USTB-04的培养和活性研究 [J]. 环境工程学报, 2007,1(5):21-24.
[24] 闫 海,邓义敏,邹 华,等.降解微囊藻毒素菌种的筛选和活性研究 [J]. 环境科学学报, 2004,25(6):49-53.
[25] 吴 涓,钟 升,王光云,等.一株降解微囊藻毒素菌种的鉴定及其活性研究 [J]. 中国环境科学, 2011,31(1):116-122.
[26] 周 洁,何宏胜,闫 海,等.滇池底泥微生物菌群对微囊藻毒素的生物降解 [J]. 环境污染治理技术与设备, 2006,7(4):30-34.
[27] 何宏胜,闫 海,周 洁,等.筛选菌种酶催化降解微囊藻毒素的特点 [J]. 环境科学, 2006,27(6):1171-1175.
[28] Wang H S, Yan H, Liu X L, et al. First Step in the Biodegradation of Microcystins by Sphingopyxis sp. USTB-05 [J]. Advanced Materials Research, 2013,647:338-343.
[29] Yan H, Wang H S, Wang J F, et al. Cloning and expression of the first gene for biodegrading microcystin LR by Sphingopyxis sp.USTB-05 [J]. Journal of Environmental Sciences, 2012,24(10):1816-1822.
[30] 金丽娜,张维昊,郑 利,等.滇池水环境中微囊藻毒素的生物降解 [J]. 中国环境科学, 2002,22(2):189-192.
[31] 苑宝玲,陈彩云,李云琴,等.假单胞菌胞内酶粗酶提液对微囊藻毒素MC-LR的降解 [J]. 环境化学, 2009,28(6):854-858.
[32] Soumaya El Herry, Afef Fathalli, Amel Jenhani-Ben Rejeb, et al.Seasonal occurrence and toxicity of Microcystis spp. and Oscillatoria tenuis in the Lebna Dam, Tunisia [J]. Water Research,2008,42(4/5):1263-1273.
[33] 赵 爽,陈 伟,左艳霞,等.蓝藻水华堆积处理池中微囊藻毒素降解细菌的分离及降解特性 [J]. 水生生物学报, 2013,37(3):522-529.
[34] 闫 海.微囊藻毒素的产生与生物降解 [D]. 北京:中国科学院研究生院, 2002.
Biodegradation of microcystins by Sphingopyxis sp. USTB-05.
XU Hui-min1, YAN Hai1∗, MA Song1, WANG Hua-sheng1,2, YIN Chun-hua1, LIU Xiao-lu1
(1.School of Chemistry and Biological Engineering, University of Science and Technology, Beijing 100083, China;2.School of Architectural and Surveying and Mapping Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China). China Environmental Science, 2014,34(5):1316~1321
The contents of microcystins (MCs) in dry cyanobacterial cells taken from Dianchi Lake and the biodegradation of MC-YR, RR and LR by Sphingopyxis sp. USTB-05 at the cellular and enzyme levels were studied. The contents of MC-YR, RR and LR in dry cyanobacterial cells were 0.16, 0.96 and 0.47mg/g, respectively. Initial concentrations of 19.5mg/L MC-YR, 79.5mg/L MC-RR and 43.6mg/L MC-LR were completely biodegraded by Sphingopyxis sp. USTB-05 within 2d. Further studies indicated that MC-YR, RR and LR could also be biodegraded in more rapid rates by crude enzymes of Sphingopyxis sp. USTB-05, and initial MC-YR, RR and LR of 14.8, 28.4, 19.5mg/L were completely removed within 10h, respectively, and two intermediate and one final products were found during the biodegradation process of MC-YR catalyzed by the crude enzymes of USTB-05.
microcystins;Sphingopyxis sp. USTB-05;enzyme;biodegradation
X172
A
1000-6923(2014)05-1316-06
2013-09-12
国家自然科学基金资助项目(21177009,11071013);教育部博士点基金资助项目(20120006110001)
∗ 责任作者, 教授, haiyan@ustb.edu.cn
徐慧敏(1989-),女,内蒙古包头人,北京科技大学硕士研究生,主要从事微囊藻毒素的生物降解研究.

