直接免疫荧光法检验狂犬病毒毒价和灭活效果试验
文│张传明 蒋雯雯 杨敏 虞华芳(江苏省常州同泰生物药业科技有限公司)
直接免疫荧光法检测狂犬病毒毒价比小鼠脑内接种法约高100.17~100.50,呈平行关系,并且两者做灭活检验结果完全一致。所以,直接免疫荧光法可取代小鼠脑内接种法做狂犬病毒毒价检测和灭活检验。
狂犬病是一种由狂犬病病毒引起的人畜共患病,遍布世界各地,我国是狂犬病的高发区。自从新中国成立以来,狂犬病有三次大流行。第一次是在20世纪50年代中期。第二次大流行是从20世纪70年代末期到90年代初期,此次流行共持续了十几年,最高年份有多达7000人死于狂犬病。到20世纪90年代中期,由于人狂犬病疫苗的改进,发病人数逐年减少。但新世纪以来,随着养犬数量的增加,狂犬病的发病人数又逐渐上升。据原卫生部统计,2006年发病人数已超过3000。预计今后有增加的趋势。因为人狂犬病主要是犬猫等宠物咬伤人所致,所以预防狂犬病的主要环节是对犬猫进行100%免疫预防。世界上发达国家通过免疫犬猫等宠物,已经完全控制了宠物的狂犬病,几十年来,再没有报道人从宠物感染狂犬病的病例。南美各国在泛美卫生组织的带领下,从20世纪80年代末普遍开展宠物免疫活动,经过10多年的努力,宠物的狂犬病得到了控制,人的狂犬病病例也因此大大下降。
近年来,我国狂犬病病例急速上升,与我国养犬数量增加有关。据农业部估计,国内养犬数量已超过1亿只。这可能还是比较保守的估计。我国90%以上的狂犬病病人是由犬传染的。犬猫等宠物的狂犬病防治主要靠预防性接种。在20世纪50年代,狂犬病弱毒株,比如ERA、SAD、LEP等,也曾用来免疫宠物或者野生动物,但发现这些弱毒活疫苗有返毒现象而引起疾病。所以,狂犬病病毒减毒活疫苗不再用于犬猫等宠物预防性接种。世界上其他国家目前所用的动物狂犬病疫苗都为灭活苗,多数是细胞培养疫苗,也有脑组织培养的疫苗。用于生产狂犬病病毒灭活苗的毒株包括PV、SAD、ERA、SAD、HEP等。目前我国生产的动物用狂犬病灭活疫苗的单位基本都是用小鼠脑内接种法检测狂犬病毒的毒价和灭活效果,但用小鼠检验存在时间长、成本高、结果不稳定等较多不利因素。我们用直接免疫荧光法做了狂犬病毒毒价检测和灭活效果检测比较试验,现将结果汇报如下。
一、试验材料与方法
1.试验材料。
(1)狂犬病SAD株病毒和BSR细胞均从美国Kansas State University引进,由常州同泰生物药业科技有限公司培养传代。
(2)荧光素(FITC)标记的抗狂犬病病毒核蛋白抗体购于美国Fujirebio公司。
2.试验动物。无特定病原体(SPF)小鼠,ICR品系,购于上海西普尔-必凯实验动物有限公司。
3.试验方法。
(1)用小鼠脑内接种法检测狂犬病毒毒价。将狂犬病毒液用磷酸盐缓冲液(PBS)作10倍系列稀释,取3个适宜稀释度在11~13克的SPF小鼠脑内注射,每只0.03毫升,观察14日,按Reed-Muench法计算半数致死量(LD50)。
(2)直接免疫荧光法检测狂犬病毒毒价。
病毒稀释。准备2块96孔细胞培养板,先在第1块96孔板每孔中加入180微升培养液;在第1列孔中加入20微升待检病毒原液,充分混匀;从第1列孔中吸出20微升加入到第2列孔中,充分混匀;依次类推,直至加到最后一列孔;从第1列孔到第8列孔稀释度分别为10-1~10-8;每个稀释度6孔。
加样。取出第2块96孔板,将第1块96孔板中的病毒稀释液吸至第2块96孔板的相应孔中,每孔100微升。
培养。在每孔中加入100微升含2×104BSR细胞悬液,混匀,置37℃、5% CO2培养箱培养48小时。
固定。弃掉96孔培养板中的培养液,用pH 7.2、0.07摩尔/升的PBS洗板1次,再用80%丙酮洗板1次,然后用80%丙酮室温固定30分钟,弃丙酮后置于室温干燥。
荧光染色。每孔加入50微升工作浓度的荧光素标记的抗狂犬病病毒核蛋白抗体,轻轻摇晃后放入湿盒中37℃孵育30分钟;弃掉荧光标记核蛋白抗体,用PBS洗两次;再吸掉多余的PBS。
观察。置于荧光显微镜下观察。通过荧光病灶形成的稀释度及荧光病灶的孔数来计算病毒荧光灶单位(FFU)。
(3)用小鼠脑内接种法做狂犬病毒灭活检验。将灭活后的病毒原液在10只11~13克的SPF小鼠脑内接种,每只0.03毫升,观察14日;14日后扑杀所有存活小鼠,取小鼠脑组织用含2%牛血清的生理盐水制成10%的匀浆,混合离心,取上清,再次脑内接种11~13克的SPF小鼠10只,每只0.03毫升,观察14日。接种后4日内死亡的小鼠属非特异性死亡,不计算在内;每组4日内死亡数应不超过1只。
(4)用直接免疫荧光法做狂犬病毒灭活检验。取灭活病毒液,10倍稀释后接种于已长成良好单层的BSR细胞,每个样品接种4只T25瓶,置33~35℃孵育1小时后弃去接种液,加病毒维持液5毫升继续培养7日,同时设未接种的BSR细胞做空白对照。7日后盲传1代,再继续培养7日。弃掉细瓶中的培养液,用PBS洗涤1次,再用80%丙酮洗涤一次,然后用80%丙酮室温固定30分钟,弃丙酮后置于室温干燥;每瓶加入1毫升工作浓度的荧光素标记的抗狂犬病病毒核蛋白抗体,37℃孵育30分钟;弃掉荧光标记核蛋白抗体,用PBS洗2次,晾干后在荧光显微镜下观察。
二、结果
1.狂犬病毒毒价检测。我们做了10批狂犬病毒的毒价检测比较试验,分别用小鼠脑内接种法和直接免疫荧光法(细胞)检测病毒毒价,结果见表1。
从表1可以看,用两种方法检测狂犬病毒毒价的平行关系非常好,直接免疫荧光法检测结果比小鼠脑内接种法约高100.17~100.50。
2.狂犬病毒灭活效果检测。我们将上述10批病毒液灭活后,分别用小鼠脑内接种法和直接免疫荧光法检测灭活效果,结果发现,两种方法做出的灭活检验结果完全一致。
三、讨论
1.小鼠脑内接种法的缺点。
(1)结果受试验动物个体影响较大。不同批次的小鼠个体差异较大,有时小鼠较为敏感,死亡率偏高,有时死亡率又会偏低,因此同样一个病毒样品,不同时间检测、不同人员检测,或用不同批次的小鼠检测,都会产生不同的结果,造成该试验的重复性不高。
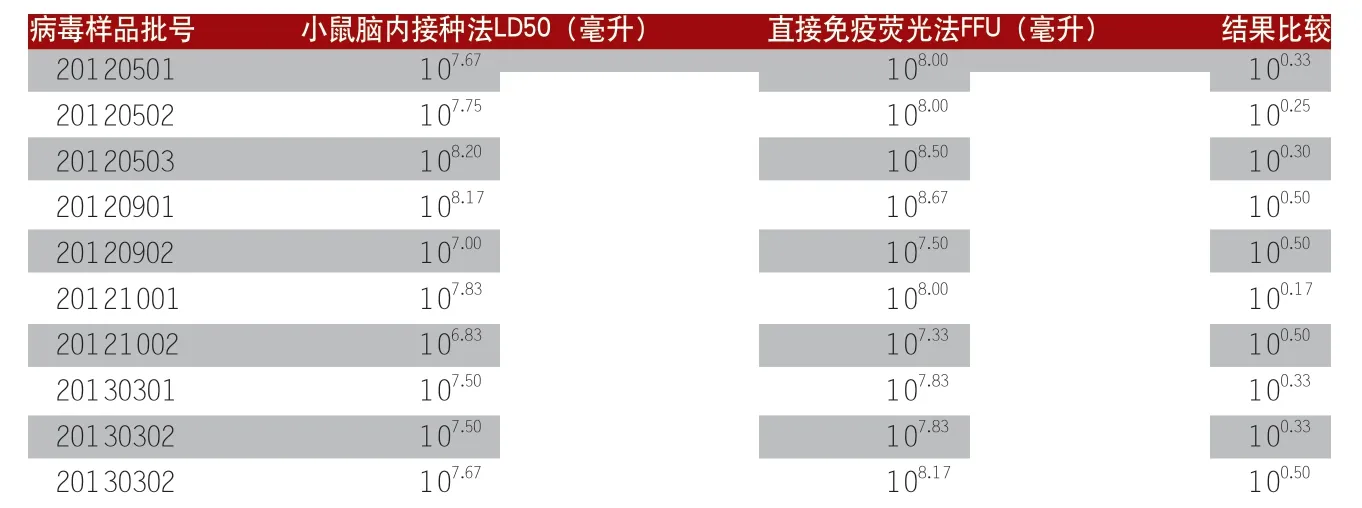
表1 狂犬病毒毒价检测结果
(2)由于需要对小鼠进行脑内注射病毒液,对试验人员的操作技能要求较高,对小鼠的注射部位、接种量要非常准确,接种部位稍有偏差,剂量稍有变化都会影响毒价检测结果,经常造成一些小鼠因接种操作而造成非特异性死亡。
(3)检测时间长,灭活检验每次接种小鼠后需观察14天,两次接种至少需要28天;毒价检测至少需14天。
(4)检测成本高,每个灭活样品至少需要20只SPF小鼠,每个毒价检测样品至少需要15只SPF小鼠,饲养成本和试验动物房资源占用成本很高。
2.直接免疫荧光法的优点。
(1)操作方便。细胞培养和接种操作非常简便,比接种小鼠脑腔相对容易掌握,不会造成动物非特异死亡所带来的结果偏差,只需控制好细胞无菌培养即可。
(2)结果客观可靠。细胞培养条件相对比较好控制,不存在试验动物的个体差异因素,不同批次的细胞均来源于同一株种细胞,因此不同时间培养的细胞差异不大,只要控制好细胞的接种数,每次检测的结果相对比较稳定,因此重复性比较好。
(3)检测时间短。病毒毒价检测仅需48小时,为小鼠脑内接种法的1/7;灭活检验最多需14天,比小鼠脑内接种法缩短一半时间。
(4)检测成本低。每个病毒样品或灭活样品仅需一些BSR细胞和荧光抗体,仅为小鼠脑内接种方法成本的1/4左右。
综合以上两种方法的优缺点,用直接免疫荧光方法检测狂犬病毒的毒价和灭活效果取代小鼠脑内接种法是完全切实可行的。

