野木瓜提取液中黄酮的测定及其体外抗氧化研究
崔霖芸
(遵义医药高等专科学校基础部,贵州遵义563003)
自由基是含有一个或多个不对称电子的原子、分子或离子,具有很强的氧化能力。生物代谢过程中会产生超氧阴离子(O2-·)和羟自由基(·OH),若其数量超过了机体的清除能力便会对机体产生损伤,如降低酶活性,促使多糖降解、DNA链断裂,从而引起体内代谢紊乱,导致各种疾病发生[1]。因此,清除自由基对维持健康、延缓衰老、防癌抗癌等方面均有积极的作用。天然植物中含有丰富的抗氧化性物质如黄酮类化合物、多酚化合物、多糖化合物等。研究显示,物质的总还原力与其抗氧化性间有显著的正相关性,还原力的高低反映了抗氧化能力的强弱[2],黄酮类化合物由于其分子结构中具有数量不等的酚羟基因而使其具有较强的还原性,是很好的抗氧化剂[3-4]。多酚类化合物是极好的氢或电子供体,且不会引发新的游离基或由于链反应而被迅速氧化,具有很好的抗氧化效果[5]。多糖中的醇羟基可以与产生·OH等自由基所必需的金属离子络合,抑制·OH的产生[1,6],从而具有一定的抗氧化性。此外,皂甙类、鞣质类、褪黑素类、不饱和脂肪酸、矿物质等均有一定的抗氧化作用[5]。
野木瓜(Stauntonia chinensis)是木通科(Lardizabalaceae)野木瓜属植物。贵州省正安县于1996被国务院发展研究中心等单位命名为“中国野木瓜之乡”,其盛产的野木瓜以果大、皮薄、肉细、气香、味甘酸等特点著称[7]。中医典籍记载其茎叶微苦,其果味甘、平,归心、肾经[8],具有舒筋活络、解渴生津、平肝和胃、祛风止痛等功效。现代研究表明,野木瓜中含有丰富的皂苷,主要包括去甲五环三萜皂苷类化合物和木脂素苷类化合物,还含有黄酮苷类化合物、酚性成分、糖类化合物[9],此外,野木瓜果实中含有丰富的有机酸、果胶、胡萝卜素、黄酮类、氨基酸、多种维生素和多种矿物质等[10],这些物质均是天然的抗氧化剂。国内外对野木瓜的镇痛抗炎、放射增敏及肝保护等方面的研究较多[11-12],但对野木瓜提取物的抗氧化能力的研究却很少。显然,在人们日益关注自身保健的今天,若能发现野木瓜的抗氧化功效,分析其抗氧化能力的主要成分,将对开发其在保健、防癌抗癌方面的新用途具有积极的意义。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
野木瓜:购自贵州正安县的新鲜野木瓜果。试剂:芦丁(BR,国药集团化学试剂有限公司)石油醚、水杨酸、无水乙醇、VC、HCl、H2O2均为化学纯,铁氢化钾、邻苯三酚、三氯乙酸、NaNO2、Al(NO3)3、NaOH、FeCl3均为分析纯,pH=6.6的K2HPO4-KH2PO4缓冲溶液(配置方法见文献[13]p331)、pH=8.34 的 Na2HPO4-KH2PO4缓冲溶液(配置方法见文献[14]p298)。
1.1.2 仪器
BSA223型电子天平:北京赛多利斯天平有限公司;752N紫外可见分光光度计:上海仪电分析仪器有限公司;PHS-2F型精密酸度计:上海雷磁仪器厂;RE-52A型旋转蒸发器:上海亚荣生化仪器厂;SHZ-DⅢ型予华牌循环水真空泵:巩义市予华仪器有限责任公司;TL80-2型离心机:姜堰市天力医疗器械有限公司;DK-S26型恒温水浴锅:上海森信实验仪器有限公司。
1.2 方法
1.2.1 野木瓜提取液的制备
野木瓜鲜果洗净去籽囊切成2 mm~5 mm薄片→于50℃烘干至恒重→粉碎,过40目筛→40℃石油醚回流脱色→抽滤,滤渣风干得野木瓜粉。
1)醇提物:称取野木瓜粉5.000 g,置入250 mL圆底烧瓶中,加入83%的乙醇151 mL,70℃回流浸提2 h,抽滤,滤液在60℃减压浓缩,定容至25 mL,得野木瓜醇提物。
2)水提物:用蒸馏水取代1)中的乙醇溶液,重复1)的操作,得野木瓜水提物。
1.2.2 芦丁标准曲线的绘制
准确称量25 mg干燥(100℃)至恒重的芦丁置于50mL溶量瓶中,用95%乙醇定容,配制制成0.5 mg/mL芦丁标准液。用移液管分别取该标准液 0、1、2、3、4、6、8 mL置于50 mL容量瓶中,相应加入30%乙醇20、19、18、17、16、14、12 mL 摇匀配成不同浓度芦丁溶液,再分别加入5%NaNO21 mL摇匀放置6 min,再加入10%Al(NO3)31mL摇匀放置6 min,然后加入4%NaOH 7 mL,用30%乙醇定容,摇匀放置11 min,在D510 nm处测定吸光度值,得标准曲线:
C=0.014+9.817A
式中:C为浓度,0.01 mg/mL;A为吸光度判定系数,R2=0.999。
1.2.3 黄酮含量的测定
分别取醇提物、水提物5 mL置于50 mL容量瓶中,用30%乙醇定容后摇匀(即将原溶稀释10倍),取该稀释液5 mL置于50 mL容量瓶中,按1.2.2的方法加入各试剂后定容(此处测试液总体积为50 mL,相当于将稀释液再稀释10倍),在D510nm处测得吸光度值A,由标准曲线可求得测试液中黄酮浓度为C×0.01(mg/mL),据此可计算出提取液的黄酮浓度为C提=C×0.01×10×10=C(mg/mL),提取液中黄酮含量为x=C×25。
1.2.4 总还原力测定[1,15-16]
采用Oyaizu法,其原理是通过待测液将Fe3+还原为Fe2+的多少来检测其还原力。分别取醇提物、水提物0.0、0.5、1.0、1.5、2.0、3.0、4.0 mL(并相应加入蒸馏水4.0、3.5、3.0、2.5、2.0、1.0、0.0 mL 以使各溶液体积相等)及浓度为 0.1、0.2、0.3、0.4、0.6、0.8 mg/mL 的 VC4.0 mL,依次加入pH=6.6的K2HPO4-KH2PO4缓冲溶液5.0 mL,质量分数1%的铁氢化钾3.0 mL,于50℃恒温水浴反应20 min后急速冷却,加入质量分数10%的三氯乙酸3.0 mL,迅速摇匀后在 3000 r/min离心10 min,取上清液2.5mL,加入蒸馏水2.0mL,质量分数0.1%的FeCl30.5 mL,摇匀静置10 min,在D700 nm处测吸光度值。
1.2.5 羟基自由基(·OH)清除率的测定[16-18]
应用Fenton法,基本原理为:过氧化氢在过渡金属离子催化作用下发生均裂产生羟自由基(·OH):[13]
H2O2+Fe3+→·OH+H2O+Fe3+
基于水杨酸能捕获·OH并生成有色物质,在510nm处有最大吸收,因此可通过测定吸光度来测定·OH的多少。但加入具有清除·OH功能的待测液后,待测液与水扬酸竞争·OH,会减少有色物质的生成,据此可测定待测液对·OH的清除力。
在19支25 mL具塞比色管中依次加入2 mmol/L的FeSO4的 3.0 mL和6 mmol/L的水扬酸 3.0 mL,摇匀,再分别加入醇提物、水提物 0.0、0.5、1.0、1.5、2.0、3.0、4.0 mL,并相应加入蒸馏水 4.0、3.5、3.0、2.5、2.0、1.0、0.0mL以使各溶液体积相等,在另一组中分别加入浓度为 0.1、0.2、0.3、0.4 mg/mL、0.6、0.8 mg/mL 的 VC4.0 mL,再分别向各比色管中加入2 mmol/L的H2O23.0 mL,摇匀,37℃恒温水浴反应15 min,取出在D510 nm处测得吸光度值A,据此计算待测液对·OH的清除率:
清除率 =(A0-Ax)/A0× 100%
式中:A0为空白管(即加入4.0 mL蒸馏水)的吸光度值;Ax为加入各待测液后的吸光度值。
1.2.6 超氧阴离子自由基(O2-·)清除率的测定[16,19-20]
采用邻苯三酚自氧化法,取pH=8.34的Na2HPO4-KH2PO4缓冲溶液4.7 mL,加入4.0 mL蒸馏水,摇匀,再加入3 mmol/L的邻苯三酚0.3 mL(用10 mmol/L的HCl配制,空白管用10 mmol/L的HCl代替),迅速摇匀倒入比色皿中,在D325 nm处测吸光度值,每隔30秒记录一次,至4.5 min,将吸光度值与时间回归,其斜率即为邻苯三酚自氧化速率。
待测液清除O2-·的测定:用待测液代替蒸馏水,即不加蒸馏水,而是分别加入醇提物、水提物0.5、1.0、1.5、2.0、3.0、4.0,并相应加入蒸馏水 3.5、3.0、2.5、2.0、1.0、0.0mL使反应体系总体积保持9.0 mL。对照组则加入浓度为 0.1、0.2、0.3、0.4、0.6、0.8 mg/mL 的 VC4.0 mL,重复上述实验。超氧阴离子自由基清除率为:
抑制率 =(V0-Vx)/V0× 100%
式中:V0为未加待测液(即加入4.0 mL蒸馏水)的邻苯三酚自氧化速率;Vx为加入待测液后的邻苯三酚自氧化速率。
2 结果与分析
2.1 总黄酮含量的测定
实验结果测得野木瓜醇提物和水提物的吸光度值分别为0.674和0.416,由1.2.2和1.2.3的方法可计算出醇提物中黄酮浓度为6.63 mg/mL,水提物中黄酮浓度为4.10 mg/mL,醇提物的黄酮浓度高于水提物。
2.2 总还原力的测定
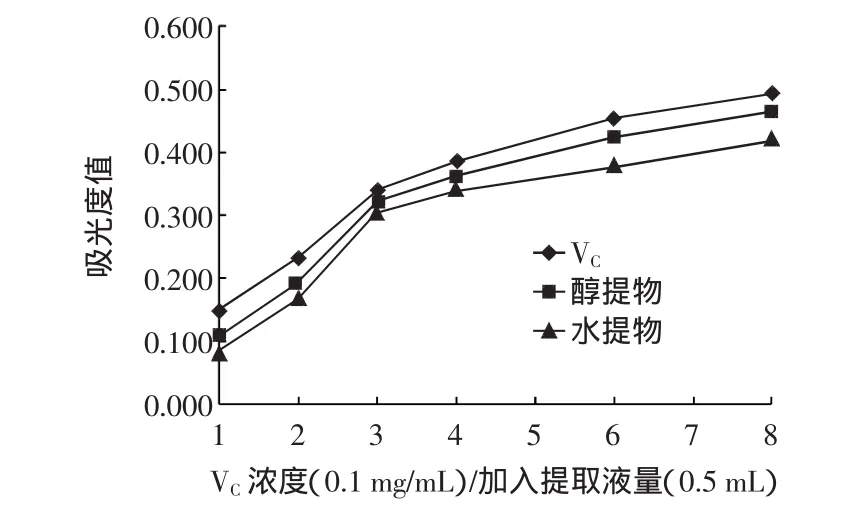
图1 野木瓜提取液的还原力Fig.1 The reduction energy of the extraction from Stauntonia Chinensis
实验结果见图1,各待测液的总还原力变化趋势相似,即随着加入野木瓜提取液量(或VC浓度)的增加,吸光度值开始迅速增加(即待测液的总还原力迅速增加),但当提取液的量增加到1.5 mL(或VC浓度增加到0.3 mg/mL)后,增长趋于平缓。吸光度值的大小反应了总还原力的强弱,因此,总还原力由强到弱依次为VC>野木瓜醇提物>野木瓜水提物,这主要可能是因为醇提物中的黄酮浓度高于水提物,说明野木瓜的总还原力主要来自于其中的总黄酮。当加入野木瓜醇提物4 mL时(相当于从0.8 g野木瓜干粉中提取的液量,换算过程为 5 g/25 mL×4 mL=0.8 g,参见 1.2.1),其还原力只是略低于0.8 mg/mL的VC的还原力,说明野木瓜提取物有较强的还原力。总还原力与抗氧化性间有显著正相关,还原力的高低反映了抗氧化能力的强弱[21]。因此说明野木瓜提取液有较强的抗氧化能力,且醇提物优于水提物。
2.3 对羟基自由基(·OH)的清除作用
图2是描述了野木瓜提取液对·OH的清除作用。

图2 野木瓜提取液对·OH的清除Fig.2 The·OH scavenging effects of the Stauntonia Chinensis extraction
野木瓜醇提物和水提物的变化趋势相似,随着添加提取液量的增加,清除率迅速上升,在添加量超过1.5 mL后增加速度放慢,并在超过3.0 mL后趋于平缓。VC对·OH的清除作用在浓度较低时,作用较小,低于野木瓜提取液,但随着浓度的上升,其清除作用上升得最快,并迅速超过野木瓜提取液的清除能力。从清除作用大小看,醇提物和水提物对·OH的清除作用基本相当,且与VC的差别不明显。原因可能是尽管醇提物中的黄酮含量高于水提物,使醇提物对·OH有较好的清除作用,但据王文平等的测定,正安野木瓜中多糖(通过蒸馏水浸提)的含量高达12.02%[22],而多糖易溶于水,难溶于醇,因此水提物中溶有较多的多糖,多糖类化合物对·OH有较好的清除作用[1,6],从而增加了水提物对·OH的清除率,使两者作用大致相当。当加入4 mL野木瓜提取液(相当于从0.8 g野木瓜干粉中提取的液量),对·OH的清除率可达到77.42%(水提物)和76.66%(醇提物),与0.246 mg/mL的VC的清除率79.26%几乎相当(即加入4 mL的0.8 mg/mL的VC的清除率,此处换算为:总反应液量为13 mL(见1.2.3),因此,反应液中 VC的浓度为 0.8 mg/mL×4 mL/13 mL=0.246 mg/mL),说明野木瓜提取液对·OH有很好的清除作用。
2.4 对超氧阴离子(O2-·)的清除作用

图3 野木瓜提取液对O2-·清除Fig.3 The O2-·scavenging effects of the Stauntonia Chinensis extraction
图3给出了野木瓜提取液对超氧阴离子(O2-·)的清除作用,野木瓜乙醇提取液对O2-·的清除作用和VC作用趋势和大小都极为相似,随着醇提物添加量的增加(VC浓度的增加),清除率迅速增加,并在超过2 mL(VC浓度0.4 mg/mL)后趋于平稳。水提物随着添加量的增加,清除率一直增加,在超过3 mL后趋于平缓,但其清除作用明显低于醇提物,其原因很可能是醇提物中黄酮类化合物含量高于水提物的原故,尽管水提物中多糖含量较高也未能弥补这个差异,说明野木瓜对O2-·的清除能力主要来自于其中的黄酮类化合物。当加入4 mL提取液量(相当于从0.8 g野木瓜干粉中提取的液量),对O2-·的清除率可达到96.36%(乙醇提取),与0.356 mg/mL的VC的清除率96.69%相当(此处即为加入4 mL 0.8 mg/mL的VC时的清除率,换算过程是:总反应液量为9 mL(见1.2.4),因此,反应液中VC的浓度为 0.8 mg/mL×4 mL/9 mL=0.356 mg/mL),说明野木瓜醇提物对O2-·有很好的清除作用,野木瓜水提物对O2-·的清除作用尽管比醇提物小,但也达到90.78%,说明水提物对O2-·也有较好的清除作用。
3 结论
实验证实野木瓜乙醇提取液在总还原力和对超氧阴离子(O2-·)的清除率上均明显高于水提物,但在清除羟基自由基(·OH)能力上,醇提物与水提物作用大致相等,其主要原因可能是由于醇提物中总黄酮含量高于水提物,尽管水提物中溶有更多多糖,也不能弥补水提物与醇提物在总还原力和对O2-·的清除率上的差距,但由于多糖类化合物对羟自由基有较好的清除作用[1,6],使二者在·OH清除率上大致相等。这说明野要瓜的抗氧化作用主要来自于野木瓜中的黄酮类化合物,其多糖类化合物也有一定的作用。与VC相比,野木瓜醇提物在总还原力上略低于VC,但在对超氧阴离子(O2-·)和羟基自由基(·OH)的清除率上大致相当,说明野木瓜有很好的抗氧化作用,是一种较好的天然抗氧化剂,对维持健康、延缓衰老、防癌抗癌等方面均有积极的作用,对推广和开发野木瓜饮品、食品、保健药品等具有一定的指导作用。
[1] 张春梅,宋海,魏生龙.荷叶离褶伞菌丝体多糖的提取及还原力的研究[J].中国食用菌,2012,31(6):44-48
[2] 邢懿,梁波,汪璐,等.黄山杜鹃总黄酮的体外抗氧化活性研究[J].华西药学杂志,2013,28(1):53-55
[3] 张琳,陆维敏.黄酮类化合物抗氧化性能与其结构的关系[J].浙江大学学报:理学版,2006,33(2):187-191
[4] 潘国庆,梁永欣.黄酮类化合物结构与抗氧化活性关系研究[J].青海科技,2005(3):28-30
[5] 刘树兴,赵芳.从天然植物中开发抗氧化剂研究进展[J].食品研究与开发,2007,28(7):179-182
[6] 赵云涛,国兴明,李付振.金樱子多糖的抗氧化作用[J].生物学杂志,2003,20(2):23-24
[7] 王文平,郭祀远,李琳,等.野木瓜多糖中糖醛酸含量测定[J].食品科技,2007(10):84-86
[8]苗明三.法定中药药理与临床[M].北京:世界图书出版公司,1998:1664
[9] 陈瑛,李锦,吴英良.野木瓜化学成分及其药理和临床研究进展[J].沈阳药科大学学报,2008,25(11):924-928
[10]张毅,王少敏.木瓜高效栽培与利用[M].北京:中国农业出版社,2003:1-2
[11]陈国栋,杨磊,陈少丹,等.野木瓜属植物化学成分和生物活性研究概况[J].中药材,2008(2):309-315
[12]陈瑛,李锦,吴英良.野木瓜化学成分及其药理和临床研究进展[J].沈阳药科大学学报,2008(11):924-928
[13]庞战军.自由基医学研究方法[M].北京:人民卫生出版社,2000:331,3
[14]袁道强,黄建华.生物化学实验技术[M].北京:中国轻工业出版社,2006:298
[15]汪海波,刘大川,佘珠花,等.大豆异黄酮类物质的提取、抗氧化性及稳定性研究[J].食品科学,2004,25(1):111-115
[16]莫开菊,柳圣,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115
[17]库尔班·吐松,展锐,张宏,等.顶羽菊抗氧化活性研究[J].生物技术通讯,2010,21(3):406-412
[18]丁利君,周圳辉,林燕如.芒萁中黄酮物质的提取及其抗氧化研究[J].食品科学,2005(8):77-81
[19]邹国林,桂兴芬,钟晓凌,等.一种SOD的测活方法――邻苯三酚自氧化法的改进[J].生物化学与生物物理进展,1986(4):71-73
[20]曾小玲.七种菊科植物抗活性氧作用的研究对超氧阴离子自由基的清除作用[J].中国现代医学杂志,1999,9(2):44-52
[21]邢懿,梁波,汪璐.黄山杜鹃总黄酮的体外抗氧化活性研究[J].华西药学杂志,2013,28(1):53-55
[22]王文平,郭祀远,李琳,等.苯酚-硫酸法测定野木瓜中多糖含量的研究[J].食品科学,2007,28(4):276-279

