蚯蚓蛋白水解酶自溶水解蚯蚓工艺及其产物组成特征
李国雷,廖 敏,张 楠,陈 娜,黄 宇
(1.浙江省亚热带土壤与植物营养重点实验室,浙江 杭州 310058;2.浙江省象山县农林局,浙江 象山 315700;3.浙江大学 环境与资源学院,浙江 杭州 310058)
研究表明,蚯蚓是陆地生态系统中生物量最大的无脊椎土壤动物,其肌体可提供蛋白质、氨基酸、维生素、矿物元素等动物需要的营养物质,以及抗氧化酶、溶栓酶、溶血素和抗肿瘤成分等生物活性成分[1-5]。其中干蚯蚓体内含蛋白质量高达70%左右,因此蚯蚓体可作为氨基酸制作的重要原料,这成为提高蚯蚓经济效益的重要途径,已成为蚯蚓综合利用的研究热点[6]。目前有关动植物蛋白制备氨基酸的工艺研究表明,酶法水解工艺往往成为首选[7-9],因为酶法水解反应条件温和,反应效率高,既不破坏氨基酸,也不产生消旋作用;同时酶法水解生成的部分小分子肽具有生物活性,可促进动物的免疫能力和生产性能提升。
目前有关蚯蚓蛋白质酶水解工艺及其产物的研究,文献报道主要集中在引入外源酶方面[9-11],如刘波等[9]研究发现,枯草蛋白酶(Asl.398)可显著促进蚯蚓蛋白质的水解,酶解产物中主要由分子量5 000以下的多肽、小分子肽及氨基酸组成,其中220 分子量以下的组份占72.09%,氨基酸组成平衡,表明外源酶水解蚯蚓蛋白具有一定的应用潜力[9],但外源酶的引入,必然增加生产的投入。研究表明,蚯蚓消化道有10 多种蛋白水解酶,包括纤溶酶等,这些酶具有较强的蛋白质水解活性[9-11],因此,是否可利用蚯蚓自身水解酶酶解蚯蚓蛋白质,获取活性成分完全保留、营养价值高的蚯蚓水解液,但目前相关研究报道较少,而开发利用蚯蚓自身水解酶酶解蚯蚓蛋白质的工艺,将有助于提高酶解蚯蚓蛋白质工艺经济效益,是投入最少,易于操作,且保留蚯蚓活性成分最多的有效方法。鉴此,本研究将系统地研究利用蚯蚓自身水解酶自溶水解蚯蚓蛋白的工艺及其产物组成特征,筛选确定蚯蚓蛋白酶自溶水解的最佳工艺条件,为提高蚯蚓利用途径和经济效益提供理论依据。
1 材料与方法
1.1 实验材料
太平二号新鲜蚯蚓,由宁波龙兴生态农业科技开发有限公司提供,水分81.23%,粗蛋白(干质量)约65.78%。茚三酮和甘氨酸(分析纯,国药集团化学试剂有限公司)。
1.2 实验仪器
DF-101S 型集热式恒温加热磁搅拌水浴锅(上海羌强仪器设备有限公司),ML-204 分析天平(上海梅特勒-托利多),低温大容量离心机GTR10-1(北京时代北利离心机有限公司),P-752 型紫外可见分光光度计(上海光谱仪器有限公司),DS-200 高速组织捣碎机(江苏无锡沃信仪器有限公司),Waters2695 高效液相色谱(美国WATERS 公司),835-50 型日立氨基酸分析仪等。
1.3 蚯蚓自溶水解
洗净蚯蚓,尽量让蚯蚓吐出体内的食物残渣。称取100 g 蚯蚓用高速组织捣碎机捣碎,加入一定体积的水,一定pH 下自溶水解,保温反应一定时间,沸水浴100 ℃加热灭活60 min,室温放置30 min,之后4 500 r/min 下离心10 min,取上清液,密封分装备用待侧。
1.4 自溶水解工艺条件优化
酶解体系pH 值、温度、时间、底物浓度(蚯蚓与水的重量比)等是影响自溶酶解工艺酶解效果的主要因素。本研究针对温度、pH、时间、蚯蚓与水的比例等对自溶水解反应的影响进行了单一因素及正交试验,进而确定最佳自溶酶解工艺条件。
1.5 水解产物指标测定
(1)氨基酸的测定。总氨基酸采用茚三酮比色法[12];氨基酸组成采用氨基酸分析仪测定,测定时样品经高速(12 000 r/min)、低温(4 ℃)离心15 min,后用0.45 μm 滤膜过滤。
(2)多肽浓度。采用三氯乙酸(TCA)结合福林酚法测定多肽浓度[13]。
(3)酶解产物分子量分布。以Waters2695 高效液相色谱,采用标准曲线法测定酶解样品的相对分子质量[9]。分析条件:300 mm×7.8 mm TSK gel 2000 SWXL 色谱柱,柱温30 ℃,流动相为乙腈/水/三氟乙酸(45/55/0.1(V/V)),流速0.5 mL/min,UV200 nm 下检测。
2 结果与分析
2.1 自溶酶解工艺条件优化
(1)水解体系温度对蚯蚓蛋白酶自溶水解的影响。图1 是保持鲜蚯蚓与水的重量比为1∶1.5,水解体系pH=7.0,水解时间48 h 的条件下,蚯蚓蛋白酶自溶水解效果随水解体系温度变化的结果,水解体系温度梯度分别为45 ℃,50 ℃,55 ℃,60 ℃,由图1 可知随着水解体系温度的增加,水解体系溶液中游离氨基酸和总氨基酸量都先上升后下降,50 ℃时,水解体系溶液中游离氨基酸和总氨基酸量达到峰值,之后逐渐下降,至55 ℃之后,水解体系溶液中游离氨基酸和总氨基酸量趋于平缓。由于水解体系溶液中总氨基酸减去游离氨基酸结果即为多肽浓度,可见,多肽浓度随水解体系温度变化不明显,温度之间差异不显著(P<0.05)。可见,蚯蚓蛋白酶自溶水解最佳活性温度是50 ℃,此时,蚯蚓蛋白酶自溶水解蚯蚓体内蛋白质能力最强。
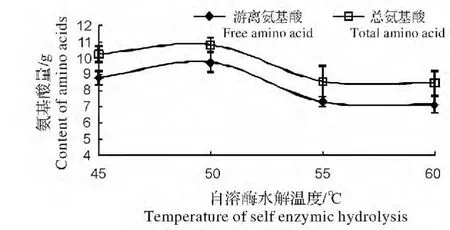
图1 水解体系温度对蚯蚓蛋白酶自溶水解的影响Fig.1 Effect of the temperature of hydrolysis system on earthworm self enzymatic hydrolysate
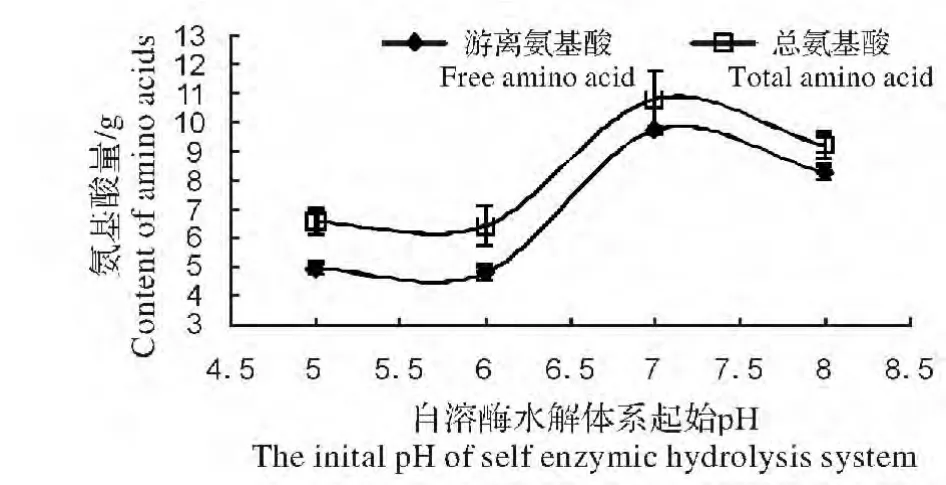
图2 水解体系起始pH 对蚯蚓蛋白酶自溶水解的影响Fig.2 Effect of the initial pH of hydrolysis system on earthworm self enzymatic hydrolysate
(2)水解体系pH 对蚯蚓蛋白酶自溶水解的影响。图2 是保持鲜蚯蚓与水的重量比为1∶1.5,水解体系温度梯度50 ℃,水解时间48 h 的条件下,蚯蚓蛋白酶自溶水解效果随水解体系pH 变化的结果,水解体系pH 分别为5.0,6.0,7.0,8.0,由图1 可知随着水解体系pH 的增加,水解体系溶液中游离氨基酸和总氨基酸量都先上升后下降,pH7.0 时,水解体系溶液中游离氨基酸和总氨基酸量达到峰值,之后逐渐下降,至pH7.0 之后,水解体系溶液中游离氨基酸和总氨基酸量趋于平缓。由于水解体系溶液中总氨基酸减去游离氨基酸结果即为多肽浓度,可见,多肽浓度随水解体系温度变化不明显,无显著差异(P<0.05)。可见,蚯蚓蛋白酶自溶水解最佳活性pH 是7.0,此时,蚯蚓蛋白酶自溶水解蚯蚓体内蛋白质能力最强。
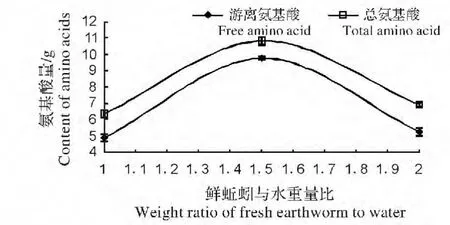
图3 水解体系鲜蚯蚓与水的重量比对蚯蚓蛋白酶自溶水解的影响Fig.3 Effect of the weight ratio of fresh earthworm to water on earthworm self enzymatic hydrolysate
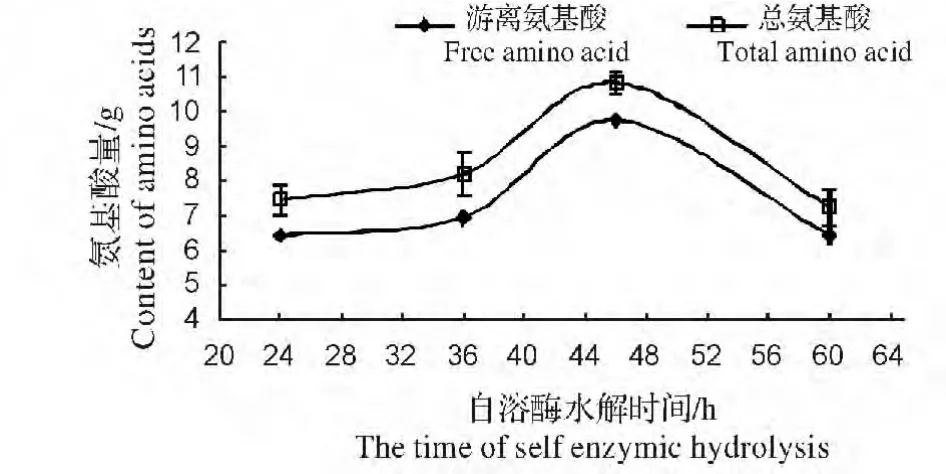
图4 水解时间对蚯蚓蛋白酶自溶水解的影响Fig.4 Effect of hydrolysis time on earthworm self enzymatic hydrolysate
(3)水解体系中鲜蚯蚓与水的重量比对蚯蚓蛋白酶自溶水解的影响。图3 是水解体系pH=7.0,水解体系温度梯度50 ℃,水解时间48 h 的条件下,蚯蚓蛋白酶自溶水解效果随水解体系鲜蚯蚓与水的重量比变化的结果,水解体系鲜蚯蚓与水的重量比分别:1∶1.1,1∶1.5,1∶2.0,由图3 可知随着水解体系鲜蚯蚓与水的重量比的增加,水解体系溶液中游离氨基酸和总氨基酸量都先上升后下降,鲜蚯蚓与水的重量比为1∶1.5 时,水解体系溶液中游离氨基酸和总氨基酸量达到峰值,之后逐渐下降。由于水解体系溶液中总氨基酸减去游离氨基酸结果即为多肽浓度,可见,多肽浓度随水解体系鲜蚯蚓与水的重量比变化不明显,差异不显著(P<0.05)。可见,蚯蚓蛋白酶自溶水解最佳反应的鲜蚯蚓与水的重量比是1∶1.5,此时,蚯蚓蛋白酶自溶水解蚯蚓体内蛋白质效果最好。
(4)水解体系中水解时间对蚯蚓蛋白酶自溶水解的影响。图4 是水解体系pH=7.0,水解体系温度梯度50 ℃,鲜蚯蚓与水的重量比为1.5,蚯蚓蛋白酶自溶水解效果随水解时间变化的结果,水解时间分别为24,36,48,60 h,由图4 可知,随着水解时间的增加,水解体系溶液中游离氨基酸和总氨基酸量都先上升后下降,水解时间为48 h 时,水解体系溶液中游离氨基酸和总氨基酸量达到峰值,之后逐渐下降。而由水解体系溶液中总氨基酸减去游离氨基酸结果所得的多肽浓度,随水解时间的变化不明显,差异不显著(P<0.05)。总体而言,蚯蚓蛋白酶自溶水解反应的最佳时间是48 h,此时,蚯蚓蛋白酶自溶水解蚯蚓体内蛋白质效果最好。
(5)蚯蚓自溶酶解试验正交分析结果。对上述蚯蚓自溶酶解试验的4 个影响因素的结果进行以游离氨基酸数和总氨基酸为指标的正交试验极差分析可以发现(表1),影响蚯蚓自溶酶解蚯蚓蛋白的上述4 个因素主次关系为:鲜蚯蚓与水的重量比>温度>酸碱度>时间,即:鲜蚯蚓与水的重量比是影响蚯蚓自溶酶解的最主要因素,其次是温度,再次为酶解pH,最后为时间。根据上述结果可得出,蚯蚓自溶酶解的最佳条件组合为:pH 7.0、鲜蚯蚓与水的重量比1∶1.5、温度50 ℃、反应时间48 h,在此条件下,每100 g 鲜自溶酶解可获游离氨基数8.92 g,总氨基酸量10.83 g,水解产物中的游离氨基酸和总氨基酸量占蚯蚓总蛋白质的比例分别为72.24%和87.71%,其中约15.47%的蚯蚓蛋白质水解为活性较高的小分子肽,总水解率接近90%,这一结果与刘波[9]等采用枯草蛋白酶(Asl.398)水解蚯蚓蛋白质的效果相比有显著提高,相比而言,枯草蛋白酶(Asl.398)的总水解率只有32.33%,可见最佳条件下利用蚯蚓自溶酶解工艺是获得高活性复合蚯蚓氨基酸,提高蚯蚓利用途径和经济效益有效的技术选择。
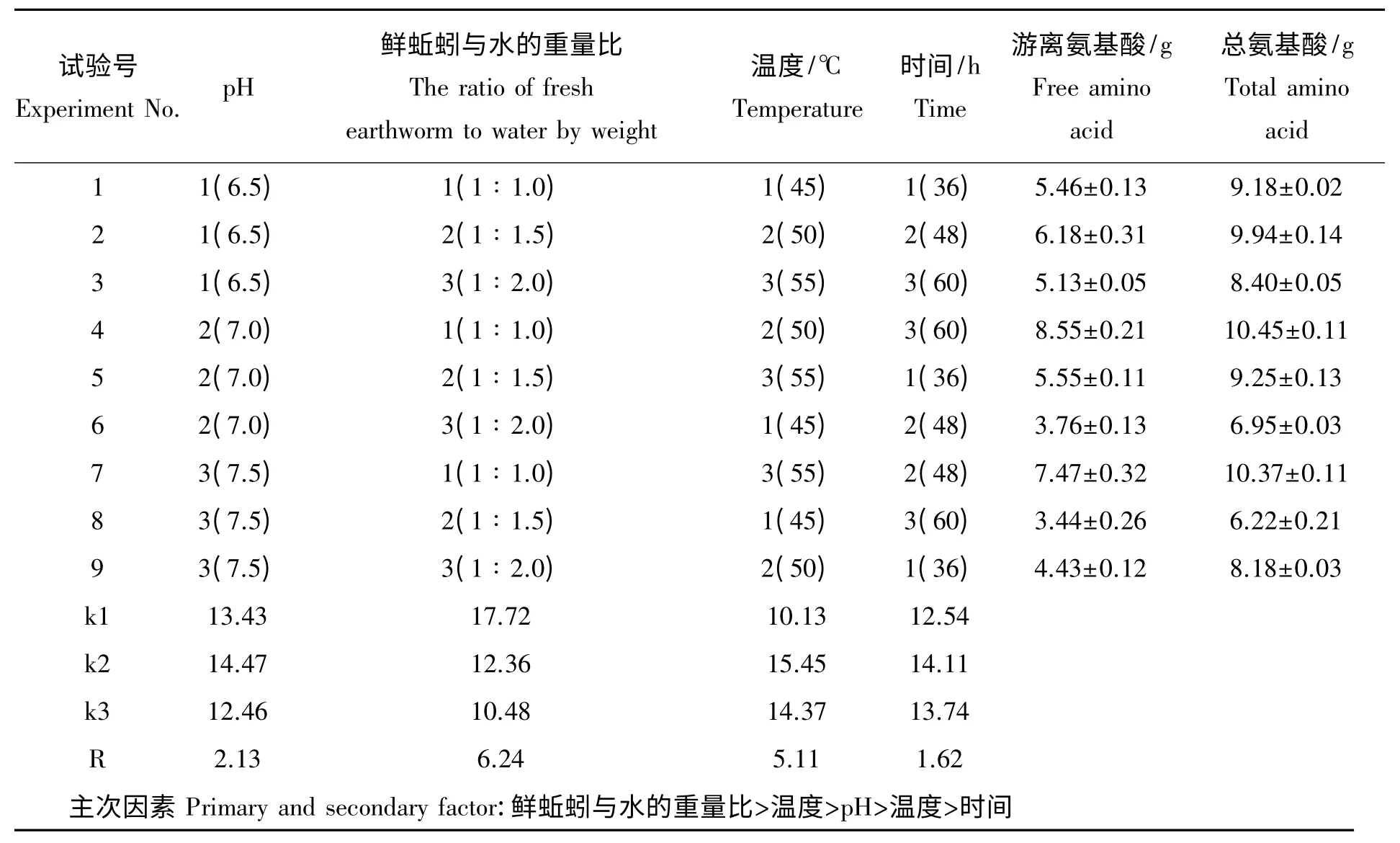
表1 自溶酶解蚯蚓正交试验L9(34)极差分析结果Tab.1 Results of range analyses for orthogonal experiment L9(34)of earthworm hydrolysate with self enzymes
此外对正交试验结果进行方差分析,结果见表2。由表2 可知根据F 值小,进一步可知影响蚯蚓自溶酶解蚯蚓蛋白形成游离氨基酸及氨基酸总量的上述四个因素主次关系为:鲜蚯蚓与水的重量比>温度>酸碱度>时间,其中鲜蚯蚓与水的重量比、温度、酸碱度的影响达到了差异显著水平(P<0.05)。上述结果进一步说明进行蚯蚓自溶酶解的最佳条件是:pH 7.0、鲜蚯蚓与水的重量比1∶1.5、温度50 ℃、反应时间48 h,此时产物中的游离氨基酸量和总氨基酸量最大。
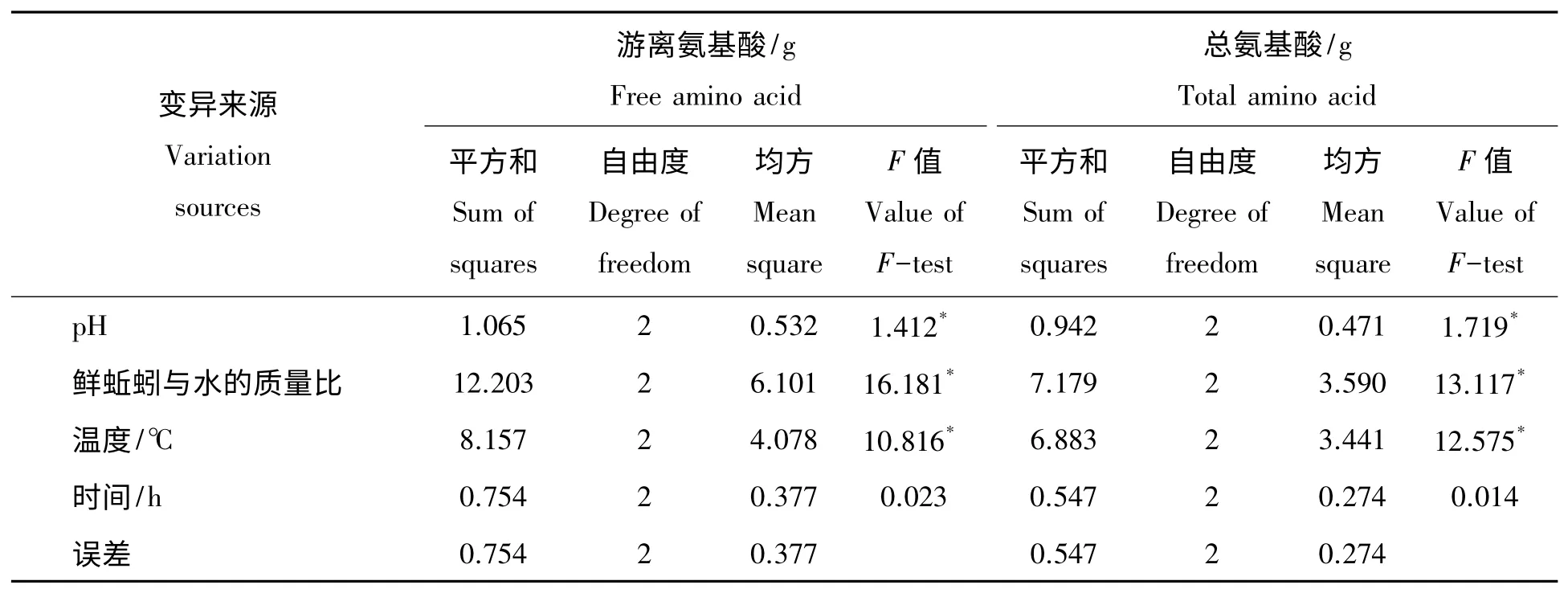
表2 自溶酶解蚯蚓正交试验L9(34)方差分析结果Tab.2 Results of variance analysis for orthogonal experiment L9(34)of earthworm hydrolysate with self enzymes
2.2 自溶酶解产物分析
(1)自溶酶解产物分子量分布。由图5 和表3 可知:最佳自溶酶解条件下,蚯蚓的酶解产物中,大部分是分子量在5 000 以下的多肽、小肽及氨基酸,其中分子量300~5 000的占了约9.40%,分子量300以下占了88.44%,这表明蚯蚓通过自身蛋白水解酶自溶酶解,酶解产物以小分子量氨基酸和肽为主,水解效果良好。这一结果也进一步表明,利用蚯蚓自身体内的酶进行蚯蚓的自溶水解,生产复合氨基酸产品具有可行性,采用该工艺,其生产成本将相对较低。同时由于自溶酶解产物中,分子量300 以下占了88.44%,这为利用自溶酶解蚯蚓获得的产物进一步制备新型氨基酸微量元素生化产品,进而再提升蚯蚓的经济利用价值提供了良好条件,这一结论在美国饲料管理官方协会(AAFCO)的规定中得到支持,其明确指出利用可溶性金属盐中金属离子与氨基酸制备氨基酸微量元素螯合物的摩尔比为1∶1 或1∶3,其中1∶2 较理想,氨基酸分子量平均为150 左右,获得的螯合物分子量不得超过800[14]。

图5 标准蛋白样品(A)和蚯蚓自溶水解产物(B)高效液相色谱分析图Fig.5 Analysis chromatogram of standard protein(A)and the earthworm self enzymatic hydrolysate(B)

表3 蚯蚓自溶酶解产物相对分子量的分布范围Tab.3 Distribution of relative molecular weights of the self enzymatic hydrolysate of earthworm
(2)酶解产物游离氨基酸分析。由表4 可知,100 g 鲜蚯蚓自溶酶解产物中,赖氨酸、谷氨酸、亮氨酸、苯丙氨酸和精氨酸相对含量比较多,分别达到2.93、1.16、1.16、1.06 及0.92 g,自溶酶解产物原液中总氨基酸有10.83 g,18 种游离必需氨基酸达8.92 g,占总氨基酸的82.36%,其中鲜味氨基酸中的谷氨酸和赖氨酸分别占总氨基酸的10.71%和27.08%。由此可知,蚯蚓自溶酶解产物中氨基酸含量丰富,必须氨基酸含量高,且相对平衡,这一特征表明蚯蚓自溶酶解产物具有开发成氨基酸饲料添加剂及其它农用生化产品的潜力。
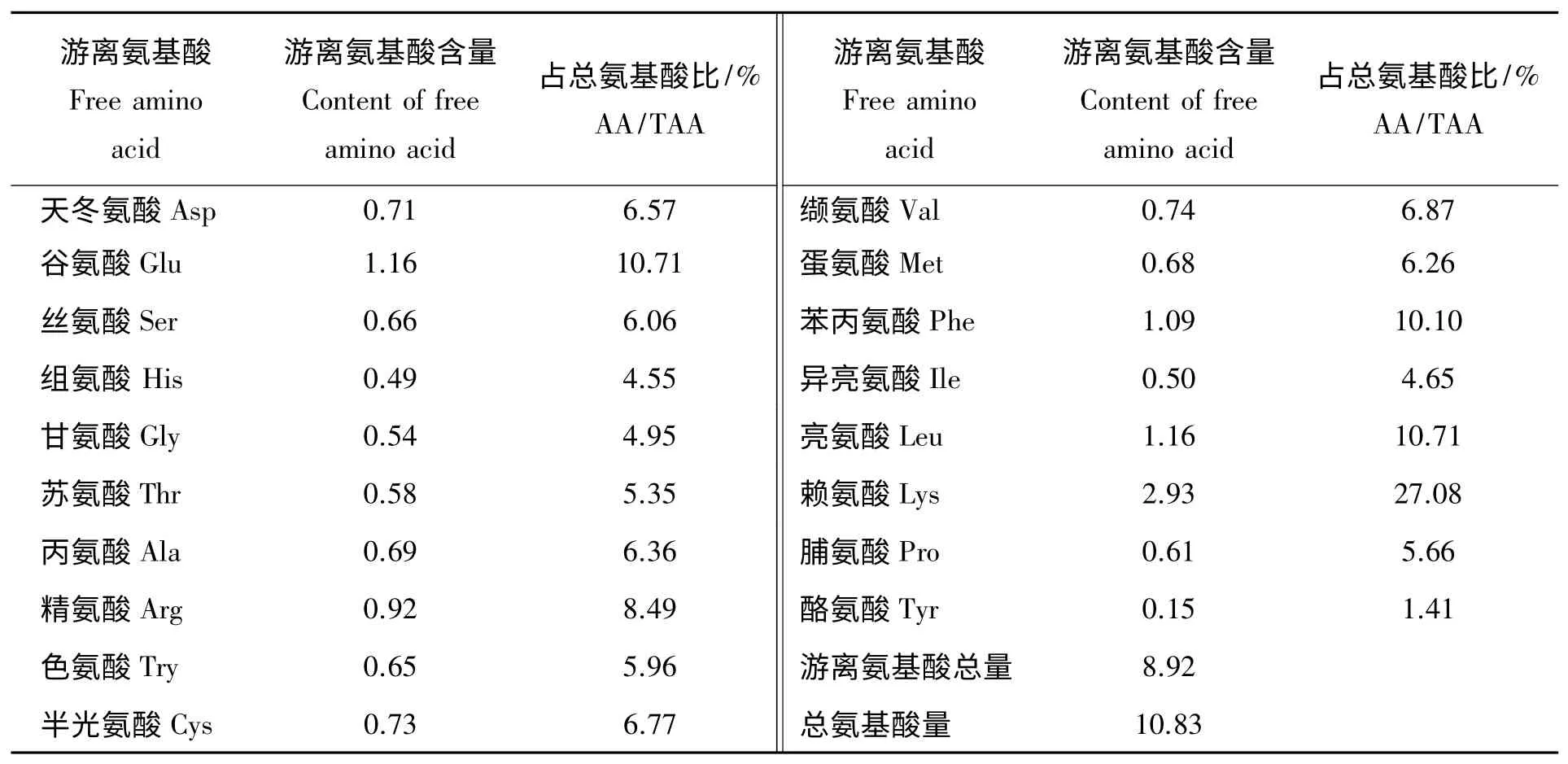
表4 蚯蚓自溶酶解产物中游离氨基酸含量分布(g/100 g 鲜蚯蚓)Tab.4 Distribution of free amino acids content in the self enzymatic hydrolysate of earthworm(g/100 g fresh earthworm)
3 结论与讨论
通过上述试验研究表明,蚯蚓蛋白酶自溶水解工艺的最佳条件是:pH 7.0、鲜蚯蚓与水重量比为1∶1.5、温度50 ℃、水解反应时间48 h,在此最佳自溶酶解条件下水解液中的氨基氮数最大,此时总水解率为90%,其中约15.47%的蚯蚓蛋白质水解为活性较高的小分子肽,这一结果显著高于刘波[9]等采用枯草蛋白酶(Asl.398)水解蚯蚓蛋白质的总水解率(32.33%)[9],原因是蚯蚓消化道有包括纤溶酶等在内的10 多种蛋白水解酶,这些酶都具有较强的蛋白质水解活性[1-5],水解过程相互协同的结果。同时获得的酶解产物中大部分是分子量5 000以下的多肽、小肽及氨基酸组成,其中分子量在300 以下的占比接近90%,达到了88.44%。同时研究结果表明水解产生的氨基酸中组成平衡,含有18 种必需氨基酸,其中赖氨酸、谷氨酸、亮氨酸、苯丙氨酸和精氨酸相对含量比较多,特别是鲜味氨基酸中的谷氨酸和赖氨酸分别占总氨基酸的10.71%和27.08%。相似的结果在刘波等[9]及王彬彬等[10-11]在采用Asl.398枯草中性蛋白酶酶解蚯蚓试验结果得到证实。可见蚯蚓自溶酶解产物中氨基酸含量丰富,必须氨基酸含量高,且相对平衡,这一特征表明蚯蚓自溶酶解产物可用于制取氨基酸饲料添加剂及其它农用生化产品,如氨基酸叶面肥、复合蚯蚓氨基酸营养保健液、氨基酸农药等。相似应用方式在其他高蛋白物质酶解再加工研究中得到验证[11,15-17]。
此外试验结果表明,蚯蚓蛋白酶自溶水解产物中除了丰富的游离氨基酸外,还含有一定量的小分子肽,研究发现约15.47%的蚯蚓蛋白质水解为活性较高的小分子肽,说明蚯蚓蛋白酶自溶水解产物也可作为小分子肽类添加剂制备的重要原料。有关蛋白质在肠道中的吸收利用研究表明,蛋白质在肠道中并非全部水解为氨基酸,以自由氨基的形式吸收和转运的为80%,其余很大一部分为小分子肽(主要是二肽、三肽),因此,对于饲料而言,要想获得最佳生产性能,必须要有一定量的完整氨基酸和小分子肽存在饲料中[18]。可见,蚯蚓蛋白酶自溶水解产物是制备这类高生产性能饲料的重要可选原材料,而蚯蚓来源广泛,成本相对低,极具开发潜力[19]。另外研究中发现,蚯蚓酶自溶酶解产物中游离的谷氨酸、亮氨酸、赖氨酸等相对含量比较高,而以谷物为主的饲料原料中的赖氨酸含量甚低,且加工过程中易被破坏导致缺乏,这样添加蚯蚓酶解产物能起到平衡氨基酸的作用,提高饲料的营养价值。同时由于蚯蚓酶解产物中赖氨酸和谷氨酸含量相对较多,具有调节食物口味作用,添加蚯蚓酶解产物后,将提高动物的适口性和采食量。因此充分利用蚯蚓的生物活性成分和氨基酸组成特征,对蚯蚓进行深加工,生产高生产性能的动物饲料将是一重点方向。
总之通过上述研究表明,蚯蚓可通过自身蛋白酶水解,获得氨基酸和活性小分子肽丰富的水解产物,该方法对蚯蚓进行进一步深加工,提高经济效益而言,是一相对价廉,投入少,且实施方便的工艺,可见其应用前景广阔。
[1]武金霞,赵晓瑜.蚯蚓体内生物活性成分的研究[J].自然杂志,2004(26):27-30.
[2]Zhao J,Li L,Wu C,et al.Hydrolysis of fibrinogen and plasminogen by immobilized earthworm fibrinolytic enzyme II from Eisenia fetida[J].International Journal of Biological Macromolecules,2003,32(3-5):165-171.
[3]Wu J X,Zhao X Y,Pan R,et al.Glycosylated trypsin-like proteases from earthworm Eisenia fetida[J].Biological Macromolccules,2007,40(5):399-406.
[4]Pan R,Zhao Y,He H J,et al.An enzyme from the earthworm Eisenia fetida is not only a protease but also a deoxyribonuclease[J].Biochemical and Biophysical Research Communications,2011,407(1):113-117.
[5]Yang J,Lv B Y,Zhang J,et al.Insight into the roles of earthworm in vermicomposting of sewage sludge by determining the water-extracts through chemical and spectroscopic methods[J].Bioresource Technology,2014,154:94-100.
[6]蔡明才,艾娜,张梁,等.蚯蚓蛋白质的自溶与开发应用[J].生物学通报,2004,39(4):23-24.
[7]BOZA J J,Martinez-Augustin O,Baro L,et al.Protein V.enzymatic protein hydrolysates nitrogen utilization in started rats[J].Br J Nutr,1995,73(1):65-71.
[8]冯健,高玲,刘永坚,等.草鱼日粮中虾蛋白肽对幼龄草鱼生长性能的影响[J].中山大学学报:自然科学版,2004,43(2):100-103.
[9]刘波,谢骏,郑小平,等.蚯蚓蛋白酶解工艺及其产物分析[J].上海水产大学学报,2006,15(1):78-83.
[10]王彬彬,聂俊华,李志强,等.外源蛋白酶对蚯蚓蛋白酶解的影响[J].中国农学通报,2009,25(1):224-228.
[11]王彬彬.蚯蚓蛋白酶解工艺与氨基酸螯合盐的制备及生物效应研究[D].泰安:山东农业大学,2009.
[12]张意静.食品分析技术[M].北京:中国轻工业出版社,1996.
[13]Lowry O H,Rosebmugh N J,Farr AL,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193:265-275.
[14]颜新春.有机微量元素螯合物在动物生产中的应用[J].饲料博览,2005(3):46-48.
[15]朱连龙,熊爱生,彭日荷,等.酶制剂在农业中的应用及生物技术改良[J].中国农学通报,2007,23(3):62-65.
[16]李典友,潘根兴,向昌国,等.土壤中蚯蚓资源的开发应用研究及展望[J].中国农学通报,2005,21(10):340-347.
[17]郝晓霞,罗明,余淑娴.酶解技术及其应用[J].江西科学,2007,25(3):355-357.
[18]孙忠保,阎宏.动物小肽营养研究新进展[J].宁夏农学院学报,2004,25(2):80-84.
[19]Aldyama T,Mural T,Hirasawa Y.Supplementation of various meals to fish meal diet for chum salmon fry[J].Aquaculture,1984,37:217-222.

