链霉菌JD211 活性物质的分离纯化
黄国强,李庆蒙,李昆太,黄 林,程 新,魏赛金
(江西农业大学 生物科学与工程学院,江西 南昌 330045)
江西农业大学生物科学与工程学院应用微生物研究室在开展农用抗生素产生菌的分离筛选中,从庐山植物园珙桐植株中分离得到一株产灰褐色孢子的链霉菌,编号为JD211。初步研究发现,JD211 属奈良链霉菌(Streptomyces naraensis),该菌发酵液的乙醇浸提液对水稻纹枯病菌、稻瘟病菌、根霉、烟草黑胫病菌、犁头霉、胶胞炭疽病菌、西瓜枯萎病菌等多种植物病原真菌具有较强的抑制作用[1]。为了进一步对发酵液中抗菌物质进行研究,本文对链霉菌JD211 发酵液中抗菌成分进行分离纯化。
1 材料与方法
1.1 材料与仪器
链霉菌JD211 菌株(Streptomyces JD211,意大利青霉(Penicillium italicum Wehmer)由江西农业大学生物科学与工程学院实训基地提供抗菌活性测定培养基(g/L):去皮土豆200 g,蔗糖20 g,琼脂20 g,水1 000 mL,pH 自然。RE-52AA 旋转蒸发仪,UV765 紫外可见分光光度计,SKY-2112B 型恒温双层摇床,RH-250A 生化培养箱,SW-CJ-2G 型超净工作台,LDZX-50KBS 立式压力蒸汽灭菌器,GF-254 层析板,20 mm×400 mm(容积为100 mL)层析柱,BS223S 电子天平,LCMS-8030 超快速三重四级杆液质联用仪。
1.2 实验方法
1.2.1 链霉菌JD211 活性物质的粗提取 将链霉菌JD211 菌株接种于PDA 斜面上,30 ℃培养7 d,制备孢子悬液,调整孢子悬液的浓度为1×108CFU/mL,按7.5%的接种量接种于发酵培养基中,于30 ℃160 r/min 摇床培养7 d。取发酵液,加等体积的工业酒精浸提24 h,真空抽滤,取滤液。滤饼再次提取,方法同上。将2 次滤液合并真空浓缩10 倍体积,得到初步提取物。取6 份上述初提物,每份10 mL,分别加入等量的石油醚、乙醚、苯、氯仿、乙酸乙酯、正丁醇等萃取剂,充分混匀,静置萃取过夜,两相分离。采用管碟法[2]以意大利青霉为指示菌测定各萃取液的抑菌活性,以确定活性成分的极性大小,每个实验设3 个重复。选取最佳萃取剂对所得初提物进行萃取,将萃取液用旋转蒸发仪浓缩成膏状物,得到活性组分的粗提物。
1.2.2 硅胶柱层析 柱层析硅胶(100~200 目)为固定相,采用湿法装柱[3]。洗脱,一次硅胶柱层析选取常用的氯仿-甲醇洗脱体系,梯度为纯氯仿、氯仿甲醇比例分别为:60∶1、40∶1、20∶1、10∶1、5∶1、2∶1 和纯甲醇。二次硅胶柱层析选取石油醚-乙酸乙酯洗脱体系,梯度为石油醚、石油醚乙酸乙酯比例分别为:20∶1,10∶1,8∶1,5∶1,3∶1,1∶1,1∶5,1∶10 乙酸乙酯,氯仿,甲醇共12 个梯度进行洗脱,洗脱条件:流速为1.5 mL/min,将洗脱液浓缩至12 mL。以意大利青霉为指示菌采用管碟法测定抑菌活性,对照为相应的空白洗脱液。
1.2.3 薄层层析 取柱层析后所得的抑菌活性的洗脱液于GF-254 层析板上点样,以石油醚-乙酸乙酯(体积比1∶5)为展开剂[4]。将层析板在365 nm 波长的紫外分析仪下显色,刮下亮带置于加有5 mL 石油醚:乙酸乙酯溶液(体积比1∶5)的离心管中,充分震荡溶解硅胶中的组分,再次展开,计算条带的Rf值。参照1.2.2 的方法取溶解好的组分进行抑菌活性测定。
1.2.4 液质联用检测层析效果 液相条件:流动相为A:5 mmol/L 醋酸铵水溶液;B:甲醇。洗脱梯度为:0~9 min,10%~90%B;9~10 min,90%B;10~11 min,90%~10%B;平衡4 min,一次进样运行15 min。质谱分析:采用全扫描(Full Scan)模式,扫描范围为100~900 amu,正离子和负离子同时扫描,分别对放线菌酮标准品和样品扫描[5-7]。
2 结果与分析
2.1 不同萃取剂的萃取效果
不同萃取剂提取链霉菌JD211 发酵粗提物对意大利青霉的抑菌活性如图1 所示。由图1 可知:正丁醇、乙酸乙酯萃取物表现出明显的抑菌效果,氯仿萃取物次之,苯、乙醚、石油醚萃取物对意大利青霉均无抑菌效果,其中以正丁醇萃取物的抑菌活性最高。因此,初步确定放线菌JD211 发酵粗提物属于中等极性物质。
2.2 硅胶柱层析结果
2.2.1 氯仿-甲醇梯度洗脱 由2.1 得出活性物质属于中等极性物质,选取中等极性洗脱剂氯仿-甲醇洗脱体系。每个洗脱梯度的抑菌活性结果如图2,只有用氯仿作为洗脱剂时有抑菌活性,并且抑菌活性很高,而其余梯度均无抑菌活性,说明氯仿-甲醇洗脱体系不能用于放线菌JD211 活性产物的柱层析分离。因此,选取极性较低的石油醚-乙酸乙酯体系作为柱层析的洗脱剂。
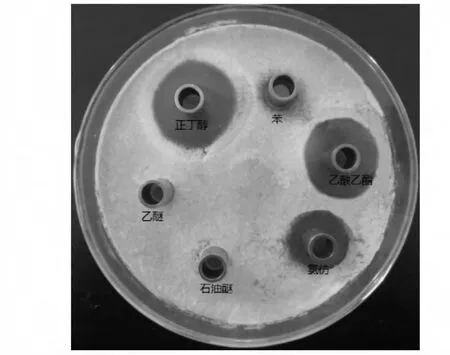
图1 不同萃取剂的萃取效果Fig.1 The extraction effects of different extractants
2.2.2 石油醚-乙酸乙酯梯度洗脱 当石油醚∶乙酸乙酯体积比为1∶5 洗脱时,洗脱液具有很好抑菌活性,抑菌圈直径为4.5 cm。其余洗脱液表现出无或极弱的抑菌活性,如图3 所示。
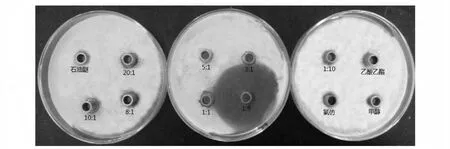
图3 石油醚-乙酸乙酯梯度洗脱效果Fig.3 The effect of petroleum ether and ethyl acetate gradient elution
2.3 薄层层析结果
石油醚-乙酸乙酯(体积比1∶5)洗脱液进行薄层层析试验发现,在365 nm 紫外波长显色下,各组分基本呈单一的斑点,并且斑点之间分开比较明显。根据各斑点的展层距离,计算出各个斑点的Rf 值见表1。以意大利青霉为指示菌对各种样品进行抑菌活性检测,结果如图4 所示:样品3 具有最高的抑菌活性,其抑菌圈直径为3.3 cm;样品4 的抑菌圈直径为1.7 cm。除样品3 和样品4 表现出抑菌活性外,其余样品均无抑菌活性。
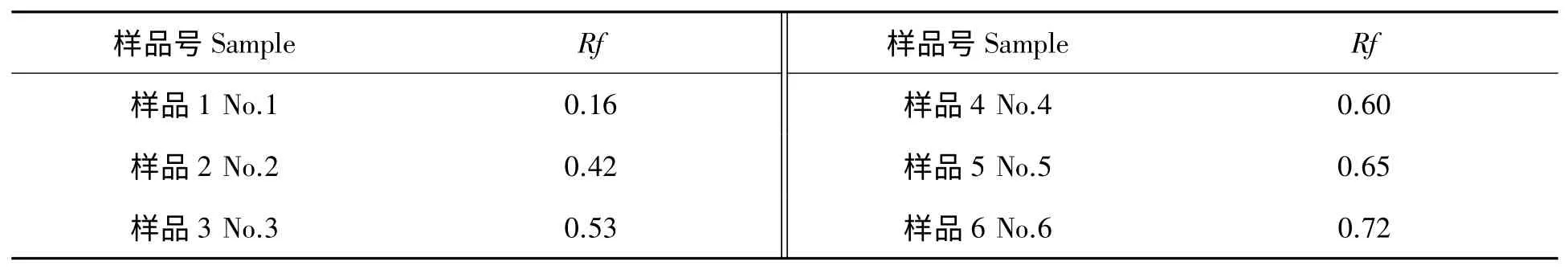
表1 链霉菌JD211 所产活性组分的相对迁移率Tab.1 The migrating rate of the antimicrobial substance produced by Streptomyces JD211
2.4 液质联用测定结果
放线菌酮标准品的分子量为281.35,通过其扫描图谱可以看出,正离子和负离子图谱中分别出现目标离子峰:m/z 282.10[M+H]+;m/z[M-H]-280.25。因此可以用其作为检测样品中是否含有放线菌酮类物质的目标离子。
2.4.1 样品3 离子全扫描图谱 图5 中红线为正离子扫描模式,黑线为负离子扫描模式。选取正离子和负离子都存在且保留时间一致的峰(7 min 出现的那个峰),做进一步质谱分析。
2.4.2 样品3 正离子和负离子扫描图谱 通过对7 min 出现的峰做正离子和负离子扫描(图6),得出其含有和放线菌酮标准品相同的目标离子峰。可以确定样品3 中含有放线菌酮类物质,且其分子量和放线菌酮标准品相同。

图4 不同Rf 值条带的抑菌结果Fig.4 The result of activity examination of different Rf vaule
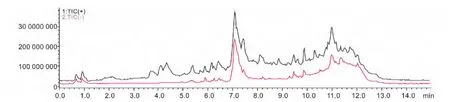
图5 样品3 离子全扫描图谱Fig.5 Chromatogram of the sample 3 under full-scan mode

图6 样品3 在正、负离子扫描模式下的质谱Fig.6 MS of sample 3 under positive and negative scanning mode
3 结论
链霉菌JD211 产生的活性产物能很好的溶解在正丁醇中,其次为乙酸乙酯;微溶于氯仿;不溶于苯、乙醚和石油醚等低极性的有机溶剂。用石油醚-乙酸乙酯(体积比1∶5)作为洗脱剂进行硅胶柱层析时洗脱液具有最大的抑菌活性。薄层层析时以石油醚-乙酸乙酯(体积比1∶5)作为展开剂展开时,Rf 值为0.53和0.6 时具有抑菌活性。
前期研究表明链霉菌JD211 为属奈良链霉菌(Streptomyces naraensis),而奈良链霉菌的主要代谢产物为放线菌酮类物质[8],放线菌酮又属于戊二酰亚胺类抗生素[9],因此在液质联用检测链霉菌JD211活性物质采用放线菌酮为标准品。目前发现的放线菌酮类抗生素己有20 种以上,这类抗生素结构上的共同特点是具有一个戊二酰亚胺(Glutarimide)的六元环,环的C-4 位上有侧链,侧链多成环,少数为直链[10]。本研究确定了菌株JD211 的活性产物属于戊二酰亚胺类抗生素,但其具体的分子结构和空间构象有待于进一步研究。
戊二酰亚胺类抗生素大多都具有抗肿瘤和抗病毒活性[11~15],也是目前研究较多的抗肿瘤抗生素。在确定了菌株JD211 活性产物分子结构和空间构象的基础上可以进行抗病毒和抗肿瘤实验,确定其抗病毒和抗肿瘤活性。
[1]李庆蒙,王世强,李昆太,等.拮抗放线菌JD211 的抑菌活性及其鉴定[J].生物灾害科学,2013,36(4):394-398.
[2]伊守亮,肖林,顾正华,等.管碟法测定Nisin 效价[J].无锡轻工大学学报,2004,23(4):41-45.
[3]贾波,金志华,张达,等.硅胶柱层析法分离普那霉素[J].浙江大学学报:工学版,2008,42(5):895-899.
[4]李昆太,彭卫福,周佳,等.一株产紫杉醇的南方红豆杉内生菌的分离与鉴定[J].江西农业大学学报,2013,1:184-188.
[5]孟兆玲,齐元英,柳仁民.高效液相色谱——质谱联用技术的应用进展[J].化学分析计量,2006,15(6):99-103.
[6]姜艳艳,刘斌,石任兵.高效液相色谱——质谱联用技术在天然产物分离鉴定中的应用[J].药品评价,2005,2(1):11-16.
[7]施理纳.有机化合物系统鉴定手册[M].北京:化学工业出版社,2007:165-171.
[8]Okuda T,Ashino K,Egawa Y,et al.Studies on streptomyces Antibiotic,cycloheximide.I.isolation of naramycin-A and its identification with cycloheximide[J].Chem Pharm Bull,1958,6:711-715.
[9]张致平.微生物药物学[M].北京:化学工业出版社,2003:364-366.
[10]Saito N F,Kitame M,Kikiichi,et al.Studies on a new antiviral antibiotic.9-mcthylstrcptiniidonc.I.Physicochemical and biological properties[J].J Antibiot,1974,27:206-214.
[11]Sonoda T H,Osada J,Uzawa,et al.Actikctal,a new member of the glutarimide antibiotics[J].J Antibiot,1991,44,160.
[12]Sugawara K Y,Nishiyama S,Toda N,et al.Lactimidomycin,a new glutarimide group antibiotic.Production,isolation,structure and biological activity[J].J Antibiot,1992,45:1433-1441.
[13]Lim S K,Jiu E J,Zazopoulos H Jiang,et al.iso-Migrastatin,migrastatin,and dorrigocin production in Strcptomvccs platcnsis NRRL 18993 is governed by a single biosynthetic machinery featuring an acyltransferase-less type I polyketide synthase[J].J Biol Chem,2009,284:29746-29756.
[14]LI Ming Gang,WU Shao Hua Z,Li Xing,et al.Isolation and structure elucidation of autolytimycin,a new compound produced by Strcptomyces autolyticus JX-47[J].Chinese Chemical Letters,2002:903-906.
[15]Wrona I E,Gozman T A,Taldone G C,et al.Synthesis of rcblastatin,autolytimycin,and non-benzoquinone analogues:potent inhibitors of heat shock protein 90[J].The Journal of Organic Chemistry,2010,75:2820-2835.

