多噬伯克霍尔德氏菌WS-FJ9 磷酸酶产生的细胞定位及营养条件优化
李冠喜,吴小芹,叶建仁
(1.南京林业大学 森林资源与环境学院,江苏 南京 210037;2.连云港市农业科学院,江苏 连云港 222006;3.江苏省入侵有害生物预防与控制重点实验室,江苏 南京 210037)
在土壤磷库中,有机磷的含量占全磷的比例约为15%~80%[1-2],我国大部分土壤中有机磷占全磷的比重为20%~50%[3]。土壤中有机磷主要有磷酸肌醇、磷酯和核酸、少量的磷蛋白和磷酸糖以及微生物量磷,其中肌醇磷酸盐含量最高,占有机磷总量的一半左右[4]。微生物分泌的磷酸酶是土壤中有机磷降解酶的主要来源,在磷酸酶的作用下,有机磷大分子变为小分子的无机磷,从而植物可以直接吸收和利用。因此,土壤中的有机磷是植物可利用磷的重要来源[5]。
磷酸酶是一个系统名称,代表一组可催化磷酸酯或磷酸酐水解的酶。国际生物化学联合会酶学委员会将这些酶划分为5 大类,分别为磷酸单酯水解酶,磷酸二酯水解酶,二磷酸单酯水解酶,作用于含磷酸酐的酶和作用于P-N 键的酶。其中研究最为深入的是酸性磷酸单酯水解酶(简称为酸性磷酸酶,ACP)和碱性磷酸单酯水解酶(简称为碱性磷酸酶,AKP),前者分布于酸性土壤中而后者在碱性土壤中占优势[6],本研究主要探讨了多噬伯克霍尔德氏菌Burkholderia multivorans WS-FJ9 所分泌的ACP 和AKP 在胞外胞内的定域表达及其降解有机磷的最佳条件。WS-FJ9 为本实验室在前期研究中从松树根际筛选获得的一株高效解磷细菌,前期的研究表明,该菌对哺乳动物和植物安全可靠,能够在杨树根际稳定定殖,具有促进植物生长、生物防治和生物降解等功能[7-9]。本研究旨在探索该菌株的酶促反应条件,并为解磷酶制剂及生物菌肥的研发提供参考依据。
1 材料与方法
1.1 供试菌株
供试菌株为多噬伯克霍尔德氏菌Burkholderia multivorans WS-FJ9,由本实验室分离筛选所得,保藏于中国典型培养物保藏中心CCTCC(NO.CCTCC M2011435)[10]。
1.2 供试培养基
蒙金娜基础培养基:葡萄糖l0 g,(NH4)2SO40.5 g,NaCl 0.3 g,KCL 0.3 g,FeSO4·7H2O 0.03 g,Mn-SO4·4H2O 0.03 g,MgSO4·7H2O 0.3 g,CaCO35 g,卵磷脂0.2 g,水1 000 mL,pH 调节至7.2~7.4。
1.3 磷酸酶活性的测定
1.3.1 试剂的配制 (1)改进的通用缓冲试剂(modified universal buffer,MUB)储备液的配制。取12.1 g三羟甲基氨基甲烷、11.6 g 顺丁烯二酸,14.0 g 柠檬酸和6.3 g 硼酸溶于488 mL 氢氧化钠溶液(1 mol/L)中,再用蒸馏水稀释至1 L,储存于冰箱中。
(2)通用缓冲试剂(MUB)(pH 为6.5 和11)的配制。取200 mL MUB 储备液用0.l mol/L 的盐酸滴定至pH 6.5,再用蒸馏水定容至1 L;另取200 mL MUB 储备液用0.l mol/L 的氢氧化钠滴定至pH 11,再用蒸馏水定容至1 L。
(3)对硝基苯磷酸二钠溶液的配制。取0.630 g 对硝基苯磷酸二钠(PNPP)溶于40 mL MUB(pH 为6.5 的用于检测酸性磷酸酶,pH 为11 时用于检测碱性磷酸酶)中,再用相同pH 的MUB 分别将溶液定容至50 mL(浓度为0.025 mol/L)并储存于冰箱中,24 h 内现配现用。
1.3.2 磷酸酶活性测定 参照钟传青[11]的方法,取l mL 细胞提取液于干净试管中,加入4 mL MUB(检测酸性磷酸酶时用pH 6.5 的MUB,检测碱性磷酸酶时用pH 11 的MUB),再加入用相同缓冲液配制成的0.025 mol/L 对硝基苯磷酸二钠溶液1 mL 后震荡几秒钟,塞住瓶塞于37 ℃水浴1 h,打开瓶塞,加入0.5 mol/L 的氯化钙1 mL 和0.5 mol/L 的氢氧化钠4 mL 并震荡混匀,离心(4 ℃,7 000 r/min)5 min后,上清液于420 nm 处比色。酶活力单位定义为以1 min 内1 L 发酵液中作用于底物产生硝基苯酚的微摩尔数,记为μmol/(L·min)。
1.4 WS-FJ9 细胞提取液的制备与磷酸酶定域的测定
参照戴树桂等[12]和陈丹[13]的方法,先取菌液离心(6 000 r/min,10 min),上清液(S1)冻存;沉淀(P1)用10 mL(pH 8.0)10 mmol/L Tris-HCl 重悬,离心(6 000 r/min,10 min),洗涤2 次,上清液(S2)冻存;沉淀(P2)以10 mL 25%蔗糖溶液重悬,于25C 振荡10 min,离心(6 000 r/min,10 min),上清液(S3)冻存;沉淀(P3)加冷双蒸水重悬,在冰浴中振荡10 min,离心(6 000 r/min,10 min),上清液(S4)冻存;沉淀(P4)用10 mL(pH 8.0)50 mmol/L Tris-HCl 重悬,冰浴中超声破碎细胞(间隔3 s,共破碎4 min),离心(10 000 r/min)10 min 后,上清液(S5)冻存,沉淀(P5)弃去。将S1、S2、S3 合并,即为胞外提取液,S4 为膜周质提取液,S5 为膜内提取液。采用1.3.2 的方法分别测定各类提取液酸、碱性磷酸酶活性,判断磷酸酶在细胞内的具体定位。
1.5 不同营养条件下磷酸酶活性和解磷量的测定
先固定氮源为蛋白胨、磷源为卵磷脂,筛选出最佳碳源;再固定碳源为筛选出的最佳碳源、磷源为卵磷脂,筛选出最佳氮源;最后固定碳、氮源为筛选出的最佳碳、氮源,筛选出最佳磷源。将蒙金娜基础培养基的碳源分别改为蔗糖、果糖、麦芽糖、乳糖和甘露醇,氮源分别改为蛋白胨、牛肉膏、硝酸钾、硝酸铵、硝酸钙,磷源分别改为植酸钙、草甘膦、Ca3(PO4)2进行营养条件优化;调节蒙金娜基础培养基卵磷脂加入量0.1、0.3、0.5、0.7 和0.9 g 测定卵磷脂浓度对WS-FJ9 菌株磷酸酶活性及解磷能力的影响;所有处理均采用相同体积培养液(50 mL)接种相同体积的种子液(500 μL)并设置3 次重复,以接种相同体积空白种子液的解磷培养基为对照(CK),28 ℃,200 r/min 振荡培养72 h 后,发酵液转移至50 mL 离心管中,加入0.5 g 无磷活性炭,采用SM-650D 型超声波细胞破碎仪进行细胞破碎20 min 后离心(4 ℃,10 000 r/min)10 min,分别取上清液测定磷酸酶活性和可溶性磷含量。可溶性磷含量的测定采用钼锑抗比色法(张祥胜,2008)。
1.6 数据分析与处理
采用Origin 8.6 软件进行数据统计分析、差异显著性检验(P<0.05)及图表绘制。
2 结果与分析
2.1 多噬伯克霍尔德氏菌WS-FJ9 磷酸酶的细胞定位
WS-FJ9 菌株磷酸酶定域如图1 所示。图1 表明,菌株WS-FJ9 既可以产生酸性磷酸酶也能产生碱性磷酸酶,且2 种酶在细胞内、胞外细胞膜中均有存在。其中以细胞外分布为最高,酶活分别为71.8 μmol/(L·min)和22.8 μmol/(L·min);细胞内次之,酸性磷酸酶和碱性磷酸酶分别为32.1 μmol/(L·min)和8.5 μmol/(L·min);细胞膜周的酶活性最低。据此认定该菌株的酸性磷酸酶和碱性磷酸酶均主要定位于细胞外,即主要是通过分泌到胞外对有机磷进行分解。研究还发现无论是胞内、胞外还是膜周,酸性磷酸酶的含量都高于碱性磷酸酶,尤其在胞外酸性磷酸酶占绝对优势,由此判断该菌以分泌酸性磷酸酶为主。因此后续试验仅测定酸性磷酸酶活性。
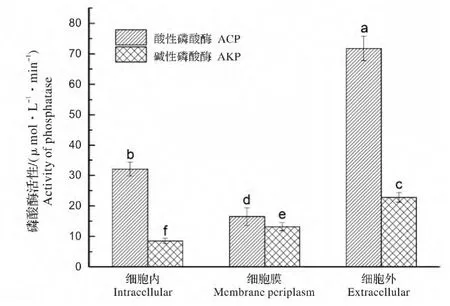
图1 多噬伯克霍尔德氏菌WS-FJ9 菌株磷酸酶的细胞定位Fig.1 Phosphatase cellular localization of strain B.multivorans WS-FJ9
2.2 碳源对WS-FJ9 菌株磷酸酶活性及解有机磷能力的影响
不同碳源对WS-FJ9 菌株磷酸酶活性及解磷能力的影响差异显著(P<0.05),从图2 可知,当以葡萄糖为碳源时,磷酸酶活性和解磷量均为最高,分别为240 μmol/(L·min)和430.5 mg/L;果糖的效果最差,仅分别为70.3 μmol/(L·min)和102.8 mg/L。因此判定在供试碳源中,葡萄糖为多噬伯克霍尔德氏菌WS-FJ9 分解有机磷能力发挥的最适碳源。
2.3 氮源对WS-FJ9 菌株磷酸酶活性及解有机磷能力的影响
从图3 中看出,不同的氮源对WS-FJ9 菌株磷酸酶活性和解磷能力影响差异显著(P<0.05)。以硫酸铵为氮源时,该菌株的磷酸酶活性及解磷能力最强,分别达到247.5 μmol/(L·min)和448.8 mg/L,而其他氮源的应用效果显著低于硫酸铵,尤其是以尿素为氮源时,该菌株的磷酸酶活性及解磷能力最低,仅为68.3 μmol/(L·min)和98.6 mg/L。因此硫酸铵为WS-FJ9 菌株解有机磷能力发挥的最适氮源。

图2 不同碳源对WS-FJ9 菌株磷酸酶活性和解磷能力的影响Fig.2 Effect of different carbon source on the phosphatase activity and P-dissolving ability of strain WS-FJ9
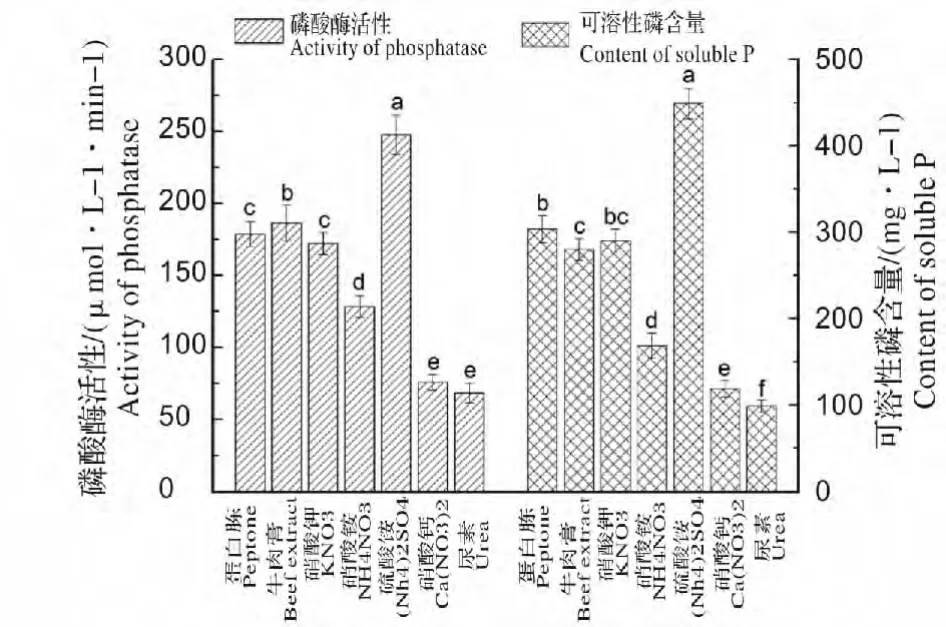
图3 不同氮源对WS-FJ9 菌株磷酸酶活性和解磷能力的影响Fig.3 Effect of different nitrogen source on the phosphatase activity and P-dissolving ability of strain WS-FJ9
2.4 磷源对WS-FJ9 菌株磷酸酶活性及解磷能力的影响
由图4 可知,不同磷源对WS-FJ9 磷酸酶活性及解磷能力的影响差异显著(P<0.05);以卵磷脂为磷源时,磷酸酶活性最高(为239.5 μmol/(L·min))但解磷量(为432.3 mg/L)低于Ca3(PO4)2而高于植酸钙和草甘膦;以Ca3(PO4)2为磷源时,磷酸酶活性最低[仅为48.5 μmol/(L·min)]但解磷量最高(为479.6 mg/L),推测WS-FJ9 菌株是通过磷酸酶以外的其他途径降解无机磷酸盐[Ca3(PO4)2]的;以草甘膦为磷源时,磷酸酶活性和解磷量分别为105.6 μmol/(L·min)和97.2 mg/L。因此卵磷脂为WSFJ9 菌株解有机磷能力发挥的最理想磷源。同时本实验发现该菌能对草甘膦进行有效降解,这对草甘膦农药残留的治理具有重要意义。
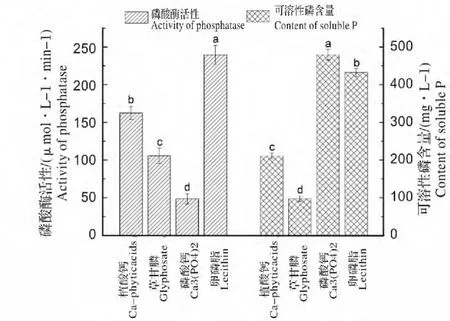
图4 不同磷源对WS-FJ9 菌株磷酸酶活性和解磷能力的影响Fig.4 Effect of different phosphorus source on phosphatase activity and P-dissolving ability

图5 卵磷脂浓度对WS-FJ9 菌株磷酸酶活性及解磷能力的影响Fig.5 Effect of different lecithin concentration on the phosphatase activity and P-dissolving ability of strain WS-FJ9
2.5 卵磷脂浓度对WS-FJ9 菌株磷酸酶活性及解磷能力的影响
WS-FJ9 菌株分泌的磷酸酶活性及解磷能力均受培养基卵磷脂加入量的影响。当卵磷脂的添加量低于0.5 g/L 时,其磷酸酶活性及解磷量随着卵磷脂添加量增加而增大,添加量为0.5 g/L 时,磷酸酶活性和解磷量分别为240 μmol/(L·min)和430.5 mg/L。其后,随着卵磷脂添加量增加其磷酸酶活性及解磷量并不增加,而是维持在相对恒定的值。由图5 可看出,卵磷脂浓度为0.5、0.7 和0.9 mg/L 时,磷酸酶活性及解磷量的差异均不显著(P<0.05)。说明WS-FJ9 菌株解有机磷培养基中添加0.5 g/L 的卵磷脂较为适宜。
3 结论与讨论
确定微生物分泌的磷酸酶定域表达对于研究有机磷的降解机制,开发有机磷降解酶制剂具有重要意义。戴树桂等[12]研究了2 种假单孢菌中二氯酚降解酶的酶学定域,结果该2 种菌产生的降解酶均主要定域在膜周及膜内。钟传青[11]研究了高效解磷菌巨大芽抱杆菌Bacillus megaterium P17 菌株的酶学定域,结果该菌酸性磷酸酶和碱性磷酸酶均为胞外酶,在发酵过程中大部分被分泌到胞外。陈丹[13]研究了高效解有机磷细菌蜡状芽孢杆菌Bacillus cereus JYZ-SD1 的磷酸酶定域表达,结果确定该酶为胞内酶。本研究结果显示,多噬伯克霍尔德氏菌B.multivorans WS-FJ9 分泌酸性磷酸酶和碱性磷酸酶,且以分泌酸性磷酸酶为主。胞外、胞内和膜周酸性磷酸酶活性分别为71.8、32.1 和16.5 μmol/(L·min);胞外、胞内和膜周碱性磷酸酶活性分别为22.8、8.5 和13.2 μmol/(L·min)。因此Burkholderia multivorans WS-FJ9酸性磷酸酶和碱性磷酸酶均定域为胞外酶。这和钟传青的研究结果一致而与陈丹的结果不同,原因可能是由微生物控制降解酶的基因不同所致。至于该菌磷酸酶的基因定位,有待于进一步研究。
不同微生物分泌的降解酶的酶特性有很大差异,对营养及环境条件的要求也各不相同。因此,本研究分别探讨了不同碳源、氮源、磷源以及培养基中不同卵磷脂浓度等不同的营养条件对多噬伯克霍尔德氏菌WS-FJ9 磷酸酶活性和解有机磷能力的影响。结果表明,该菌株解有机磷的最适碳、氮和磷源分别为葡萄糖、硫酸铵和卵磷脂,降解培养基中卵磷脂的最适浓度为0.5 g/L。硝酸铵和硫酸铵均可提供铵态氮源,但本研究中硫酸铵效果显著优于硝酸铵,推测其原因可能是硝酸铵中的硝酸根或其转化而来亚硝酸根对细菌生长产生了某种抑制作用。同时研究还发现,植酸钙和草甘膦均可作为磷源被该菌利用,这在农业生产和环境治理中具有重要的意义,该菌不但可用于土壤中植酸盐的降解而且还可应用于环境中草甘膦农药残留的治理。因此,本研究为生物菌肥和解磷酶制剂的研发与生产,以及农药残留的生物降解均提供了一定的参考依据。
[1]Jenkinson D S.Cycles of soil:Carbon,nitrogen,phosphorus,sulfur,micronutrients[J].Soil Sci,1987,144(5):387-388.
[2]赵少华,宇万太,张璐,等.土壤有机磷研究进展[J].应用生态学报,2004,15(11):2189-2194.
[3]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:1-10.
[4]Hayes J E,Richardson A E,Simpson R J.Components of organic phosphorus in soil extracts that are hydrolysed by phytase and acid phosphatase[J].Biol Fertil Soil,2000,32:279-286.
[5]Scott J T,Condron L M.Dynamics and availability of phosphorus in the rhizosphere of a temperate silvopastoral system[J].Biol Fertil Soils,2003,39:65-73.
[6]Juma N G,Tabatabai M A.Distribution of phosphomonoesterases in soils[J].Soil Sci,1988,126:101-108.
[7]LI Guanxi,WU Xiaoqin,YE Jianren.Biosafety and colonization of Burkholderia multivorans WS-FJ9 and its growth promoting effects on poplars[J].Appl Microbiol Biotechnol,2013,97:10489-10498.
[8]李冠喜,吴小芹,叶建仁.杨树根际土自毒物质的积累、毒害及生物修复[J].南京林业大学学报:自然科学版,2013,37(3):71-76.
[9]李冠喜,吴小芹,叶建仁.多噬伯克霍尔德氏菌WS-FJ9 对草甘膦降解特性的研究[J].生态学报,2013,33(21):6885-6894.
[10]侯亮.松树根际高效解磷细菌的筛选及其解磷特性的研究[D].南京:南京林业大学,2012.
[11]钟传青.解磷微生物溶解磷矿粉和土壤难溶磷的特性及其溶磷方式研究[D].南京:南京农业大学,2004.
[12]戴树桂,庄源益,陈勇生,等.两种假单胞菌中二氯酚降解酶及其定域研究[J].环境科学学报,1996,16(2):173-178.
[13]陈丹.杨树解有机磷细菌与菌根真菌互作效应研究[D].南京:南京林业大学,2011.

