烟草正反交组合F1 SRAP的比较分析
朱列书 詹莜国 郭东海 宋正雄 王祖富 尹佳
(1.湖南农业大学中国烟草中南农业试验站,湖南长沙 410128;2.昆明市烟草公司,云南昆明 650202)
烟草正反交组合F1 SRAP的比较分析
朱列书1詹莜国2郭东海1宋正雄1王祖富1尹佳1
(1.湖南农业大学中国烟草中南农业试验站,湖南长沙 410128;2.昆明市烟草公司,云南昆明 650202)
本文旨在利用SRAP 标记对4X4完成双列杂交烟草组合进行差异比较,从遗传层面鉴定正反交差异。100对SRAP引物组合中只有me3-em2、me4-em6、me6-em5、me10-em7引物组合能4 X 4个组合中扩增出差异条带,但是没能在正反交F1之间扩增出特异条带。表明SRAP标记在鉴别种内之间的差异时效率不高。
烤烟 SRAP分子标记 差异
0烟草(Nicotiana tabacum L.)为茄科烟属一年生或多年生作物,为典型的自交作物,是最早应用于分子生物学和基因工程研究的模式植物之一。但我国烟草种植品种单一化,严重阻碍了烟草产量和质量的进一步提高。究其原因除烟草育种目标固有复杂性与特殊性以外,主要是烟草育种还依赖于植株的表型选择及一些生理生化指标的测定,未曾从遗传的层面研究应用科学问题,使烟草育种的进展受到一定的限制。近年发展起来的分子标记技术克服了形态性状研究的不足,不受发育时期的影响,结果可靠,因此被广泛使用。而其它作物种,分子标记辅助育种选择体现了它的优势。
SRAP(Sequence-Related AmplifiedPolymorphism)标记是Li和Quiros[96,97]在芸苔属植物上开发出的新型分子标记技术,已在马铃薯、水稻、生菜、油菜、大蒜、[98-100]中成功扩增。其原理是利用特定引物对ORFs区域(Open Reading Frames)进行扩增。因不同个体、物种的内含子、启动子及间隔区长度不同而产生多态性。目前,该技术已被用于甜瓜、南瓜、野牛草、辣椒和棉花[101]等的遗传多样性研究,显示了良好的效果和适用性。
本文旨在利用SRAP标记对4X4完成双列杂交烟草组合进行差异比较,从遗传层面鉴定正反交差异。从分子水平了解烟草的遗传变异和亲缘关系,为合理选配亲本,挖掘利用现有种质资源提供理论指导;为加快我国烟草育种效率提供理论参考依据。
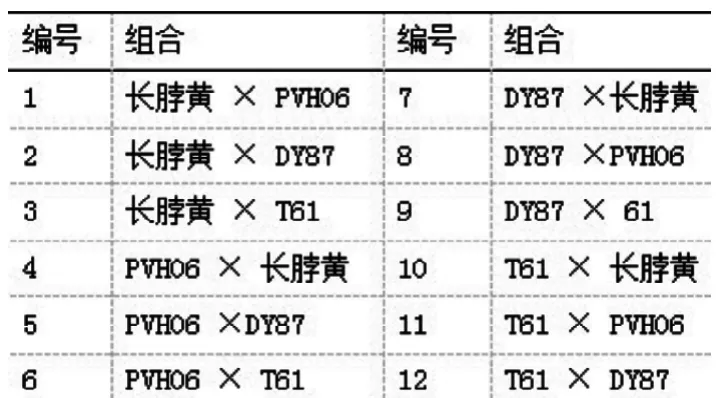
表1 4×3正反杂交组合

表2 亲本的主要特征特性
1 材料与方法
1.1 材料
选用材料以红花烟草(Nicotiana tabacum)中的DY87、长脖黄、T61、PVH06共4个烤烟品种为亲本,按Griffing方法I进行4×4完全双列杂交,配制正反、交组合12个,连同亲本共16个(见表1,表2)。
1.2 仪器与试剂
高速冷冻离心机(日本,Hitachi koki co,ltd),核酸蛋白检测仪(德国,Eppendorf,Biophometer)、紫外凝胶成像系统(GelDoc-1000)、HVE-50高压灭菌锅、电泳槽、移液枪(0.2-2μL、2-20μL、20-200μL、1mL)、超低温冰箱、低温冰箱、Biometra基因扩增仪、电磁炉

表3 正向引物碱基序列
用于SRAP-PCR反应的Taq酶、dNTP、10×PCR Buffer(Mg2+15mM)购自东盛生物公司,标准分子量(Marker)DL100购自GenScript。SRAP引物由上海生物工程公司合成。琼脂糖凝胶DNA回收试剂盒购自Tiangen公司。
1.3 基因组DNA的提取(CTAB法)与浓度测定
采集新鲜幼嫩的叶片约2g,放入研钵中,用液N2研磨成粉末,DNA的提取采用CTAB法,参考王关林、王宏建等[102]的方法并稍做改进,提取步骤为:
①在CTAB提取液中先加入200μL的β-巯基乙醇,水浴锅中预热到65℃;
②往装有粉碎样品的离心管中加入65℃预热的DNA的提取液[2%CTAB,100mmol Tris/HCl(pH8.0),1.4mol NaCl,20mmolEDTA(pH8.0),用前加40mmol/L β-巯基乙醇]4mL,轻轻摇晃均匀,在65℃水浴45min,每5min温和翻转一次;
③取出试管冷却至室温,加入等体积的氯仿/异戊醇(24:1),温和上下颠倒50次左右,至下层液相呈深绿色为止,于15℃,12000r/min离心10min;
④将上清液转移到另一离心管,重复以上操作再用氯仿/异戊醇(24:1) 抽提一次;
⑤取上清液于离心管中,加入等体积的-20℃的异戊醇,温和颠倒数次,-20℃冰箱中放置15min,于4℃,10000r/min 离心10min;
⑥倒掉液体后用75%的酒精清洗两次后,于超净工作台上晾干,将晾干的DNA溶于100μLTE溶液中。
得到的DNA提取液用Eppendorf公司生产的BioPhotometer核酸检测仪检测DNA溶液浓度与纯度,用0.8%的琼脂糖电泳检测DNA的完整性,最后将样品稀释成20ng/μL,保存于-20℃下备用。

表4 反向引物碱基序列
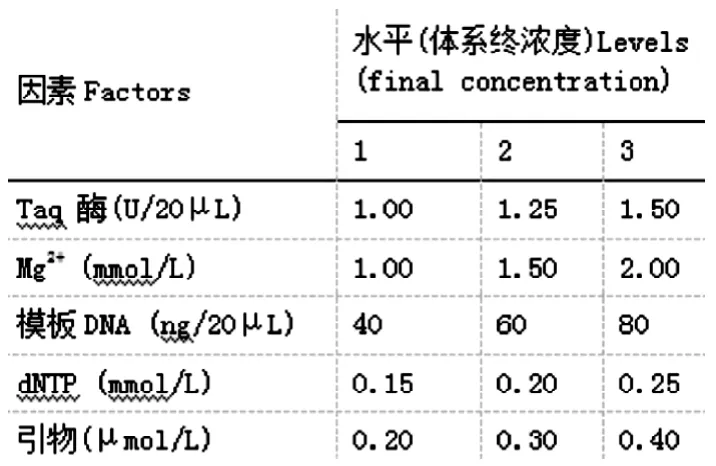
表5 SRAP-PCR反应各因素的水平
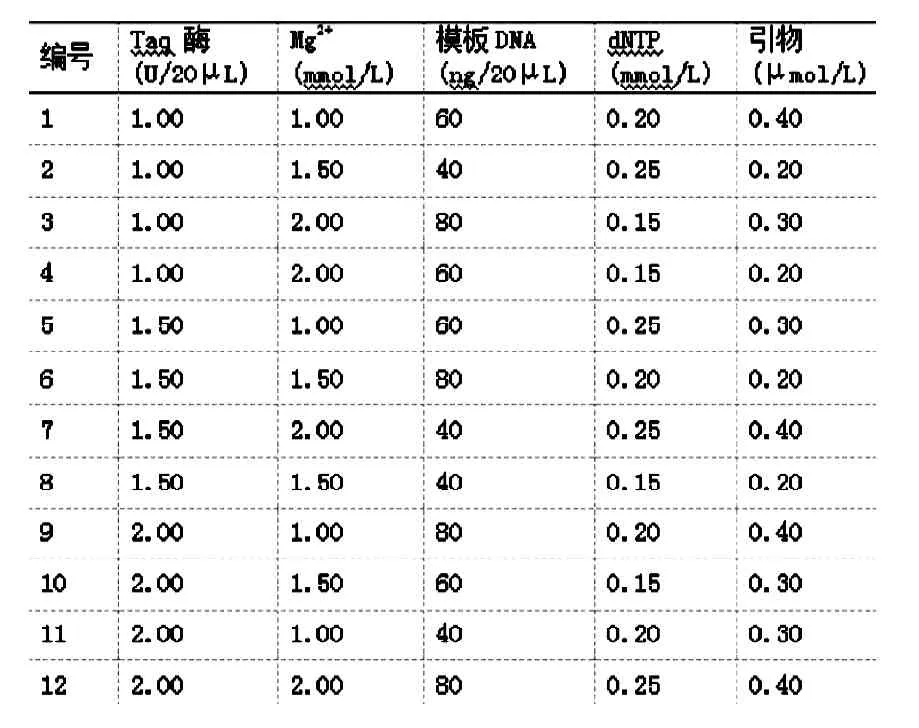
表6 PCR反应的因素水平试验设计
1.4 PCR引物
SRAP是建立在PCR基础上的一种新型分子标记,以PCR为基础的分子标记系统的引物的一般设计原则也适用于SRAP:不能产生二聚体、不能形成发夹结构、GC含量在40%—60%等。SRAP标记的引物分为正反两种,正向引物长为17bp,由14bp的核心序列和3'端的3个可选择性碱基组成,核心序列由5'端的10bp填充序列和紧接着的CCGG组成,3'端的3个碱基的变化能产生一系列的引物。反向引物长为17bp或18bp,组成与正向引物相同,核心序列长10bp或11bp,组成必须与正向引物不同,在核心序列与3'端可选择性碱基之间是AATT,具体序列如下(如表3,4):
1.5 PCR反应因素水平的确定与体系设计
PCR反应受多个因素影响,反应复杂,为了确定PCR反应中5个因素(Taq酶、Mg2+、模板DNA、dNTP、引物)的最佳水平,参考陈万胜[103]的正交设计,简化为三个水平进行试验,参加PCR反应的因素水平见表3-3,设计方案见表5。
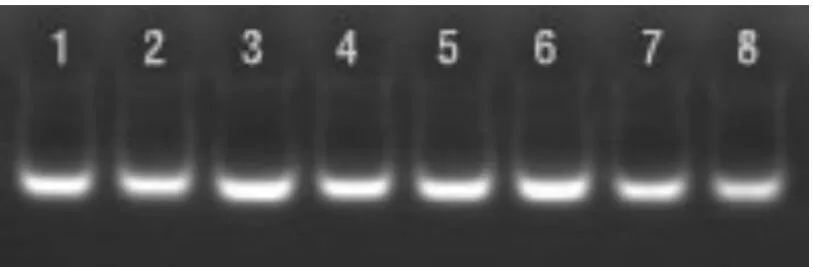
图1 提取的总DNA
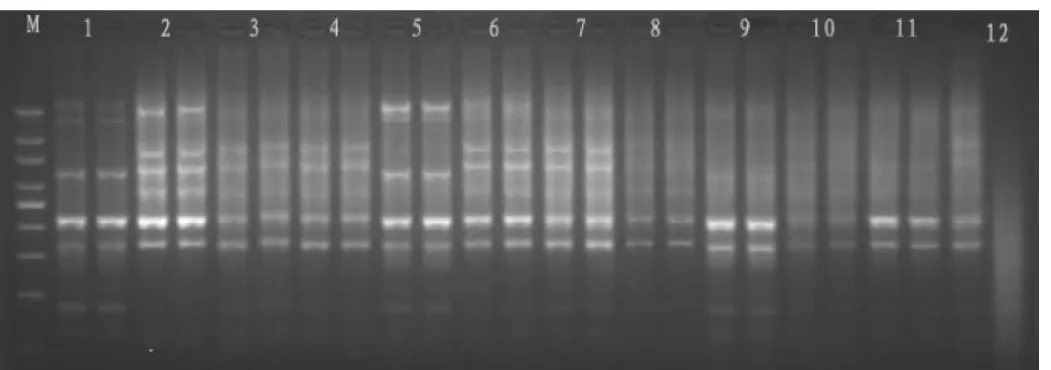
图2 试验设计SRAP-PCR产物电泳结果
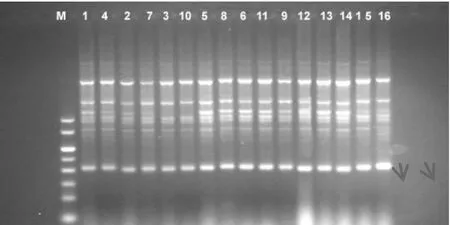
图3 品种试验结果(me3-em2)
1.6 PCR扩增与检测
将表6的12个处理重复两次,在Biometra基因扩增仪上进行扩增反应,反应程序首先是94℃预变性5min;前5个循环程序为:94℃,1min,35℃,1min,72℃,2min;随后的35个循环为:94℃,1min,53℃,1min,72℃,2min;最后72℃延伸5min,4℃保持。PCR扩增产物与6×点样缓冲液混合,用2%琼脂糖凝胶电泳检测,电泳缓冲液为1×TAE溶液,电压80V,电泳时间约45min,电泳结束后在GelDoc-1000紫外凝胶成像系统上采集图像。
2 结果与分析
2.1 DNA提取
DNA的提取质量是决定SRAP-PCR成功与否的关键。改良的CTAB法提取的DNA经核酸蛋白检测仪检测OD260/OD280为1.91±0.05,OD260/OD230为1.96±0.06,表明无多糖、蛋白质和酚类物质等杂质干扰;经0.8%琼脂糖凝胶电泳检测DNA主带明亮清晰(图1),点样孔没有杂质遗留,得到的样品纯度比较高。
2.2 SRAP反应体系的优化
按表6设计的12个处理进行PCR扩增反应后,所得到的产物用2%的琼脂糖凝胶进行检测(图2)。从图可以看出,体系8、10、11和12扩增的条带数很少且不清楚,说明Tap酶单位和引物浓度加大效果并不理想;1、3和4能扩增出一定数量的条带,但是都不是很清晰,可以看出Tap酶1.0U偏少,dNTP浓度0.15mmol/L偏小;2号体系能扩增出较多清晰的条带,5、6和7也能扩增出比较清晰的条带,由此可以看出Tap酶为1.5U、Mg2+1.5mmol/L、dNTP0.25mmol/L最好,引物浓度0.2μmol/L就可以了,DNA模板对结果影响并不很明显,40ng能够满足体系扩增要求。
2.3 应用SRAP反应体系扩增不同烤烟品种基因组
采用优化的SRAP反应体系扩增4×4完全双列杂交16个烤烟品种(系)基因组,共扩增了100对引物,每一对引物组合都能扩增出一定数量的清晰条带,但是其中有差异条带的只有4对,它们分别是me3-em2、me4-em6、me6-em5、me10-em7,图谱如下。在引物对me3-em2扩增下亲本T61与其他亲本相比在大约700bp处缺少一个条带;而组合“长脖黄×61”在1200bp处缺少条带,但正反交(3号10号)之间没有条带差异。14号亲本PVH06在引物对me4-em6的扩增下与其亲本相比较在250bp处缺少条带,由其组配的杂种没有相应的缺失条带;同时其它正反交F1也没有相应的缺失。引物对Me6-em5能在亲本T61中扩增出两个特异条带,分别在大约在1500bp、900bp处。其组配的杂种F1没有检测到相关相同条带,这可视为亲本T61的特异标记条带。DY87在引物对me10-em7的扩增下,在1500bp和1000bp两处缺少条带,正反交F1之间没有检测到条带差异。
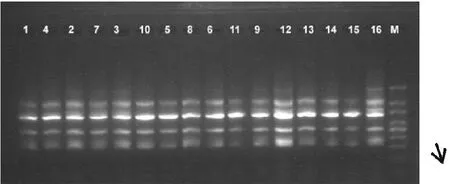
图4 品种试验结果(me6-em5)
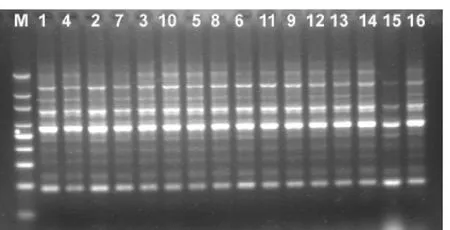
图5 品种试验结果(me10-em7)
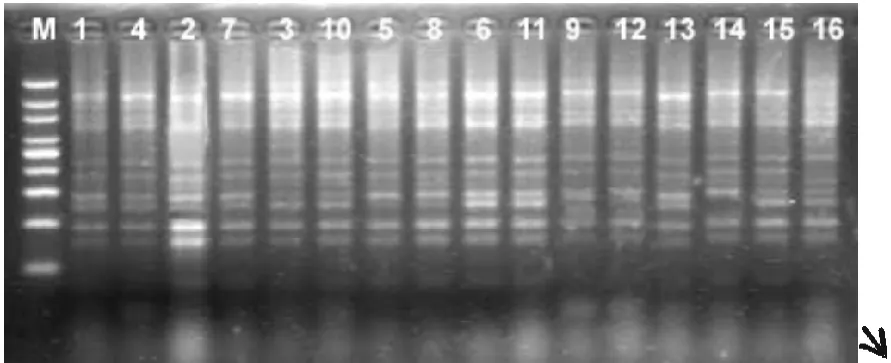
图6 品种试验结果(me4-em6)
3 小结与讨论
3.1 DNA提取与SRAP反应体系
改良的CTAB法提取DNA效果比较好,可以完成DNA提取,快速、简易、低成本,去除了蛋白质、糖、酚类等杂质,能够满足SRAP体系对模板的要求。
SRAP分子标记技术基于PCR反应,其扩增谱带虽较RAPD标记稳定,但同样受反应条件和扩增程序变化以及物种不同的影响,DNA模板质量,不同厂家生产的Tap酶,PCR反应的缓冲液以及各成分的浓度均能影响实验结果,采用不同的体系组合对烟草的SRAP-PCR扩增结果影响很大,因此,有必要根据具体情况优化反应体系。SRAP体系优化的方法有多种,一般均采用多次单因素设计的方法。本试验在简化正交设计的基础上,得出了烟草SRAP最佳反应体系(20uL):Mg2+1.5mmol/L、dNTP0.25mmol/L,引物0.2umol/L、Tap聚合酶1.5U、DNA模板40ng。
PCR扩增还跟退火温度密切相关,引物不同,其退火温度也不同[11,12]。温度高,扩增产物的特异性强,温度低,扩增产物的产量高。本研究的扩增程序为94℃预变性5min,前5个循环程序为:94℃,1min,35℃,1min,72℃,2min,随后的35个循环为:94℃,1min,53℃,1min,72℃,2min;最后72℃延伸5min,4℃保持。
3.2 SRAP正反交F1差异鉴定
SRAP作为一种新型的分子标记技术,具有简便、高共显性、重复性好、条带分离清晰等优点,广泛应用于物种内部系统树的构建、亲缘关系的确定等,显示了比较好的作用。本研究将SRAP应用于4×4完全双列杂交的基因组差异分析,SRAP扩增效果良好,产率中等,条带清晰,可以在烟草中产生多态,但是品种间的多态性条带很少,100对引物组合中只有me3-em2、me4-em6、me6-em5、me10-em7等4个引物组合能扩增出差异条带,但正反交F1之间没有扩增出特异条带。表明SRAP标记在鉴别种内之间的差异时效率不高。因为在农艺性状和生理指标中,亲本与正反交F1的方差分析表明存在极显著或者显著差异。
[1]朱列书,赵松义,戴林建.烟草生物技术研究及在育种上的应用[J].作物研究,2004.
[2]杨铁钊.烟草育种学[M].北京:中国农业出版社,2003.
[3]PRASANNA SIMHA RAO G S B1 烤烟的杂种优势及其配合力[J].国外烟草,1994.
[4]庄杰云,樊叶杨,吴建利等.杂交水稻中超显性效应的分析[J].遗传,2000.
[5]肖炳光,卢秀萍,王绍坤,等.烤烟品种RAPD分析与杂种优势预测[J].烟草科学研究, 200l增刊:16-20.
[6]赵卫国,苗雪霞,潘一乐,等.SSR和ISSR分子标记及其在桑树遗传育种研究中的应[J]. 江苏农业,2006.
[7]陈万胜,王元英,罗成刚等.利用正交设计优化烟草SRAP 反应体系[J].分子植物育种,2008.
SRAP was used to compare differences of 4x4 Flue-cured Tobacco combinations by diallel crosses excluding reciprocal and identify reciprocal differences of Heredity. Amplified bands were only detected by me3-em2 prime pair、me4-em6 primer pair、me6-em5 primer pair and me10-em7 primer pair in the 100 primer pairs of 4x4 Flue-cured Tobacco combinations but specific bands were not amplified between Reciprocal Crosses Hybrids F1.The results showed that the efficiency of identification intraspecific differences was not high by SRAP.
Flue-cured tobacco SRAP Difference
国家烟草专卖局烟草育种重大专项[中烟办〔2010〕221号]文合同编号:110201002007。

