化学计量之pH 计分析
刘永奎LIU Yong-kui;童诚TONG Cheng
(安庆市计量测试所,安庆 246001)
(Anqing Measurement and Test Institute,Anqing 246001,China)
1 化学计量
化学计量是指有关化学组成、化学变化中,量和能量的关系及其计算。其出发点是原子论、质能守恒定律及一些化学的基本定律。化学计量包括反应物和产物量的计算、化学平衡的计算、化学反应速率的计算、化学反应中能量的计算等。而pH 计作为化学仪器的最基础的设备,在化学计量方面具有典型的代表作用。
2 pH
什么是pH?pH 是拉丁文“Pondus hydrogenii”一词的缩写(Pondus=压强、压力,hydrogenium=氢),用来量度物质中氢离子的活性。这一活性直接关系到水溶液的酸性、中性和碱性。水在化学上是中性的,但不是没有离子,即使化学纯水也有微量被电离,形成水合氢离子和水合氢氧根离子:
H2O+H2O=H3O++OHˉ,由于水合氢离子(H3O+)的浓度是与氢离子(H+)浓度等同看待,上式可以简化成下述常用的形式:

利用质量守恒定律,对于纯水的电离可以找到一平衡常数加以表示:

由于水只有极少量被电离,因此水的浓度实际为一常数,并且有平衡常数K 可求出水的离子积KW。
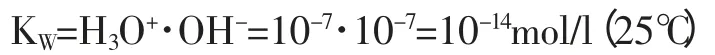
也就是说对于一升纯水在25℃时存在10-7摩尔H3O+离子和10-7摩尔OHˉ离子。
在中性溶液中,氢离子H+和氢氧根离子OHˉ的浓度都是10-7mol/l。如:
假如有过量的氢离子H+,则溶液呈酸性。酸是能使水溶液中的氢离子H+游离的物质。同样,如果使OHˉ离子游离,那么溶液就是碱性的。所以,给出H+值就足以表示溶液的特性,呈酸性还是碱性,为了免于用此分子浓度负幂指数进行运算,生物学家泽伦森(Soernsen)在1909年建议将此不便使用的数值用对数代替,并定义为“pH 值”。数学上定义pH 值为氢离子浓度的常用对数负值。即pH=-log[H+]。
因此,pH 值是离子浓度以10 为底的对数的负数。
3 pH 计
pH 计,又称作pH 酸度计或者酸度计,是利用化学上的原电池的原理工作的。是用来测定溶液pH 的一种仪器,利用溶液的电化学性质测量氢离子浓度,以确定溶液的pH 值。用酸度计进行电位测量是测量pH 最精密的方法。
pH 计由三个部件构成:
①一个参比电极;参比电极的基本功能是维持一个恒定的电位,作为测量各种偏离电位的对照。银-氧化银电极是目前pH 中最常用的参比电极。
②一个玻璃电极,其电位取决于周围溶液的pH;玻璃电极的功能是建立一个对所测量溶液的氢离子活度发生变化作出反应的电位差。
③一个电流计,该电流计能在电阻极大的电路中测量出微小的电位差。把对pH 敏感的玻璃电极和参比电极放在同一溶液中,就组成一个原电池,该电池的电位是玻璃电极和参比电极电位的代数和,E电池=E参比+E玻璃。如果温度恒定,这个电池的电位随待测溶液的pH 变化而变化,而测量酸度计中的电池产生的电位是困难的,因其电动势非常小,且电路的阻抗又非常大;因此,必须把信号放大,使其足以推动标准毫伏表或毫安表。电流计的功能就是将原电池的电位放大若干倍,放大了的信号通过电表显示出,电表指针偏转的程度表示其推动的信号的强度,为了使用上的需要,pH 电流表的表盘刻有相应的pH 数值;而数字式pH 计则直接以数字显出pH 值。
pH 计在使用前均需用标准缓冲液进行校准。一般实验室中采用一点校准和二点校准。
酸度计的一点校准:
对于测量精度在0.lpH 以下的样品,可以采用一点校准方法调整仪器,一般选用pH6.86 或pH7.00 标准缓冲液。具体操作步骤如下:
①配好标准缓冲溶液并测量标准缓冲液温度,查资料确定该温度下的pH 值,将温度补偿旋钮调节到该温度下。
②将电极用纯水冲洗干净,用滤纸将电极水珠擦去。
③将电极浸入缓冲溶液晃动后静止放置,待读数稳定后,调节定位旋钮使仪器显示值为查资料所得的pH 值。
④取出电极,用纯水冲洗干净。
酸度计的二点校准:
精密级的pH 计,除了设有“定位”和“温度补偿”调节外,还设有电极“斜率”调节,它就需要用二种标准缓冲液进行校准。一般先以pH=6.86 进行“定位”校准,然后根据测试溶液的酸碱情况,选用pH=4.00(酸性)或pH=9.18(碱性)缓冲溶液进行“斜率”校正。
具体操作步骤为:
①测量pH=6.86 标准溶液温度,将电极洗净并擦干,浸入到标准溶液中,仪器温度补偿旋钮置于溶液温度处。待示值稳定后,调节定位旋钮使仪器示值为6.86。
②取出电极用纯水洗净并擦干,浸入第二种标准溶液中。待示值稳定后,调节仪器斜率旋钮,使仪器示值为第二种标准溶液的pH 值。
③取出电极洗净并擦干,再浸入pH=6.86 缓冲溶液中。如果误差超过0.02pH,则重复第①、②步骤,直至在二种标准溶液中不需要调节旋钮都能显示正确pH 值。
4 pH 计的应用
近年来,化学计量得到了飞速发展,而pH 作为化学计量中一个重要的基础组成部分,在很多方面需要控制溶液的pH。pH 计被广泛应用于环保、污水处理、科研、制药、发酵、化工、养殖、自来水等领域。该仪器也是食品厂、饮用水厂办QS、HACCP 认证中的必备检验设备。
[1]林荣镜.pH 计的基本原理与特殊故障分析[J].计量技术,2001(12).
[2]张春霞,魏继日.pH 计的温度补偿[J].医疗卫生装备,2000(03).
[3]陆品桢.带自诊断功能的pH 计[J].仪器仪表与分析监测,1994(01).

