复方盐酸左氧氟沙星滴眼液的稳定性试验研究
刘世萍,柳玉杰,郭美华,白建海,张新建,王琪(.哈尔滨医科大学附属第一医院药学部,哈尔滨5000;.哈尔滨市食品药品监督管理局,哈尔滨 5008;.哈尔滨医科大学附属第一医院眼科,哈尔滨5000)
稳定性试验研究是评价药品质量的主要内容之一,在药品的研究、开发和注册管理中占有重要地位。通过稳定性试验,考察药物在不同环境条件(如温度、湿度、光线等)下药品特性随时间变化的规律,以认识和预测药品的稳定趋势,为药品生产、包装、贮存、运输条件、有效期的确定提供科学依据[1]。复方盐酸左氧氟沙星滴眼液系由盐酸左氧氟沙星、地塞米松磷酸钠、盐酸萘甲唑啉3种成分以适当比例组方,并辅以氯化钠及注射用水而制成的眼用制剂,可用于结膜炎、角膜炎、泪囊炎、白内障术后感染等外眼感染。笔者采用高效液相色谱(HPLC)法测定该制剂中的3种主药含量,并对其在强光照射及高温、加速等条件下的稳定性进行了研究,方法灵敏、准确、重复性好。
1 材料
1.1 仪器
Waters 600 HPLC系统,包括2996 PDA检测器、717自动进样器(美国Waters公司);SB3200型超声波仪(上海必能信超声有限公司);AE200型电子天平[梅特勒-托利多仪器(上海)限公司]。
1.2 药品与试剂
盐酸左氧氟沙星对照品(批号:130455-201005,纯度:100%)、盐酸萘甲唑啉对照品(批号:100111-201104,纯度:99.2%)、地塞米松磷酸钠对照品(批号:100016-201015,纯度:100%)均来自中国食品药品检定研究院;盐酸左氧氟沙星原料药(江西大地制药有限责任公司,批号:120716-2,纯度:97.8%);盐酸萘甲唑啉原料药(天津天成制药股份有限公司,批号:120308,纯度:99.7%);地塞米松磷酸钠原料药(扬州制药有限公司,批号:DL20120039,纯度:99.2%);复方盐酸左氧氟沙星滴眼液(哈尔滨医科大学附属第一医院自制,批号:20120529、20120530、20120531,规格:5 ml/瓶);甲醇、乙腈为色谱纯,其他试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 处方
盐酸左氧氟沙星原料药3 g,地塞米松磷酸钠原料药1 g,盐酸萘甲唑啉原料药0.25 g,氯化钠8.5 g,注射用水适量,制成1000 ml。
2.2 制备
称取处方量盐酸左氧氟沙星原料药,加适量注射用水使其溶解,然后分别取处方量地塞米松磷酸钠、盐酸萘甲唑啉原料药和氯化钠,加适量注射用水使其溶解后加入到上述溶液中,再加注射用水至全量,用G3过滤器过滤,无菌条件下灌封,即可。
2.3 性状
本品为淡黄色的澄明液体。
2.4 鉴别
在“2.6.1”项色谱条件下,供试品中3种主药的保留时间与对照品溶液中3种对照品主峰的保留时间分别一致。
2.5 检查
参照2010年版《中国药典》(二部)附录ⅠG眼用制剂[2]项下要求制订本品的检查项目,包括pH、渗透压摩尔浓度、可见异物及无菌等项,均按相关步骤及原则执行。
2.6 含量测定
2.6.1 色谱条件。色谱柱:Kromasil 100-5 C18(250 mm×4.6 mm,5 μm);流动相:三乙胺溶液(取三乙胺7.5 ml,加水稀释至14000 ml,用磷酸调节pH至3.5±0.05)-甲醇-乙腈(50∶45∶5,V/V/V),流速:1.0 ml/min;检测波长:222 nm;柱温:25 ℃;进样量:10 μl。
2.6.2 溶液的配制。对照品溶液:取盐酸左氧氟沙星、盐酸萘甲唑啉及地塞米松磷酸钠对照品适量,精密称定,加流动相制成0.1243、0.0113、0.0405 mg/ml的混合对照品溶液,即得。供试品溶液:精密量取本品1 ml,置于25 ml量瓶中,用流动相稀释至刻度,摇匀,即得。阴性供试品溶液:分别依次取处方量的除盐酸左氧氟沙星、盐酸萘甲唑啉、地塞米松磷酸钠外的其他成分,按照供试品溶液的制备方法分别制成阴性供试品溶液Ⅰ、Ⅱ、Ⅲ。
2.6.3 方法专属性。分别精密吸取对照品溶液、供试品溶液和阴性供试品溶液Ⅰ、Ⅱ、Ⅲ各10 μl,进样。结果基线平稳,3种主药及杂质峰之间分离度良好(分离度分别为4.0、7.2),各组分之间测定无干扰,柱效高(以盐酸左氧氟沙星计理论板数为2500),峰形理想。
2.6.4 线性关系考察。取对照品溶液适量,过滤后进样,分别以自动进样器依次进样1、2、4、8、16、20 µl,记录峰面积。以峰面积响应值(y)为纵坐标、对照品进样量(x,µg)为横坐标,绘制标准曲线,得回归方程:盐酸左氧氟沙星y=5.27×106x-2.66×105(r=0.99998),线性范围为0.1243~2.4860 μg;盐酸萘甲唑啉y=2.47×107x-3.37×104(r=0.99996),线性范围为0.0113~0.2260 μg;地塞米松磷酸钠y=2.18×106x-2.52×104(r=0.99995),线性范围为0.0113~0.2260 μg。
2.6.5 回收率试验。分别精密量取阴性供试品溶液Ⅰ、Ⅱ、Ⅲ适量,分成3组,每组3份,每份1 ml,置于25 ml量瓶中,分别精密加入高、中、低3个水平量的盐酸左氧氟沙星对照品(2.3908、2.9885、3.5862 mg)、盐酸萘甲唑啉对照品(0.2048、0.2560、0.3072 mg)及地塞米松磷酸钠对照品(0.8004、1.0005、1.2006 mg),按“2.6.2”项下方法制备供试品溶液,进样分析,计算回收率。结果3种主药平均回收率分别为99.22%(RSD=0.72%,n=9)、99.87%(RSD=0.86%,n=9)、100.02%(RSD=0.91%,n=9)。
2.6.6 精密度试验。取同一份对照品溶液和同一份供试品溶液适量,分别在“2.6.1”项色谱条件下连续进样6次,计算峰面积的RSD。结果3种主药RSD分别为0.14%和0.32%、0.21%和0.48%、0.45%和0.64%(n=6),说明精密度良好。
2.6.7 稳定性试验。取同一份供试品溶液适量,分别于0、1、2、4、6、8、10 h进样测定,测定峰面积。结果RSD 分别为0.41%、0.52%和0.85%(n=7),可见溶液10 h内稳定性良好。
2.6.8 重复性试验。取同一批样品,共6份,在“2.6.1”项色谱条件下测定供试品溶液和对照品溶液的峰面积,计算含量。结果3种主药的平均含量分别为:3.01 mg/ml(RSD=0.38%,n=6)、0.255 mg/ml(RSD=0.47%,n=6)和1.02 mg/ml(RSD=0.53%,n=6)。
2.7 稳定性试验研究
2.7.1 影响因素试验。(1)强光照射试验:取样品3批,置于密封洁净容器中,于(4500±500)lx的光照箱内考察10 d,分别于第5天及第10天取样,考察性状、3种主药含量等指标的变化,详见表1(表中,*:表示淡黄色的澄明液体,**:表示黄色的澄明液体,+:表示符合规定,以下表格同)。
由表1可知,在此条件下样品的性状发生了变化,颜色有所加深,3种主药的含量均呈下降趋势,但仍在合格范围内(应为标示量的90.0%~110.0%),有待进一步考察研究。同时提示,本品应选择深色包材,以求遮光。
(2)高温试验:取样品3批,置于密封洁净容器中,置于恒温培养箱中(40、60℃),考察10 d,分别于第5天及第10天取样,考察性状、3种主药含量等指标的变化,详见表2、表3。
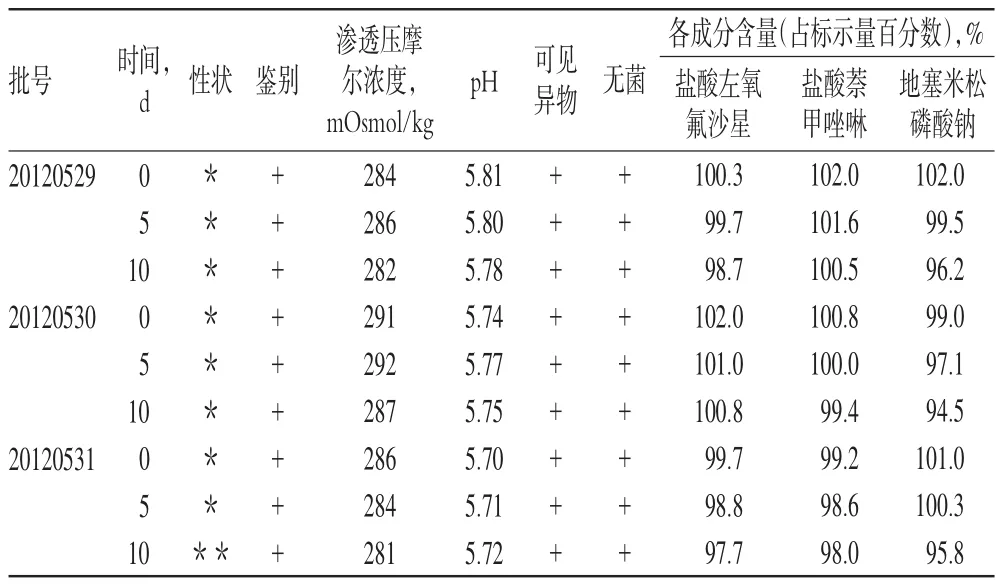
表1 强光照射试验结果(n=3)Tab 1Results of highlight exposure test(n=3)

表2 高温试验结果(40℃,n=3)Tab 2Results of high temperature test(40℃,n=3)

表3 高温试验结果(60℃,n=3)Tab 3Results of high temperature test(60℃,n=3)
由表2、表3可知,在40、60℃的条件下各项指标无明显变化。
2.7.2 加速试验。取样品3批,不除去外包装,保持内包装的完整性及密封性,于温度(40±2)℃、相对湿度(75±5)%的条件下分别放置1、2、3、6个月,按时取样,考察性状、3种主药含量等指标的变化。结果各项指标基本稳定,详见表4。
2.7.3 长期试验。取样品3批,不除去外包装,保持内包装的完整性及密封性,于温度(25±2)℃、相对湿度(60±10)%的条件下放置12个月。分别于放置0、3、6、9、12个月时,按时取样,考察性状、3种主药含量等指标的变化。结果各项指标未见明显改变,详见表5。
3 讨论
根据研究目的和条件的不同,稳定性试验研究内容可分为影响因素试验、加速试验和长期试验等。影响因素试验是在剧烈条件下探讨药物的稳定性、了解影响其稳定性的因素及所含成分的变化情况,其为制剂处方设计、工艺筛选、包装材料和容器的选择、贮存条件的确定、有关物质的控制提供依据[1],并为加速试验和长期试验应采用的温度和湿度等条件提供参考。其中,高湿度试验目的是考察供试品的吸湿潮解性能,以吸湿增重的百分比进行考察,因本品为液体制剂,所以未进行高湿度试验。在强光照射试验中,样品的性状发生了变化,颜色有所加深,3种主药的含量均呈下降趋势,但在合格范围内,有待进一步考察研究提示本品应选择深色包材,遮光保存。在高温试验中,40、60℃放置,本品各指标无明显变化,提示本品应在低于40℃温度下保存。
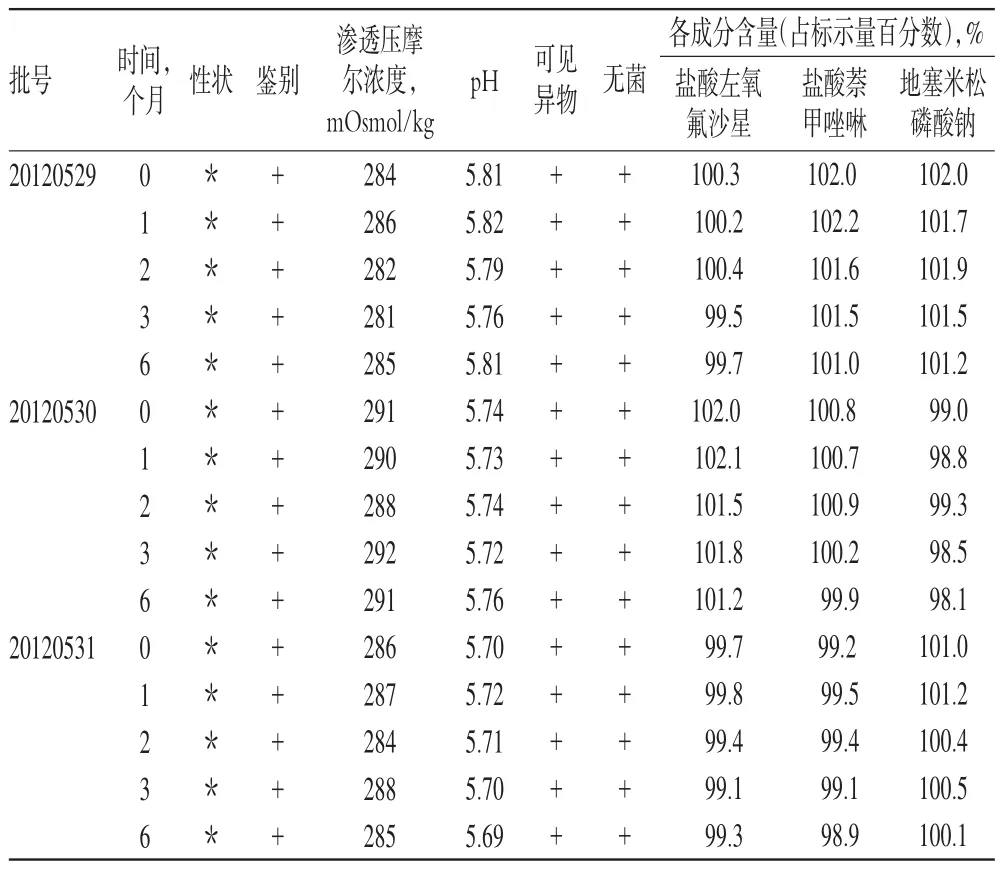
表4 加速试验结果(40℃,n=3)Tab 4Results of accelerated test(40℃,n=3)

表5 长期试验结果(n=3)Tab 5Results of long-term test(n=3)
加速试验目的是在较短的时间内,了解制剂的化学、物理和生物学方面的变化。本品的各项考察指标均无明显变化,说明本制剂的工艺及包装等设计合理,符合制剂稳定性的要求。
长期试验是在接近药品的实际贮存条件下进行的稳定性试验,为制订药物的有效期提供依据。在设计的包装条件下室温留样12个月,结果显示各项指标基本稳定,与加速试验结果一致。所以本包装能够保证本产品质量,结合考察结果,可将本品有效期暂定为1年。
本试验的标准曲线是用体积定量法(自动进样器)进行绘制的。与传统方法相比较,采用不同体积产生不同响应值的办法获得标准曲线,简化步骤,方便快捷;其所获得曲线的相关系数(r)更好,可达到0.9999以上,曲线标准差(s)更小,精密度更高,更准确。用新方法定量未知样品时,采用体积进样,可以根据需要灵活调整,不受限制。
综上,笔者参照文献[2-5]建立的主药含量测定方法,简便易行,方法灵敏、准确、重复性好。
[1]郭美华,张新建,马妍妍,等.安神益心液的稳定性考察[J].中国药师,2011,14(8):1149.
[2]国家药典委员会.中华人民共和国药典:二部[S].2010年版.北京:中国医药科技出版社,2010:附录9、10、44、75、76、103.
[3]闫瑾,刘美欣,张蕊,等.复方盐酸左氧氟沙星丁卡因滴眼液的制备及其质量控制[J].中国药房,2012,23(29):2729.
[4]胡正波,李航.HPLC法测定盐酸左氧氟沙星氯化钠注射液的含量[J].中国药师,2008,11(1):108.
[5]蔡佳玉,孙树茂,孟永春,等.HPLC测定微球中盐酸左氧氟沙星的含量[J].中国现代应用药学,2012,29(5):437.

