不同浓度臭氧对大鼠离体脑片氧糖剥夺及再灌注损伤模型的保护作用
师存伟,敬晓鹏,冶占福,宋涛
(1.青海大学附属医院疼痛科,西宁 810001;2.中国医科大学附属一院疼痛科,沈阳 110001)
脑梗死是临床常见的、严重危害人类健康的脑血管疾病,其发病率约占脑血管病的75%,病死率平均10%~15%,致残率高且易复发,复发后死亡率大幅度增加[1]。通常颅内动脉血管堵塞5~10 min就可以引起不可逆性神经细胞坏死,形成“核心区”,而其周边组织则处于缺血状态,存在不同程度的水肿,细胞尚未发生不可逆性坏死,CT检查表现为“半影区”,又称“半暗带”,这部分组织存在缺血—再灌注损伤的风险,是治疗的关键点,不恰当的治疗可能引发“迟发性神经元死亡”而影响患者的预后[2,3]。目前研究显示,脑缺血-再灌注损伤与自由基的生成、细胞内钙超载、兴奋性氨基酸毒性、白细胞高度聚集和高能磷酸化合物耗尽等机制相关[4,5]。急性脑梗死的传统治疗包括溶栓、脱水、抗凝、降压、营养神经及使用糖皮质激素等,这些方法从疗效和安全性方面考虑仍存在着不足。上世纪80年代欧洲首先将臭氧引入临床治疗,在中枢及外周缺血性血管疾病的治疗中取得了良好的效果[6],但是尚缺乏相关的基础研究。
脑片培养是近年发展起来的一种器官培养方法[7,8]。为了明确臭氧对急性缺血性神经组织损伤的作用,本研究拟采用大鼠离体大脑皮层脑片,建立氧糖剥夺(oxygen and glucose deprivation,OGD)及复氧的神经组织缺血⁃再灌注损伤模型,研究不同浓度臭氧对于大鼠离体神经组织缺血-再灌注损伤的作用。
1 材料与方法
1.1实验动物、试剂和器材
雄性SD大鼠(中国医科大学实验动物部),共25只。体质量250~300 g,于实验前3 d领入实验室适应环境,每12 h昼-夜交替光照,室温20℃。自由获取食物和水。实验试剂购自于Sigma⁃Aldrich公司(无锡),主要包括:三(羟甲基)氨基甲烷[Tris(hy⁃droxymethyl)aminomethane,Tris]、抗坏血酸、丙酮酸钠、β⁃烟酰胺腺嘌呤二核苷酸(NAD+)、还原型β⁃烟酰胺腺嘌呤二核苷酸(β⁃nicotinamide adenine dinu⁃cleotide reduced form,NADH)、谷氨酸(glutamate,Glu)、谷 氨 酸 脱 氢 酶(glutamate dehydrogenase,GDH)、牛血清白蛋白(bovine serum albumin,BSA)、硫巴比妥酸。人工脑脊液(artifi cial cerebrospinal fluid,ACSF)成分:120 mmol/L NaCl,2.5 mmol/L KCl,1.3 mmol/L MgCl2,1.0 mmol/L NaH2PO4,1.5 mmol/L CaCl2,26 mmol/L NaHCO3,11 mmol/L葡萄糖,pH值7.4,渗透压285~290 mOsmol。4%人血清白蛋白(human serum albumin,HSA,美国 Equitech⁃Bio公司);谷氨酸检测试剂盒(BioVision,美国),器材主要包括:活组织切片机(英国Gomshall公司)、无菌插入式培养皿—Millicell⁃CM insert(上海Millipore)、MEM培养基(美国Gibco公司)、臭氧发生器(德国Hu⁃mares)、分光光度计(北京普析通用公司)。
1.2 制备脑片并建立模型
参照文献[8,9]制备脑片并建立模型。大鼠在吸入安氟醚麻醉下迅速断头取脑,置入4℃ACSF保存,弃去小脑和脑干、分离双侧皮层,使用活组织切片机,沿冠状面将皮层切开,制成350 μm厚度的切片。将制备好的脑片放入无菌插入式培养皿中,每孔内预先加入2 mL ACSF液并放入2片脑片,将培养皿并放入37℃恒温培养箱,持续吹入95%O2+5%CO2的混合气体60 min,该过程是为了修复切片所造成的损伤(恢复期);在37℃继续孵育30 min,使脑片与外部环境充分达到平衡(平衡期);将培养液迅速更换成由混合氮气(95%N2+5%CO2)预饱和的无葡萄糖ACSF孵育液(葡萄糖以等摩尔量的蔗糖代替),并持续吹入95%N2+5%CO230 min,使脑片处于缺糖缺氧状态(OGD期);OGD过程结束后,用新鲜的氧气预饱和的含葡萄糖ACSF替代缺氧的溶液,继续孵育90 min(再灌注期)。臭氧干预组是在再灌注过程中,分别向含和不含HAS(150 μg/mL)的ACSF液中持续加入不同浓度的臭氧和氧气混合气。整个实验过程是序贯完成的(图1)。
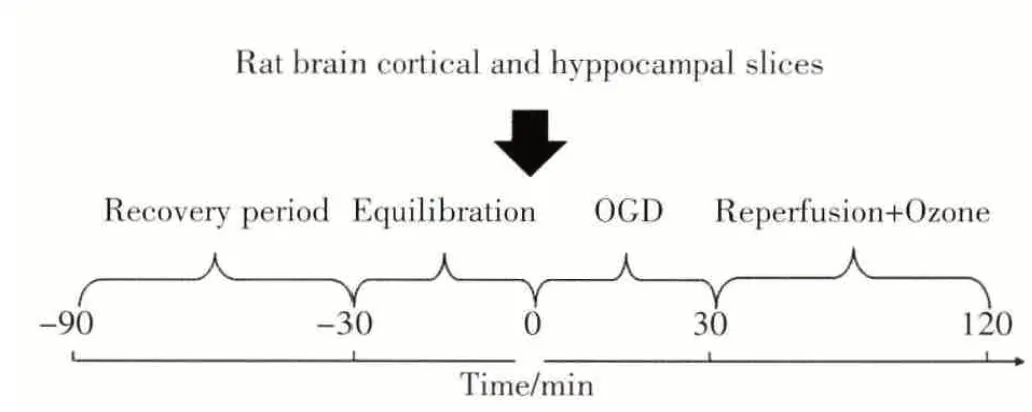
图1 实验程序Fig.1 Scheme of the study
1.3 实验分组
将制备好的脑片随机挑选分组,每组12片,共分为12组,对照组(CTRL)、模型组(OGD/R)及臭氧组,臭氧组依据干预条件不同分为10个亚组,具体包括:首先根据在再灌注期是否向ACSF中加入HSA,分成含HSA(TH)和不含HSA的组(T),再根据各自接受的不同浓度臭氧干预分为,10μg/mL组(TH1;T1)、20 μg/mL 组(TH2;T2)、30 μg/mL 组(TH3;T3)、40 μg/mL 组(TH4;T4)和 50 μg/mL 组(TH5;T5)。对照组全程处于恢复期状态;模型组经历30 min OGD和90 min再灌注。
1.4 臭氧制备
利用高精度的医用臭氧仪(德国HUMAZON公司)获取臭氧,其浓度范围为1~56 μg/mL,气流量0~1 300 mL/min,最小可调节浓度为1 μg/mL。臭氧仪需要定期接受“碘量法”浓度校正检测,以确保生成臭氧浓度的精确性。臭氧仪需要使用医用氧气而不是过滤空气制备臭氧,因为在过滤空气中存在78%的氮气,并且能自动生成一氧化氮而干扰实验。全程使用一次性的硅处理聚丙烯注射器(抗臭氧)和聚乙烯管路以确保臭氧含量和浓度的稳定[10]。
1.5 神经损伤的评估
参照文献[11],测量再灌注期内ACSF中Glu和乳酸脱氢酶(lactate dehydrogenase,LDH)的含量来评估神经损伤的程度。利用试剂盒检测谷氨酸浓度,试剂盒内提供的谷氨酸混合酶试剂能够特异性识别Glu为底物,成比例催化产生相应颜色变化,因此Glu的含量可以用比色度法来测定,用组织湿重(nmol/mg)表示。
LDH作为细胞内标志酶,是糖的无氧酵解和糖异生的重要酶系之一。当神经元受损、膜通透性改变时,LDH漏出量明显增加,是反映神经细胞损伤的可靠生化指标,其含量可以利用紫外分光光度法测定样本(脑片)在340 nm时吸收率下降的程度进行计算(U/mg组织湿重),在本研究中将该值与对照组进行比较,并以百分率表示。
1.6 统计学处理
2 结果
2.1 臭氧对大鼠脑片OGD和再灌注所致的LDH、Glu释放的影响
结果表明,对照组大鼠脑皮质LDH释放量为(2.24±0.22)U/mg,谷氨酸释放量为(0.18±0.02)nmol/mg。经历30 min OGD和90 min再灌注后OGD/R组LDH和Glu释放量明显增加,分别为(8.31±0.21)U/mg和(0.66±0.04)nmol/mg,与对照组比较具有统计学差异(P<0.01)。臭氧20,30,40 μg/mL拮抗OGD后再灌注引起的LDH和Glu释放,40 μg/mL臭氧有明显的效应,LDH和Glu释放与OGD/R组比较差异具有统计学意义(P<0.01)。而低浓度(10,20,30 μg/mL)或高浓度(50 μg/mL)臭氧引起的LDH和Glu释放与OGD/R组比较差异没有统计学意义(P>0.05),见表1。
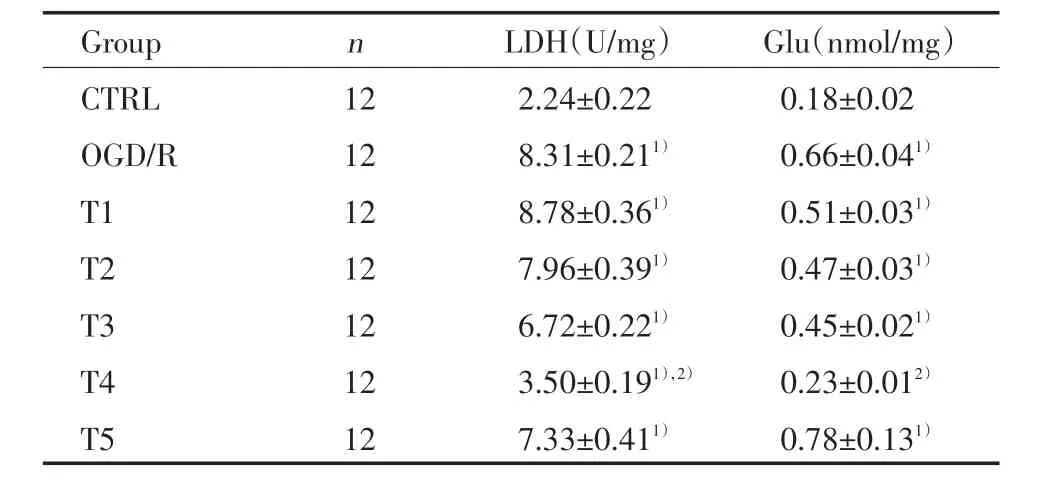
表1 臭氧对大鼠脑片OGD和再灌注所致的LDH、Glu释放的影响Tab.1 Effects of ozone on oxygen⁃glucose deprivation and reoxygenation⁃induced release of glutamate and LDH
2.2 HSA 在臭氧(30,40 μg/mL)作用下对大鼠脑片OGD和再灌注所致的LDH、Glu释放的影响
结果表明,30,40 μg/mL的臭氧能够明显减少LDH和Glu释放,其数值与对照组相当。LDH释放量在含有HSA组(30,40 μg/mL臭氧)与不含HSA组比较差异具有统计学意义(P<0.05)。而Glu释放量在含有HSA组(30 μg/mL臭氧)处理后下降,与不含HSA组比较差异具有统计学意义(P<0.05)。见表2。
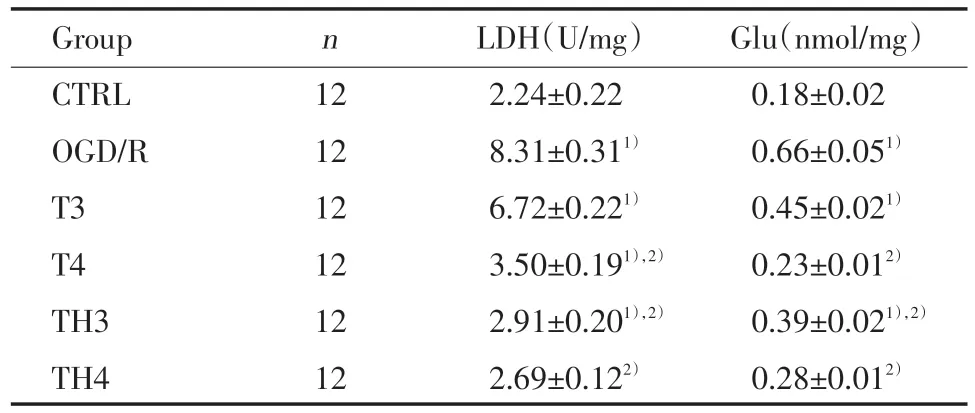
表2 臭氧和HSA对大鼠脑片OGD和再灌注所致的LDH、Glu释放的影响Tab.2 Effects of ozone and HSA on oxygen⁃glucose deprivation and reoxygenation⁃induced release of glutamate and LDH
3 讨论
臭氧治疗缺血性疾病(下肢动脉硬化闭塞症、视网膜中央动脉栓塞、急性脑梗死等)具有良好的疗效[12,13]。
本研究结果表明大鼠脑片在经历OGD及再灌注损伤后,LDH与Glu的释放明显增加,给予不同浓度臭氧干预后表现出不同的效应,其中40 μg/mL臭氧具有最明显的抑制效应,而低浓度(10~30 μg/mL)或高浓度(50 μg/mL)臭氧都没有引起明显的效应。臭氧的拮抗作用表现出倒置的“U型”浓度-效应曲线规律,这与以往的研究一致[14]。
本研究结果还表明,在ACSF中加入HSA能明显提高臭氧的拮抗效应,这提示臭氧的作用不仅仅是简单的物理溶解效应,而是与周围介质发生化学反应的结果。相关研究显示[13]用95%氧气与5%臭氧混合气处理人血液,氧气仅仅使血浆含氧量增加以及血红蛋白发生充分氧合,而臭氧的作用类似于前体药物,在血浆的液体环境中臭氧的溶解速度和扩散程度比氧气高,并且能与溶质快速发生反应,特别是与水溶性抗氧化剂(尿酸、维生素C、还原型谷胱甘肽等),这些物质在ACSF中不存在,因此本研究可能只观察到了臭氧的一部分作用,这是该离体实验存在的不足之处,尚需要结合相关的在体研究完善对臭氧作用的认识。
另外,目前所使用的大鼠离体脑片OGD及再灌注损伤模型,理论上仅有切片表面或内部表浅组织的表层才能正常利用ACSF,而深层组织似乎无法与外界环境充分沟通,但在实验中我们却观察到该离体神经组织对外界不同浓度的臭氧有很好的反应性,这提示我们臭氧的作用可能不仅局限在表面接触。通常,在含水环境里,臭氧能快速发生反应生成H2O2和烯醛。临床研究[13]显示,使用40~50 μg/mL臭氧气体可以在全血中获得最佳的臭氧治疗浓度,即在1 mL全血(大约600 μL血浆)中溶解的有效臭氧剂量为20~40 μg。因此可以推测离体的脑组织至少在一定程度上接触20~40 μmol H2O2和亚微摩尔的烯醛。两者能够在脑组织中扩散并逆转在“缺血”或OGD 30 min阶段时所造成的损伤。在接受臭氧自体血治疗的志愿患者中,合理的H2O2和烯醛浓度能激发许多有用的生化反应,从而发挥治疗作用[16]。
根据“U型”曲线效应,臭氧对神经的保护作用与浓度相关,具有典型的“毒物兴奋效应”特点[15],即类似于“预处理反应”,通过少量有害刺激,激发体内潜在的防御和修复能力。许多药物的浓度/效应关系都表现为这种特异的内在趋势特点[14]。
综上所述,在离体脑缺血模型中臭氧具有神经保护作用,且与浓度密切相关,表现为倒置的“U型”浓度-效应曲线。该研究结论为臭氧的临床应用提供了一定的理论基础,但是,在臭氧具体作用机制方面尚需要进行更加深入、细致的研究。
[1]Chen J,Venkat P,Zacharek A.Neurorestorative therapy for stroke[J].Front Hum Neurosci,2014,27(8):382-390.
[2]贾革,陈秋惠,张海娜,等.进展性卒中相关危险因素分析[J].中国老年学杂志,2014,14:4110-4113.
[3]Wasser G.Ischemic stroke penumbra and extracorporeal ozone treat⁃ment[J].Neuroradiol,2013,26(3):243-251.
[4]Weinberger JM.Evolving therapeutic approaches to treating acute ischemic stroke[J].J Neurol Sci,2006(2):101-109.
[5]Gertz K,Priller J,Kronenberg G,et al.Physical activity improves long⁃term stroke outcome via endothelial nitric oxide synthase⁃de⁃pendent augmentation of neovascularization and cerebral blood flow[J].Circ Res,2006(99):1132-1140.
[6]Bocci V,Borrelli E,Travagli V,et al.The ozone paradox:ozone is a strong oxidant as well as a medical drug[J].Med Res Rev,2009,29(4):646-682.
[7]Adamchik Y,Frantseva MV,Weisspaph M,et al.Methods to in⁃duce primal T and secondary traumatic damage in organotypic hip⁃pocampal slice cultures[J].Brain Res Brain Res Protoc,2000,5(2):153-158.
[8]杨丽君,崔红,杨爱君,等.大鼠全脑脑片培养及缺氧缺糖模型的建立[J].实验动物与比较医学,2009,29(5):283-285.
[9]Ricci L,Valoti M,Sgaragli G,et al.Protection by taurine of rat brain cortical slices against oxygen glucose deprivation and reoxygenation⁃induced damage[J].Eur J Pharmacol,2009,621(1⁃3):26-32.
[10]Travagli V,Zanardi I,Bocci V,et al.Effects of ozone blood treat⁃ment on the metabolite profile of human blood[J].Int J Toxicol,2010(29):165-174.
[11]Ricci L,Valoti M,Sgaragli G,et al.Neuroprotection afforded by di⁃azepam against oxygen/glucose deprivation⁃induced injury in ratcortical brain slices[J].Eur J Pharmacol,2007,561(1⁃3):80-84.
[12]张兰.臭氧自体血回输治疗超急性脑梗塞的临床及影像学观察[J].中国社区医师(医学专业),2011,13(292):198-199.
[13]Bocci VA,Zanardi I,Travagli V.Ozone acting on human blood yields a hormetic dose⁃response relationship[J].J Trans Med,2011,9:66.
[14]Martínez⁃Sánchez G1,Pérez⁃Davison G,Re L,et al.Ozone as u⁃shaped dose responses molecules(hormetins)[J].Dose Response,2010,9(1):32-49.
[15]Calabrese EJ.U⁃shaped does response in behavioral pharmacology:historical foundations[J].Crit Rev Toxicol,2008,38(7):591-598.

