L1CAM在胃癌组织中的表达及其与患者临床病理特征的关系
董建华,王学松,韩文学,陈晓红,王钧芹,李 利,王元宇
(1莒县人民医院,山东 莒县 276500;2浙江省人民医院)
L1细胞黏附分子(L1CAM)是免疫球蛋白超家族中的Ⅰ型跨膜糖蛋白。L1CAM在多种肿瘤组织中表达,在肿瘤浸润的边缘和转移灶中高表达,其在肿瘤组织中的表达能促进肿瘤细胞的侵袭和迁移[1,2]。但目前关于L1CAM在胃癌方面的研究很少,仅有Kodera等[3]应用免疫组织化学检测胃癌组织中L1CAM的表达情况。为此,我们回顾了436例胃癌患者资料,并分析L1CAM与患者临床病理特征的关系。
1 资料与方法
1.1 临床资料 选择1998年1月~2004年12月莒县人民医院手术切除的胃癌组织436份,均经术后病理证实,且患者术前未行放化疗。其中患者男311例、女125例,年龄17~91岁、中位年龄60岁;按WHO 2002年胃癌分类标准分为乳头状腺癌16例、管状腺癌326例、黏液腺癌29例、印戒细胞癌65例;高分化腺癌13例、中分化腺癌128例,低分化腺癌293例、未分化癌2例;TNM分期:Ⅰ期90例、Ⅱ期104例、Ⅲ期173例、Ⅳ期69例;胃癌淋巴分期:PN0期166例、PN1期136例、PN2期99例、PN3期35例;有远处转移61例,无远处转移375例。另取癌旁正常胃黏膜组织92份作为对照。随访起止时间为1998年1月~2008年12月,并随访5年以上。
1.2 方法
1.2.1 L1CAM组织芯片制备和免疫组织化学染色参照文献[4,5]制备 L1CAM 组织芯片及免疫组织化学染色。鼠抗人L1CAM抗体购于Abcam公司,广谱二抗试剂盒及DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。
1.2.2 结果判定 以细胞质和细胞核出现棕黄色颗粒为L1CAM阳性。根据染色程度和染色细胞百分率进行评定和分析[6,7]:基本不着色者为0分,着色淡者为1分,着色适中者为2分,着色深者为3分;着色细胞占计数细胞的百分率≤5%记0分,6%~25%记1分,26% ~50%记2分;≥51%记3分。将每张切片的染色程度与染色细胞百分率得分相乘为最后得分。0~1分为阴性(-),2~3分为弱阳性(+),4~6分为中等阳性(++),>6分为强阳性(+++)。在统计分析中,将表达(-、+)划为低表达组,(++、+++)划为高表达组。
1.2.3 统计学方法 采用SPSS13.0统计软件,计量资料以±s表示,比较采用配对t检验;计数资料比较采用χ2或Fisher精确概率检验。生存数据采用Kaplan-Meier分析,并绘制生存曲线,应用Logrank检验差异性,用Cox风险模型进行独立预后因素分析。P≤0.05为差异有统计学意义。
2 结果
2.1 L1CAM在正常胃黏膜和胃癌组织中的表达在92份正常胃黏膜中,L1CAM蛋白阴性表达70份(76.1%),弱阳性表达 22 份(23.9%)。在 436 份胃癌组织中,L1CAM蛋白高表达118份(27.1%),低表达318份(72.9%),主要在细胞质中表达。
2.2 L1CAM蛋白表达与胃癌临床病理特征的关系L1CAM 低表达组年龄(58.13 ±12.03)岁,明显低于高表达组[(61.15 ±12.0)岁;t=-2.632,P=0.009]。其余见表1。
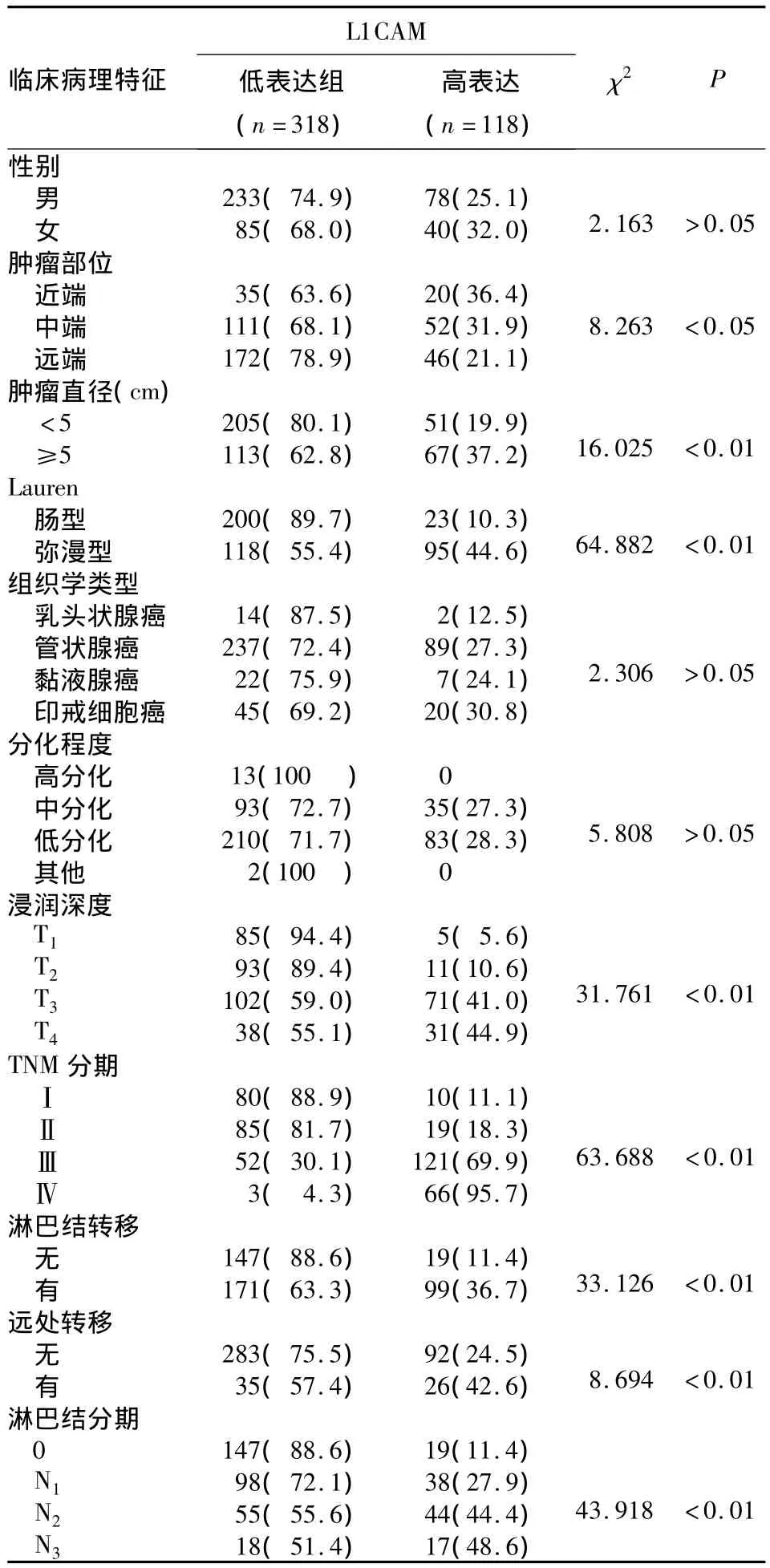
表1 L1CAM在胃癌组织中的表达与患者临床病理特征的关系[例(%)]
2.3 L1CAM蛋白表达与患者预后的关系 见图1。Kaplan-Meier分析显示,L1CAM低表达患者的5年生存率(50.0%)明显高于L1CAM高表达患者(16.1%,P<0.05)。在 TNMⅠ期中,L1CAM 高表达患者的5年生存率(60.0%)明显低于L1CAM低表达患者(87.1%,P<0.05);在Ⅱ期中,L1CAM 高表达患者的5年生存率(36.4%)明显低于L1CAM低表达患者(65.6%,P<0.05);在Ⅲ期中,L1CAM高表达患者的 5年生存率(16.9%)明显低于L1CAM低表达患者(30.4%,P<0.05);在Ⅳ期中,L1CAM高表达患者的5年生存率(0)与L1CAM低表达患者无显著差异(5.3%,P>0.05)。用Cox风险模型进行独立预后因素分析,结果发现L1CAM表达、浸润深度、淋巴结转移、远处转移和TNM分期是胃癌的独立预后因素(P均<0.05)。
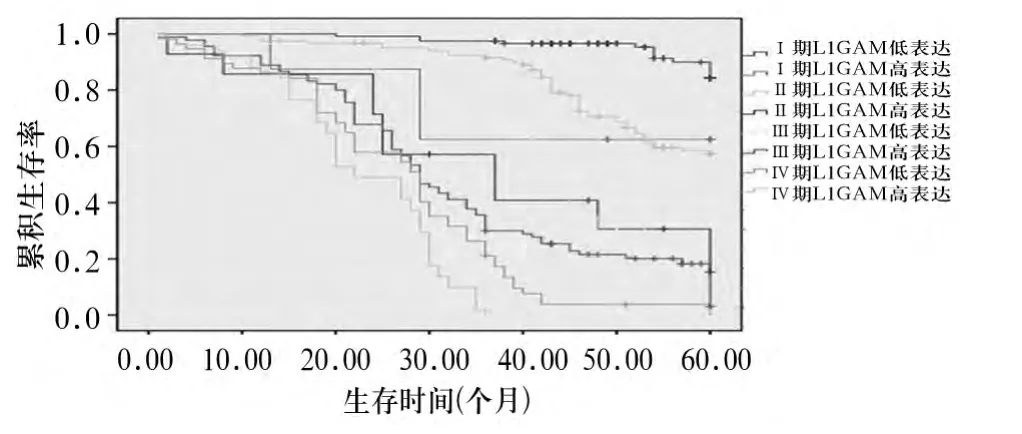
图1 不同TNM分期L1CAM高表达和低表达患者的生存曲线
3 讨论
L1CAM属免疫球蛋白超家族中的Ⅰ型跨膜糖蛋白,分子量为200~220 kD,首先在神经系统中被发现,之后发现在结直肠癌、胰腺癌、食管癌、肝内胆管癌、胃肠道间质瘤和胃癌组织均有表达,在肿瘤组织浸润的边缘表达显著增强[8~12]。Kodera 等[3]应用免疫组织化学检测了L1CAM在72份pT3期胃癌组织中的表达情况,结果发现L1CAM在15份胃癌组织中表达,以肠型胃癌为主。本研究中,76.1%的非肿瘤胃黏膜组织中L1CAM蛋白为阴性表达,23.9%呈弱阳性表达。在27.1%的胃癌组织中L1CAM蛋白高表达,且主要在细胞质中表达。与Kodera等[3]研究一致。
L1CAM在结直肠癌、胰腺癌、食管癌和胆管癌等组织中表达,且其在肿瘤组织的表达与临床病理特征和预后相关。L1CAM的表达与结直肠癌的分期、远处转移和复发相关[13]。L1CAM在胰腺癌组织高表达,其表达与淋巴结转移、血管侵犯、周围神经浸润和疼痛程度有关[14]。L1CAM在胆囊癌组织的表达与胆囊癌组织学分级、浸润深度、临床分期、血管和淋巴侵犯相关[15]。本研究发现,L1CAM蛋白的表达强度与肿瘤部位、肿瘤大小、Lauren分型、浸润深度、TNM分期、淋巴结转移、远处转移、淋巴结分期有关,提示L1CAM可能参与胃癌的发生、发展。
临床研究发现,L1CAM在结直肠癌、胰腺癌、胆囊癌和肝外胆管细胞癌中高表达,并与患者的预后密切相关[13~16]。本研究发现,L1CAM 蛋白的表达强度与预后有关。为排除肿瘤分期对预后的影响,我们对不同 TNM分期患者进一步分析发现,在TNMⅠ、Ⅱ、Ⅲ期中,L1CAM高表达患者的5年生存率均低于 L1CAM低表达患者;在 TNMⅣ期中,L1CAM高表达患者的5年生存率与L1CAM低表达患者无统计学差异。表明L1CAM在胃癌组织的表达与患者预后有关,并且是独立预后因素之一。
综上所述,L1CAM在胃癌组织中高表达,其表达与淋巴结转移、远处转移、TNM分期和预后显著相关。
[1] Raveh S,Gavert N,Ben-Ze'ev A.L1 cell adhesion molecule(L1CAM)in invasive tumors[J].Cancer Lett,2009,282(2):137-145.
[2]Gavert N,Ben-Shmuel A,Raveh S,et al.L1-CAM in cancerous tissues[J].Expert Opin Biol Ther,2008,8(11):1749-1757.
[3]Kodera Y,Nakanishi H,Ito S,et al.Expression of L1 cell adhesion molecule is a significant prognostic factor in pT3-stage gastric cancer[J].Anticancer Res,2009,29(10):4033-4039.
[4]Zhao ZS,Wang YY,Chu YQ,et al.SPARC is associated with gastric cancer progression and poor survival of patients[J].Clin Cancer Res,2010,16(1):260-268.
[5]Lee HS,Lee HK,Kim HS,et al.Tumour suppressor gene expression correlates with gastric cancer prognosis[J].J Pathol,2003,200(1):39-46.
[6]Geisler SA,Olshan AF,Weissler MC,et al.p16 and p53 protein expression as prognostic indicators of survival and disease recurrence from head and neck cancer[J].Clin Cancer Res,2002,8(11):3445-3353.
[7]Fukuoka J,Fujii T,Shih JH,et al.Chromatin remodeling factors and BRM/BRG1 expression as prognostic indicators in non-small cell lung cancer[J].Clin Cancer Res,2004,10(13):4314-4324.
[8]Kato K,Maesawa C,Itabashi T,et al.DNA hypomethylation at the CpG island is involved in aberrant expression of the L1 cell adhesion molecule gene in colorectal cancer[J].Int J Oncol,2009,35(3):467-476.
[9]Tsutsumi S,Morohashi S,Kudo Y,et al.L1 Cell adhesion molecule(L1CAM)expression at the cancer invasive front is a novel prognostic marker of pancreatic ductal adenocarcinoma[J].J Surg Oncol,2011,103(7):669-673.
[10]Rawnaq T,Kleinhans H,Uto M,et al.Subset of esophageal adenocarcinoma expresses adhesion molecule l1 in contrast to squamous cell carcinoma[J].Anticancer Res,2009,29(4):1195-1199.
[11]Min JK,Kim JM,Li S,et al.L1 cell adhesion molecule is a novel therapeutic target in intrahepatic cholangiocarcinoma[J].Clin Cancer Res,2010,16(14):3571-3580.
[12]Zander H,Rawnaq T,von Wedemeyer M,et al.Circulating levels of cell adhesion molecule L1 as a prognostic marker in gastrointestinal stromal tumor patients[J].BMC Cancer,2011,11:189-196.
[13]Boo YJ,Park JM,Kim J,et al.L1 expression as a marker for poor prognosis,tumor progression,and short survival in patients with colorectal cancer[J].Ann Surg Oncol,2007,14(5):1703-1711.
[14]Ben QW,Wang JC,Liu J,et al.Positive expression of L1-CAM is associated with perineural invasion and poor outcome in pancreatic ductal adenocarcinoma[J].Ann Surg Oncol,2010,17(8):2213-2221.
[15]Choi SY,Jo YS,Huang SM,et al.L1 cell adhesion molecule as a novel independent poor prognostic factor in gallbladder carcinoma[J].Hum Pathol,2011,42(10):1476-1483.
[16]Li S,Jo YS,Lee JH,et al.L1 cell adhesion molecule is a novel independent poor prognostic factor of extrahepatic cholangiocarcinoma[J].Clin Cancer Res,2009,15(23):7345-7351.

