VEGF-C mRNA在前列腺癌表达及临床病理意义的初步研究
张秀梅,顾金松,刘 曙,石 明,苏建军
0 引 言
前列腺癌(prostate cancer,PCa)是老年男性最常见的恶性肿瘤,位列男性常见肿瘤的第2位[1]。近年来,由于人口老龄化及生活习惯的改变,PCa的发病率呈逐年增高的趋势,PCa病死率居高不下的主要原因在于术后易复发及向周围组织浸润转移。血管内皮生长因子-C(vascular endothelial growth factor-C,VEGF-C)又称淋巴管生长因子,是调节淋巴管生成作用的细胞因子,在低氧诱导下对新生血管的形成发挥正向调节作用,同时可以通过激活VEGF受体调节肿瘤组织的新生淋巴管形成并侵袭淋巴系统,这都可能与PCa的生长转移相关。本研究采用TaqMan探针法RT-PCR技术检测VEGF-C mRNA在前列腺癌细胞系、前列腺癌组织及前列腺增生组织中的表达,探讨其临床病理意义及与预后的关系。
1 资料与方法
1.1 细胞株与组织样本 PCa细胞株DU145、PC-3、LNCap购自上海细胞库,前两者均为雄激素非依赖性、LNCap为雄激素依赖性。所有组织标本均取自我院2007年8月至2012年5月根治性前列腺切除术、经尿道前列腺电切术的患者,包括PCa患者32例,年龄54~78岁,平均年龄(67.2 ±5.3)岁,其中 Gleason评分2~6分7例,7~10分25例;良性前列腺增生(benign prostatic hyperplasia,BPH)患者15例,年龄53~73岁,平均年龄(63.5±4.8)岁。32份 PCa标本和15份BPH标本离体后尽快切取组织块,装入EP管并立即放入液氮中保存,然后转入-80℃冰箱内保存。所有病例术前均未行放、化疗或抗雄激素治疗,所取样本新鲜组织均获得患者知情同意,并获得医院伦理委员会批准,所有病理诊断均由2位病理医师双盲复核证实。
1.2 方法
1.2.1 细胞培养 在含10%胎牛血清的RPM1640细胞培养基中加青霉素100 U/mL及链霉素100 U/mL,将 DU145、PC3、LNCap细胞接种于配好的培养基中,在37℃、5%CO2及95%饱和湿度条件下培养,用0.25%的胰蛋白酶消化,以离心半径8 cm、1000 r/min离心5 min获取细胞沉淀。
1.2.2 引物的设计与合成 根据 GenBank人类VEGF-C和GAPDH基因mRNA序列(登录号:NM_005429和NM_005631),设计引物序列如下:VEGF-C上游引物 5'AAGATcCGCAGACGTGTAAATGTT3',下游引物5'CGGCTTGTCACATGCAAGT3';片段长度121 bp。以3-磷酸甘油醛脱氢酶(glyceraldehydes-3-phosphate dehydrogenase,GAPDH)作为内参基因,其上游引物5'CATGGGTGTGAACCATGAGAAGTA3',下游引物5'GACTGTGGTCATGAGTCCTTCC3';片段长度138 bp,探针FAM(荧光基团)5'CATGCCATCACTGCCACCCAGAAG3'TAMRA(淬灭荧光基团)。所有引物均委托Invitrogen(上海)贸易有限公司合成。
1.2.3 RNA提取 取PCa细胞沉淀和新鲜组织分别加入液氮预冷的匀浆仪进行匀浆30 s,再加入含有预冷1 mL Trizol提取液的15 mL离心管中,摇匀静置10 min;加0.2 mL酚氯仿混匀、离心、取上清,异丙醇沉淀,75%冷乙醇洗涤。
1.2.4 逆转录反应及荧光定量PCR 预变性,65℃5 min,逆转录42℃ 10min,95℃ 45s,-20℃保存备用。PCR反应条件为:95℃预变性5 min,95℃变性5s,58℃退火45s,72℃延伸45s,共计40 个循环,所有反应重复3次。
1.3 数据处理 实验数据应用2-ΔΔCt进行处理,根据实时荧光定量PCR中Ct值和样本起始拷贝数的对应关系,各样本目的基因VEGF-C的Ct值减去内参基因GAPDH的Ct值得到该样本的ΔCt值,计算各样本的2-ΔCt值,以2-ΔΔCt值代表 VEGF-C mRNA表达的相对量。
1.4 统计学分析 采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差(±s)表示,两组均数间的比较采用两独立样本t检验,VEGF-C mRNA的表达与临床病理参数之间的多组均数的比较在满足方差齐性时应用单因素方差分析,方差不齐时应用非参数检验Mann-Whitney U检验,组间的生存情况应用Log-Rank检验,Kaplan-Meier法绘制生存曲线,以P≤0.05为有统计学意义。
2 结 果
2.1 VEGF-C mRNA在 PCa细胞系中的表达VEGF-C mRNA在PC-3细胞系和在DU145细胞呈高表达,相对表达量分别为 153.31 ±26.24、194.62 ±41.36,在 LNCap细胞中呈低表达,相对表达量为1.00 ±0.00。
2.2 VEGF-C mRNA在PCa组织中的表达 32份PCa组织中VEGF-C mRNA的表达量(13.67±1.95)较15 份 BPH 组织(11.89 ±1.63)明显升高,差异有统计学意义(P=0.004)。见表1。
2.3 PCa组织中VEGF-C mRNA的表达与临床病理参数的比较 VEGF-C mRNA的高表达与高Gleason评分及淋巴结转移相关。其中Gleason评分>7分组中较Gleason评分≤7分组明显升高,差异有统计学意义(P=0.004),伴有淋巴结转移组较无淋巴结转移者的表达显著增高,差异有统计学意义(P=0.015)。VEGF-C mRNA的相对表达量与年龄及PSA值无相关性(P=0.138;P=0.083)。见表1。
表1 前列腺癌组织中VEGF-C mRNA的表达与临床病理参数的相关性(±s)Table 1 Relationship between VEGF-C mRNA expression in PCa and clinicopathological parameters(±s)
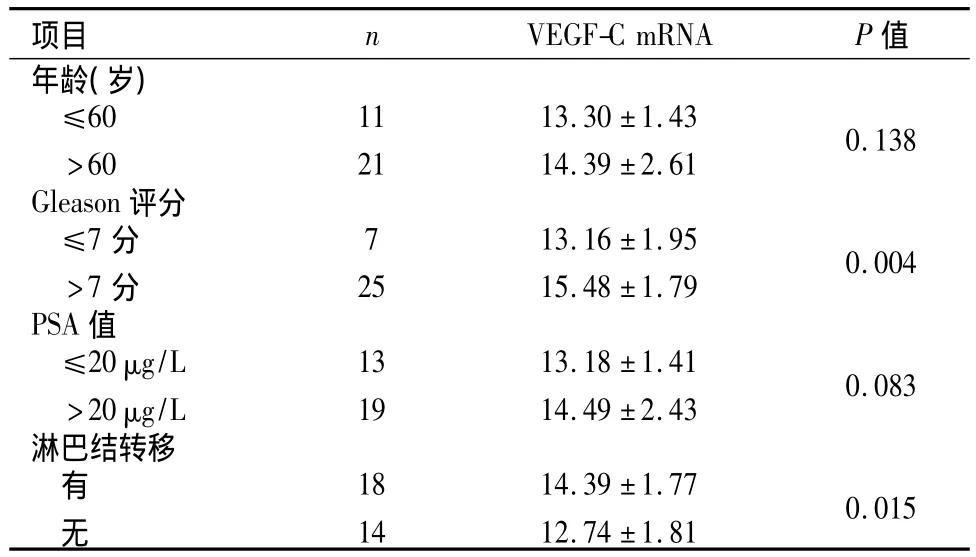
表1 前列腺癌组织中VEGF-C mRNA的表达与临床病理参数的相关性(±s)Table 1 Relationship between VEGF-C mRNA expression in PCa and clinicopathological parameters(±s)
项目 n VEGF-C mRNA P值年龄(岁)≤60>60 11 21 13.30 ±1.43 14.39 ±2.61 0.138 Gleason评分≤7分>7分7 25 13.16 ±1.95 15.48 ±1.79 0.004 PSA值≤20 μg/L>20 μg/L 13 19 13.18 ±1.41 14.49 ±2.43 0.083淋巴结转移有无18 14 14.39 ±1.77 12.74 ±1.810.015
2.4 VEGF-C mRNA的表达与PCa患者预后的关系本组32例PCa患者中,获得随访21例,随访时间为4~41个月,进行单因素的预后分析,将本组病例分为VEGF-C mRNA高表达者(2-ΔΔCt>2)16例和低表达者(2-ΔΔCt≤2)5 例,3 年累积生存率分别为 12.5% 和40.0%,差异有统计学意义(P=0.033),见图1。
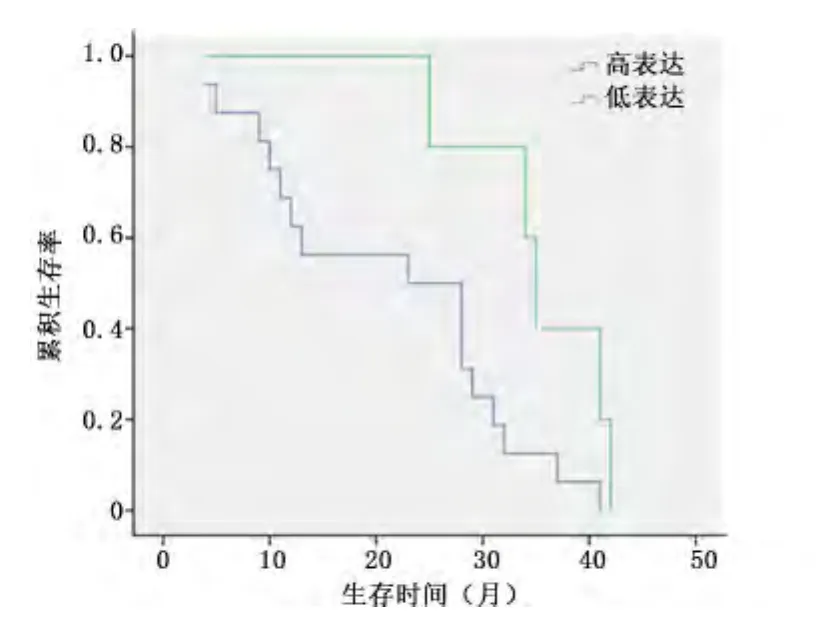
图1 VEGF-C mRNA不同表达者与患者生存时间比较Figure 1 Relation between VEGF-C mRNA expression and the survival time of patients with PCa
3 讨 论
PCa是男性最常见的恶性肿瘤之一,寻找早期发现前列腺癌的肿瘤标记物成为降低死亡率的关键[2]。
VEGF是目前研究证实调节肿瘤血管生成最主要的一组因子[3]。人类VEGF-C基因定位于染色体4q34,是促进淋巴管新生的关键因子,可通过结合并激活淋巴内皮细胞表面的受体VEGFR-3,促进淋巴内皮细胞的增殖、存活与迁移,调节肿瘤血管新生和淋巴管生成,促进肿瘤细胞进入淋巴管,通过淋巴系统向全身转移和扩散[4-5]。
成人的VEGF-C作为特异性淋巴管内皮细胞的生长因子,在淋巴结、胎盘、卵巢、心脏、小肠及骨骼肌中都有弱表达[6]。研究证实,VEGF-C在非小细胞肺癌、甲状腺癌、食管癌、大肠癌、胃癌、黑色素瘤及乳腺癌中表达均明显增高,且与肿瘤的病理分级和预后相关[7]。Furudoi等[8]对 152 例进展期结直肠癌研究表明,VEGF-C蛋白与淋巴管和脉管侵犯、Dukes分期、肝转移、浸润深度、分化程度和微血管密度相关,是影响5年生存率的独立预后因素。Feng等[9]利用siRNA沉默VEGF-C基因的方法抑制VEGF-C的表达,发现非小细胞肺癌的生长、侵袭、转移受到明显抑制。
在本研究中,我们发现VEGF-C mRNA在PC-3和DU145细胞中的表达量较LNCap细胞中显著增高。LNcap细胞系代表着早期非转移、雄激素依赖的PCa的显著特征,其本身具有成瘤性差、转移力相对较低的特点,而PC3和DU145细胞系内具有较强的迁移、侵袭能力和体内成瘤能力,这提示在转录水平上,VEGF-C在促进PCa细胞系转移侵袭方面起一定的作用。在PCa组织标本中,VEGF-C mRNA的高表达更易出现在高Gleason评分及有淋巴转移的患者,与淋巴结转移相关可能是由于肿瘤的基质细胞分泌VEGF-C,进而通过诱导淋巴管新生并分泌淋巴相关趋化因子等促进淋巴管的转移,Tsurusakl等[10]应用原位杂交方法研究VEGF-C在PCa组织中的表达,结果显示PCa中VEGF-C的表达和淋巴结转移相关,所有淋巴结转移病例均呈VEGF-C阳性表达,而且非淋巴结转移组中只有约40%的标本呈阳性表达,与我们的研究结果一致。Gleason评分及淋巴结转移被认为是评价PCa预后及进展最重要的指标之一[11],因此推测VEGF-C有可能成为评估PCa的生物学行为和判断预后的有效参考指标。我们尚未观察到VEGF-C与患者血清PSA水平存在明显相关,这可能与不同患者血清PSA变异度较大有关。Shimizu等[12]用VEGF-C单克隆抗体来抑制VEGF-C的表达,结果发现VEGF-C表达高的肿瘤组织内和肿瘤周边新生淋巴管明显减少,抑制了肿瘤组织向淋巴系统转移。这种抗淋巴管形成的靶向治疗为肿瘤的治疗提供了崭新的思路。
总之,本研究应用RT-PCR发现了VEGF-C mRNA在PC3和DU145细胞系高表达,在PCa中高表达与淋巴结转移、高Gleason评分均呈正相关,且高表达患者预后更差,提示VEGF-C有可能成为判断PCa侵袭、转移和预后的新标志及基因治疗的新靶点。
[1] 王永川,魏丽娟,刘俊田,等.发达与发展中国家癌症发病率与死亡率的比较与分析[J].中国肿瘤临床,2012(10):679-682.
[2] 韩苏军,张思维,陈万青,等.中国前列腺癌发病现状和流行趋势分析[J].临床肿瘤学杂志,2013,18(4):330-334.
[3] 韩曼丽,章金春.雷公藤多苷对胶原诱导性关节炎大鼠组织中血管内皮生长因子及血管内皮生长因子受体2mRNA表达水平的影响[J].医学研究生学报,2013,26(5):478-480.
[4] 吴雪芹,岑 洪,谭晓虹,等.VEGF-C基因沉默对裸鼠移植乳腺癌淋巴管和血管生成影响的观察[J].中华肿瘤防治杂志,2013,20(8):583-587.
[5] 王允芬,姚艳雯,刘红兵,等.伊曲康唑对Lewis肺癌荷瘤裸鼠恶性胸腔积液生成的抑制作用[J].医学研究生学报,2014,27(1):19-22.
[6] Lynch TJ,Bell DW,Sordella R,et al.Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib[J].N Engl J Med,2004,350(21):2129-2139.
[7] 唐月汀,焦晓阳.血管内皮生长因子C在恶性肿瘤转移中的作用与临床研究[J].汕头大学医学院学报,2012(3):176-178.
[8] Furudoi A,Tanaka S,Haruma K,et al.Clinical significance of vascular endothelial growth factor C expression and angiogenesis at the deepest invasive site of advanced colorectal carcinoma[J].Oncology,2002,62(2):157-166.
[9] Feng Y,Hu J,Ma J,et al.RNAi-mediated silencing of VEGFC inhibits non-small cell lung cancer progression by simultaneously down-regulating the CXCR4,CCR7,VEGFR-2 and VEGFR-3-dependent axes-induced ERK,p38 and AKT signalling pathways[J].Eur J Cancer,2011,47(15):2353-2363.
[10] Tsurusaki T,Kanda S,Sakai H,et al.Vascular endothelial growth factor-C expression in human prostatic carcinoma and its relationship to lymph node metastasis[J].Br J Cancer,1999,80(1-2):309-313.
[11] 程 亮,饶 秋,黄文斌.前列腺癌的病理分期进展[J].中华病理学杂志,2013,42(5):351-354.
[12] Shimizu K,Kubo H,Yamaguchi K,et al.Suppression of VEGFR-3 signaling inhibits lymph node metastasis in gastric cancer[J].Cancer Sci,2004,95(4):328-333.

