人乳头状瘤病毒感染与宫颈病变的相关性分析*
卢春冬,徐 燕,任玉香,李玉艳,胡华,唐 帅,包碧惠
(1.重庆市第三军医大学西南医院妇产科,重庆400038;2.成都军区总医院妇产科,成都610083)
高危型人乳头状瘤病毒(human papillomavirus,HPV)感染是宫颈上皮内瘤样病变(cervical intraepithelial neoplasia,CIN)和宫颈癌(cervical carcinoma,CC)最重要的风险因素,目前HPV检测是临床筛查和防治宫颈癌的重要标志物[1]。本文分析宫颈癌、宫颈上皮内瘤样病变患者中HPV感染发生情况以及与细胞学的关系,探讨HPV与宫颈渐进性病变的相关性。
1 研究对象与方法
1.1 研究对象
选择2010年9月~2013年8月于第三军医大学西南医院妇科门诊就诊的慢性宫颈炎、疑似宫颈癌以及宫颈光滑但细胞学异常或持续HPV感染患者,排除孕期、近期宫颈手术及放化疗、免疫治疗史,知情同意后行宫颈活检共11 013例,病检提示CIN及CC的患者共2 481例,年龄16~81岁,平均41.39 ±10.11 岁。
1.2 宫颈细胞学和HPV检测
所有拟行宫颈癌筛查的患者均非月经期、3天内无阴道用药,一次性采样刷插入子宫颈管内顺时针旋转3~5圈,将附有宫颈和宫颈管内脱落细胞及分泌物的颈管刷置入保存液中,及时行HPV及液基细胞学检测(TCT)。宫颈TCT由专业的细胞学医师阅片报告,采用2001年修订的TBS(the bethesda reporting system 2001)诊断标准[2],结果分:正常鳞状上皮、挖空细胞、不明意义的非典型鳞状上皮细胞(ASCUS)、低度鳞状上皮细胞内病变(LSIL)以及高度鳞状上皮细胞内病变(HSIL)。HPV由临床检验科利用“凯普医用核酸分子快速杂交仪”检测平台判断21种基因亚型中某亚型(单型感染)、两型或两型以上(多型感染)的HPV阳性,包括5种低危型(HPV6、11、42、43、44)、2 种中危型(53、CP8304)和14 种高危型(HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68)。
1.3 宫颈组织学诊断
阴道镜下宫颈多点活检、刮取宫颈管粘膜行组织学检查,或宫颈锥切、环切(Leep刀)组织送病检。组织学诊断标准参照妇产科诊断病理学[3]:(1)慢性宫颈炎;(2)宫颈鳞状上皮增生伴空泡变性;(3)CINⅠ级:宫颈上皮内轻度非典型增生;(4)CINⅡ级:中度非典型增生;CINⅠ-Ⅱ级:2个以上象限呈CINI,局部病灶可达CINⅡ级;(5)CINⅢ级:宫颈上皮内重度非典型增生;CINⅡ-Ⅲ:CINⅡ级累及2个以上象限,个别地方达到CINⅢ;(6)宫颈癌分型、分级。
1.4 统计学处理
以百分率作HPV感染的评价指标,多型HPV感染分别计数。正常鳞状上皮、炎性细胞、挖空细胞统计为TCT阴性,CINⅠ-Ⅱ级最终统计为CINⅡ,CINⅡ-Ⅲ级最终统计为 CINⅢ级[4],采用 Pearson's卡方统计量进行统计分析。
2 结果
2.1 CIN、CC 中 HPV 感染情况
CIN和CC患者共2 481例,CINI 751例,CINⅠ-Ⅱ 42例,CINⅡ 624例,CINⅡ-Ⅲ 114例,CINⅢ283例,CC 667例,HPV 阳性率85.0%(2 106例),多型HPV感染占25.2%(530例),甚至同一患者可同时见 HPV16、33、44、51、53、58 等六种亚型阳性。感染频率以 HPV16最高(56.1%),其次HPV52(17.2%)、 HPV58(15.7%)、 HPV33(10.5%)、HPV18(7.2%)、HPV31(5.3%)等几种高危型感染,而低危型 HPV11(2.4%)、HPV 6(1.9%)、HPV42单独或混合其它亚型感染则少见。
667例CC患者中,HPV16(431例)、HPV18(60例)感染最多见,其次见HPV58(43例)、HPV33(29例)、HPV52(14 例)、HPV31(12 例)、HPV45(9例)、HPV59(9例)、HPV68(8例)等亚型;CINⅢ、CINⅡ患者所见HPV感染亚型近似CC患者,而CINⅠ中并见 HPV阴性和 HPV52、HPV16、HPV58、HPV33、HPV31、HPV18、HPV68 等亚型感染。各级别的宫颈病变中HPV感染情况见表1,HPV阴性及所感染的HPV亚型在CC、CINⅢ、CINⅡ和CINⅠ患者中所占百分比的分布见图1。
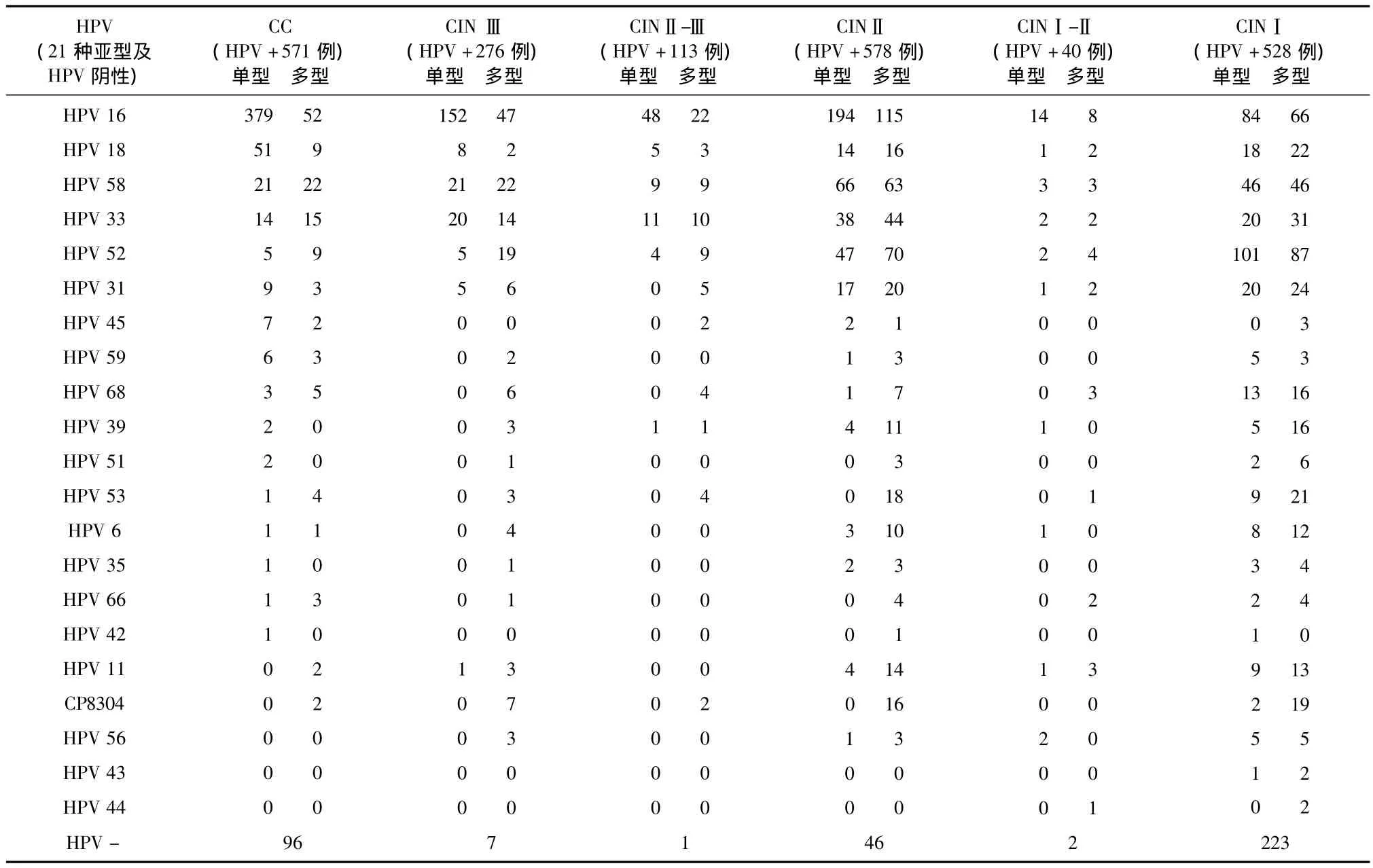
表1 2 481例CC和CINⅢ~Ⅰ中HPV感染情况调查表
分析HPV感染与宫颈病检报告的关系(χ2=221.189,P <0.001),可以认为 HPV 感染与宫颈组织学结果相关(Pearson列联系数=0.648),表明有较强的联系。统计表1中的病例,因HPV45感染以下CC 例数较少,仅进行 HPV16、HPV18、HPV58、HPV33、HPV31、HPV52单型感染的卡方检验,数据线性相关的 χ2=108.23,P < 0.001,提示 HPV16、HPV18、HPV58、HPV33、HPV31、HPV52 各亚型的单型感染在CC中有减少趋势。
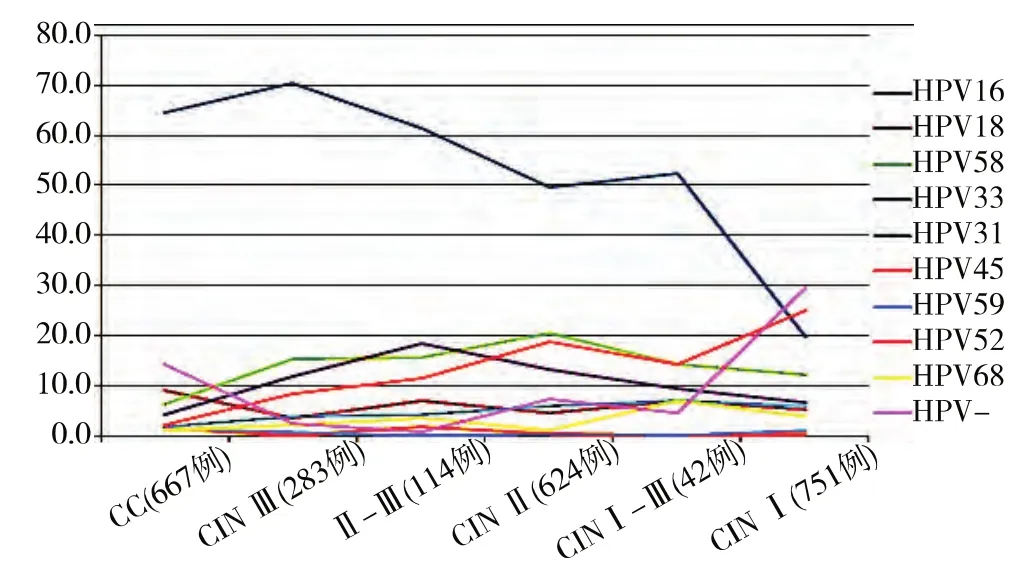
图1 21种HPV亚型及HPV阴性在各级宫颈病变中所占百分率的曲线图
由图1中的感染百分率曲线可知,CC、CINⅢ/CINⅡ-Ⅲ及CINⅡ/CINⅠ-Ⅱ患者中,HPV16感染率(CC 中占64.6%,CINⅢ中占70.3%,CINⅡ-Ⅲ中占62.3%,CINⅡ中占 49.5%,CINⅠ-Ⅱ中占 52.4%)明显高于其它HPV亚型,而其它几种高危型HPV在 CC、CINⅢ/CINⅡ-Ⅲ、CINⅡ/CINⅠ-Ⅱ中的感染频率相对较平稳(≤20%)。但在CINⅠ中,HPV16感染率20.0%,HPV52感染率25.0%,HPV58感染率12.3%,HPV33、HPV31、HPV18 等亚型感染率渐低,而HPV阴性的 CINⅠ占29.7%,说明CINⅠ的发生更多地并存了其他致病因素。
2.2 宫颈组织学异常所对应的HPV、细胞学诊断
2 481例宫颈病变中,仅304例鉴于各种原因而首选TCT,其中HPV感染者280例,使宫颈细胞学、HPV检测结果及组织学诊断并存。304例中仅24例HPV阴性,HPV检测初筛了92.1%的 CC和CIN,且集中于 HPV16、58、52、33、31、18、53 等几种常见高危型HPV单独或混合感染,TCT检测仅34例TCT未见异常,初筛88.8%(270/304)的 CC和各级别的CIN,该数据支持宫颈病变筛查后进一步积极处理和预后判断。但HPV阴性(CC 1例)或TCT阴性(CC 4例、CINⅢ3例、CINⅡ8例)的可疑CC和CINⅢ、CINⅡ,需及时组织诊断。宫颈细胞学、组织学诊断及常见的几种高危型HPV感染(每一种亚型病例数包含多型HPV感染病例)的数量统计见表2、表3。

表2 280例HPV常见亚型与宫颈细胞学检测结果
将HSIL、ASCUS及LSIL视作TCT阳性,细胞学检测阳性结果与是否感染HPV及HPV分型没有相关性(χ2=9.588,P=0.143)。但几种常见的高危型 HPV 如 HPV16、58、52、33 以及 HPV31、18、53 感染宫颈后,HSIL、ASCUS及LSIL的发生率增加,统计分析细胞学分型与HPV常见高危亚型的对应关系,TCT分型与HPV的几种常见高危亚型有较弱的相关关系(χ2=31.206,P=0.002,Pearson 列联系数=0.322),定期细胞学筛查可动态观察HPV感染的自然进程。

表3 304例宫颈组织学、细胞学、HPV检测结果
304例患者细胞学结果与HPV感染没有相关关系,χ2=0.639,P=0.424,但 TCT 结果与组织学分型有较弱的相关关系,χ2=9.232,P=0.026,Pearson列联系数 =0.172。TCT阳性诊断(HSIL、ASCUS、LSIL)与组织学分型之间,仍存在较弱的相关关系,χ2=18.452,P=0.005,Pearson 列联系数 =0.253,说明细胞学结果为进一步诊治宫颈病变可提供良好的选择。
3 讨论
高危型HPV持续感染可通过早期开放阅读框E6、E7和E2导致宿主细胞的抑癌基因丢失或肿瘤基因过表达,成为宫颈癌(CC)及癌前病变(CIN)的主要始动因素和独立危险因素[5-6]。我们通过分析2 481例CIN和CC患者中21种HPV亚型的感染情况,发现HPV阳性率达85.0%,HPV16亚型的感染率占21种亚型的一半以上(56.1%)。在667例CC患者近90%存在HPV感染,在CINⅡ、CINⅢ中,仍普遍存在HPV(分别为92.8%、98.0%)感染,且与宫颈组织学结果有较强的相关性,尤其是HPV16、18、58、33、31、52 单型感染,表明 CINⅡ/Ⅲ患者可因 HPV16、18、58、33等高危亚型 HPV持续作用最终向宫颈癌转化。在众多CINⅠ患者中,HPV感染率 70.3%,29.7%的 CINⅠ患者 HPV阴性,而感染HPV16、HPV52、HPV58亚型后发生CINⅠ的几率分别是20%、25.0%、12.3%,可见 CINⅠ病因复杂,除HPV之外还存在其他致瘤因素和机体自身的免疫因素[6-7]。CINⅠ患者751例,基数较CINⅡ666例、CINⅢ 397例和 CC 667的大,以及HPV阴性在CINⅠ、CINⅡ、CINⅢ和CC中的比例分别是 29.7%、7.2%、2.0%、14.4%,说明 CINⅠ可自然 消 退[4],仅 部 分 患 者 可 因 HPV16、HPV18、HPV58、HPV33、HPV31、HPV52、HPV45、HPV59、HPV68等高危亚型的持久感染、免疫力低下等原因逐步进展为CINⅡ、Ⅲ甚至CC。然而,CC患者除了发生HPV16感染,其它HPV亚型感染并未呈上升趋势(图1所示),甚至HPV阴性的CC病例高出CINⅢ病例(14.4%:2.0%),这与 CC 的发生发展可能掺杂了其它的理化、生物因素,甚至存在遗传易感性、免疫状况、内分泌、营养、精神、生活习惯等因素有关,还与初次性交时间、孕产数、性伴侣数、性传染病史、不洁性生活发生病原菌交叉感染等密不可分,综合作用使局部病变因免疫力受损而增加向CC发展的风险[8-12]。
我们进一步分析得知 CC 与 HPV16、18、58、33、52、31、45等亚型关系紧密。性接触或被HPV污染的物品可引起HPV感染,导致宫颈局部损伤,并受T细胞介导的免疫因素影响。当免疫力提高后80~90%的HPV感染呈一过性,在6~10个月内自动消失,仅有一小部分HPV逃避宿主NK/T细胞和朗汉斯细胞(LC)的免疫监视发展为持续感染。如存在协同致瘤因子:吸烟、长期使用免疫抑制、口服避孕药以及合并人类免疫缺陷病毒(HIV)、Epstein-Barr病毒(EBV)、单纯疱疹病毒Ⅱ型(HSV-Ⅱ)、巨细胞病毒(CMV)、衣原体(CT)、支原体(UU)、细菌感染等高危因素,宫颈癌的风险也就大大增加[1,13]。我们通过对已婚妇女每半年、1年甚至2~3年重复宫颈细胞学、21种HPV亚型检测联合阴道镜检查进行宫颈癌筛查和临床随访,在最大程度减少宫颈创伤的条件下及时发现可疑病变。对并存宫颈细胞学、HPV检测及组织学诊断的304例患者进行统计分析,尽管细胞学检测结果与HPV感染与否没有相关性,但常见的高危型 HPV16、58、52、33以及 HPV31、18、53感染宫颈后,HSIL、ASCUS及LSIL的发生率增加,并有一定的统计学意义,故HPV初筛了92.1%(280/304)的 CC和 CIN,且集中于 HPV16、58、52、33、31、18、53 等型的单独或混合感染。分析TCT诊断HSIL、ASCUS、LSIL与组织学分型,二者存在较弱的相关关系,故TCT初筛后经过进一步活检确诊了88.8%的CC和各级别的CIN。因此,HPV和TCT检测促进了对宫颈病变的积极诊治和预后判断,高危型HPV感染或合并HSIL、ASCUS、LSIL患者宜及时活检、定期阴道镜检,必要时宫颈管内取样随访,防止进行性宫颈上皮内瘤变甚至宫颈癌的发生。
由于细胞学与组织学的相关关系较弱,TCT阴性者发生 CINⅠ(55.9%)、CINⅡ(23.5%)、CINⅢ(8.8%)和 CC(11.8%)的可能性就不容忽视,当妇检或阴道镜检不满意或反复 HPV16、58、52、33、31、18、53等亚型阳性,需高度重视,及时或重复宫颈活检以避免漏诊部分CC和CIN。我们TCT阴性的CC、CINⅢ/Ⅱ病例也可发生单型或多型HPV感染,故我们肯定宫颈活检在确诊宫颈病变中的地位,但不否定TCT在大范围体检筛查中快捷、无创、可重复的宫颈细胞学分类诊断优势,结合HPV检测,实现了宫颈癌的广泛筛查和早发现、早治疗,也避免了多数妇女在宫颈癌筛查中不必要的组织破坏。
目前浸润性宫颈癌已相对少见,宫颈癌的死亡率随之大大下降,但已婚妇女CIN的发生率呈明显的上升之势,并常伴随高危型或多型HPV感染。曾有分析认为仅10%CINⅠ进展为CINⅡ、CINⅢ,未治疗的CINⅡ约22%进展为CINⅢ,也不排除CINⅢ逆转为正常的可能,当CINⅢ合并高危型HPV感染可迅速进展为宫颈癌[4,14],故应及时处理 CINⅡ、CINⅢ和HPV感染,并重视治疗后的随访。在临床工作中,对于阴道镜检查不满意者及时宫颈定位活检或诊断性切除宫颈病变送检,排除宫颈管内可能存在隐匿性的高级别CIN或浸润癌灶;慢性宫颈炎、CINⅠ选择物理治疗和定期随访,并注重个人清洁卫生,增强机体免疫力,实现多层次、多角度防治CC。
[1] Wheeler CM,Hunt WC,Cuzick J,et al.A population-based study of human papillomavirus genotype prevalence in the United States:baseline measures prior to mass human papillomavirus vaccination[J].Int J Cancer,2013,132(1):198-207.
[2] Solomon D,Davey D,Kurman R,et al.The 2001 Bethesda System:terminology for reporting results of cervical cytology[J].JAMA,2002,287(16):2114-2119.
[3] 陈乐珍.妇产科诊断病理学[M].北京:人民军医出版社,2010:117-120.
[4] Piris S,Bravo V,Alvarez C,et al.Natural history of histologically moderate cervical dysplasia in adolescent and young women[J].Onco Targets Ther,2014 7:2101-2106.
[5] Mandal P,Bhattacharjee B,Das Ghosh D,et al.Differential expression of HPV16 L2 gene in cervical cancers harboring episomal HPV16 genomes:influence of synonymous and non-coding region variations[J].PLoS One,2013,8(6):e65647.
[6] Tang SY,Li L,Li YL,et al.Distribution and location of Daxx in cervical epithelial cells with high risk human papillomavirus positive[J].Diagn Pathol,2014,9(1):1.
[7] Rositch AF,Silver MI,Burke A,et al.The correlation between human papillomavirus positivity and abnormal cervical cytology result differs by age among perimenopausal women[J].J Low Genit Tract Dis,2013,17(1):38-47.
[8] Ramos CA,Narala N,Vyas GM,et al.Human papillomavirus type 16 E6/E7-specific cytotoxic T lymphocytes for adoptive immunotherapy of HPV-associated malignancies[J].J Immunother,2013,36(1):66-76.
[9] 木则帕尔·太来提,阿尼克孜·阿不都艾,玛依努尔·尼牙孜,等.人乳头状瘤病毒16型、18型、单纯疱疹病毒2型和巨细胞病毒感染与宫颈癌的关系[J].疾病预防控制通报,2013,28(1):10-13.
[10]陶萍萍,张国荣,卞美璐,等.女性生殖道21种亚型人乳头状瘤病毒感染与性行为、孕产史、文化程度等因素相关性分析[J].中国妇产科临床杂志,2008,9(1):20-23.
[11] Aili A,Hasim A,Kelimu A,et al.Association of the plasma and tissue riboflavin levels with C20orf54 expression in cervical lesions and its relationship to HPV16 infection[J].PLoS One,2013,8(11):e79937.
[12] Isaakidis P,Pimple S,Varghese B,et al.HPV infection,cervical abnormalities,and cancer in HIV-infected women in Mumbai,India:12-month follow-up[J].Int J Womens Health,2013,5:487-494.
[13] Khenchouche A,Sadouki N,Boudriche A,et al.Human papillomavirus and Epstein-Barr virus co-infection in cervical carcinoma in Algerian women[J].Virol J,2013,10:340.
[14] Bian ML,Cheng JY,Ma L,et al.Evaluation of the detection of 14 high-risk human papillomaviruses with HPV 16 and HPV 18 genotyping for cervical cancer screening[J].Exp Ther Med,2013,6(5):1332-1336.

