QuEchERs-GC法测定蜜蜂生物体的氟胺氰菊酯残留
陈 芳 李 熠 王 勇 曹葳蕤 魏 月 吴黎明
(1中国农业科学院蜜蜂研究所;2农业部蜂产品质量安全风险评估实验室)
引 言
蜂螨是蜜蜂的天敌,也是蜜蜂最为严重的病害。西方蜜蜂几乎100%感染大蜂螨,且蜂群每年要用药物防治1~3次,才能保证蜂群正常繁衍。氟胺氰菊酯因其对蜜蜂低毒而对蜂螨的极强杀伤力而被常运用于螨害的防治中[1]。当向蜂巢中喷洒药物时,由于蜜蜂的卫生行为,大部分的药物会因蜜蜂吞咽活动进入蜜蜂体内;此外,氟胺氰菊酯具有挥发性,蜜蜂在挂有螨片的蜂箱中活动,其身体表面会沾染药物。由于蜜蜂的高敏感性和短的生命周期,多数药物在很短的时间内在蜜蜂体内的残留都将降至一个很低的水平,但由于氟胺氰菊酯易稳定地积累于巢脾中[2,3],巢脾(或巢础)的循环利用使其成为药物的二次污染源[4]。蜜蜂在蜂箱内可自由活动,氟胺氰菊酯就很可能粘附在蜂足上到处散布,药物残留就转移到了蜂产品中,造成蜂产品的污染[5],并在蜜蜂体内产生蓄积[6]。由于氟胺氰菊酯具有发育和生殖毒性,其残留对消费者存在一定的健康风险[7],欧盟已将其列入了内分泌干扰物名单[8]。因此,本研究拟建立一种快速、简便、廉价、高效、稳健和安全的(QuEch-ERs)蜜蜂体内氟胺氰菊酯残留检测方法。通过测定蜜蜂体内氟胺氰菊酯的残留来监测蜂产品可能的污染情况。
1 材料与方法
1.1 仪器与试剂
气相色谱-电子捕获检测器(美国Agilent公司);色谱柱 (30 m×0.25 mm×0.25 μm,HP-5或相当者);天平;均质器;旋转蒸发仪;氮吹仪;离心机;冷冻研磨仪;冰箱;QuEchERs基质分散固相萃取管。
氟胺氰菊酯标样(1000 mg/L,1ml;sigma)。正己烷、乙腈均为色谱纯(美国 J.T.Baker公司);实验用水为去离子水。
1.2 蜜蜂样品提取
取5只蜜蜂用液氮冷后迅速在冷冻研磨仪中粉碎,将粉碎后的蜜蜂转移至15 ml QuEchERs基质分散管中,用10 ml乙腈/水(v/v)=5:1分次清洗粉碎池,并且将清洗溶液收集至15 ml分散管中。旋转振荡提取30 min,取出离心管在8000 rpm/min转速下离心5 min,取上清液,上清液氮吹至1 ml,残渣再用8 ml的乙腈提取一次,5000 rpm/min离心后取上清液至上一次浓缩的小管中,氮吹至干后用2 ml正己烷复溶过滤备用。
1.3 色谱分析
进样口:260℃ 不分流
检测器(μECD):290℃
程序升温:100℃保留1 min
8℃/min升至230℃,保留5 min
10℃/min升到290℃,保留3.75 min
载气:高纯氮(>99.999%)
流速:1 ml/min
进样体积:1μl
0.1 mg/L的标样经气相色谱分离后色谱图见图1。
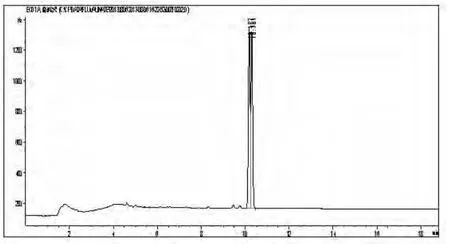
图1 氟胺氰菊酯标样图
2 结果与讨论
2.1 样品的提取与净化
蜜蜂样品是生物样品,且蜜囊内存有粘稠的蜂蜜样品,普通的冷冻后机械粉碎效果不佳,因此在液氮迅速冷冻下用冷冻研磨仪进行组织捣碎后再进行目标化合物的提取。为了实现快速、高效、准确的样品前处理,选择了商品化的QuEchERs基质分散管,实现提取净化一体完成。根据药物及基质的性质,选择了PSA、GBC和C-18等3种可能适合的填料进行提取净化,PSA(N-丙基乙二胺)是一种固相吸附剂有比氨基柱更强的离子交换能力。广泛用于植物农残分析样品的处理,去除有机酸、色素和金属离子;C-18用于吸附样品中的脂类物质,而GCB(石墨化炭黑)去除色素的效果很好。将这3种填料组合后最终选择的QuEchERs基质分散管的内容物分别是:①150 mg PSA,45 mg GCB,900 mg无水 MgSO4;②150 mg PSA,150 mg C-18,900 mg无水 MgSO4;③150 mg PSA,900 mg 无水 MgSO4。
实验结果显示:①号基质分散固相萃取能够有效地去除色素及其他基质干扰,提取溶液澄清透明且色谱图干净,但目标化合物的回收率略低;②号基质分散固相萃取后的溶液基本无色且透明,且目标化合物出峰时间段没有基质干扰,回收率也符合农兽药残留分析要求;③号基质分散固相萃取液颜色较深,且色谱图中杂峰较多,净化不完全,长时间多次进样可能会造成进样口、柱子及检测器的污染。
综合上述结果,本研究选择了②号基质固相分析体系。各种填料回收率比较的结果见表1。

表1 3种基质固相分散填料对蜜蜂样品中氟胺氰菊酯的提取效率比较
2.2 方法的线性、准确性及精密度
为确定标准曲线的线性,以 0.01、0.05、0.1、0.5、1.0 mg/L等5个浓度对应的峰面积建立标准曲线,直线回归的相关系数为0.9964,说明氟胺氰菊酯在102的动态范围内具有很好的线性,能够涵盖日常分析工作中的浓度变化范围。以空白加标样品中目标化合物出峰时间左右两侧基线为噪声,3倍性噪比为检出限,该方法的检出限为4.52μg/kg,以10倍性噪比计算定量限,定量线为15.1μg/kg。另外,采用了不同浓度的加标回收来确定方法的准确性,加标浓度为20μg/kg、50μg/kg及100μg/kg,回收率为64.3~107.2%,以同日及隔日加标样品的相对标准偏差来计算方法的精密度,日内偏差为4.3~8.9%,日间为6.7~11.7%,符合农兽药分析要求。具体结果见表2。
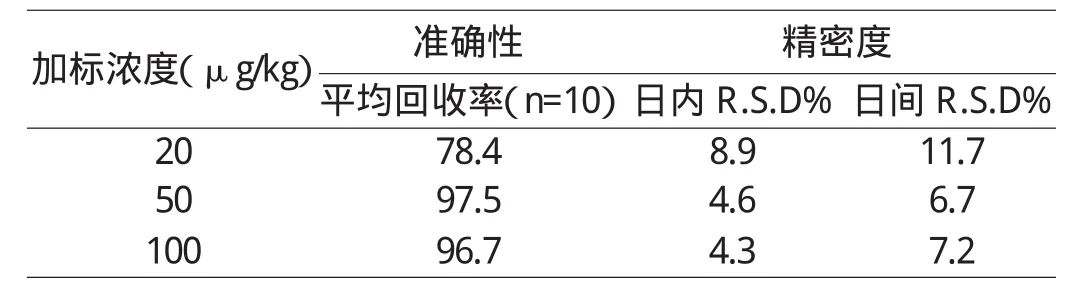
表2 方法的准确性及精密度
2.3 蜜蜂样品的测定
运用上述分析方法,我们测定了挂螨片蜂群中蜜蜂体氟胺氰菊酯残留情况,共采集7个蜂群蜜蜂样品63个,时间跨度为挂片当天至挂片后65天,施药浓度为不挂片、半片、1片及2片。结果显示,未施药时,所有蜂群的蜜蜂样品中氟胺氰菊酯残留基本处于检出限附近,个别样品为未检出;施药后,在未挂螨片的蜂群中,蜜蜂体内的氟胺氰菊酯残留水平显著低于施药蜂群,但其变化规律与用药蜂群基本一致,在3~7天达到峰值,之后迅速下降,13天以后缓慢下降,至45天后残留水平基本在检出限附近;不同用药水平对蜜蜂体残留的影响主要体现在残留峰值上,最大施药蜂群的残留峰值可高达1 mg/kg,在13天后差异不明显。
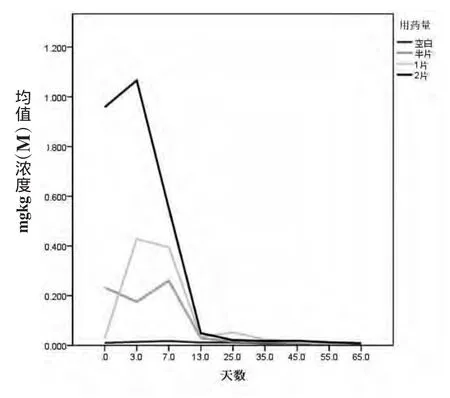
图2 不同用药水平对蜜蜂体内氟胺氰菊酯残留的影响
3 结论
用液氮冷冻研磨,QuEchERs固相基质分散提取净化蜜蜂样品,是一种快速、高效、准确的样品前处理方法,PSA和C-18能有效地去除糖类、脂类及少量色素类物质的干扰,达到有效净化。该方法具有能涵盖日常测定需求的线性范围、准确度和精密度。蜜蜂样品的分析表明,蜜蜂体内的氟胺氰菊酯残留峰值主要集中在施药后的3~7天,由于药物的自然挥发及蜜蜂生命周期短等原因,蜂群中蜜蜂体内的氟胺氰菊酯残留急剧下降,其残留水平在检出限附近。
[1]代平礼,王强,孙继虎,等.4种农药对意大利蜜蜂的毒力测定.农药,2007(08):546-547.
[2]Tsigouri,A.D.,U.Menkissoglu-Spiroudi,and A.Thrasyvoulou,Study of tau-fluvalinate persistence in honey.Pest Management Science,2001.57(5):467-471.
[3]Corta,E.Bakkali,A.Barranco,A.et al.,Study of the degradation products of bromopropylate,chlordime form,coumaphos,cymiazole,flumethrin and tau-fluvalinate in aqueous media.Talanta,2000.52(2):169-180.
[4]Fries,I.,K.Wallner,and P.Rosenkranz,Effects on Varroa jacobsoni from acaricides in beeswax.Journal of Apicultural Research,1998.37(2):85-90.
[5]Lodesani,M.Costa,C.Serra,G.et al.,Acaricide residues in beeswax after conversion to organic beekeeping methods.Apidologie,2008.39(3):324-333.
[6]Skerl,M.I.S.,V.Kmecl,and A.Gregorc,Exposure to Pesticides at Sublethal Level and Their Distribution Within a Honey Bee(Apis mellifera)Colony.Bulletin of Environmental Contamination and Toxicology,2010.85(2):125-128.
[7]Http://pesticideinfo.org/Detail_Chemical.jsp Rec_Id=PC38853
[8]Food and Drug Administration of the United States.Pesticides tolerances.http://www.cfsan.fda.gov

