分泌IL- 21的白血病细胞系的建立及其抑瘤作用
朱 琰,孙 蕊,王春景,刘玉琴
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 病理学系, 北京 100005)
分泌IL- 21的白血病细胞系的建立及其抑瘤作用
朱 琰,孙 蕊,王春景,刘玉琴*
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 病理学系, 北京 100005)
目的建立及鉴定稳定表达白介素21的4种白血病细胞系,并初步分析其刺激活化的淋巴细胞对肿瘤细胞的杀伤功能。方法构建携带白介素21和红色荧光蛋白基因的质粒,包装慢病毒,感染4种白血病细胞系,连续传代后,通过荧光显微镜、流式细胞仪和ELISA法鉴定建立的4种细胞系。以稳定分泌IL- 21白血病细胞为抗原刺激外周血单个核细胞增殖,细胞分析计数仪检测增殖倍数,流式细胞仪分析淋巴细胞的表型,细胞计数试剂盒(CCK8)检测增殖后的淋巴细胞对肿瘤细胞的杀伤作用。结果建立稳定表达IL- 21的4种细胞系:K562-IL- 21、THP- 1- IL- 21、jurkat E6- 1- IL- 21和RPMI8226-IL- 21。3份人PBMC在4种分泌IL- 21的白血病细胞的作用下都有增殖,增殖倍数在1.147±0.057~2.725±0.345倍之间。不同数量的IL- 21分泌白血病细胞都可激活淋巴细胞增殖,增殖的倍数在1.127±0.152~2.213±0.200之间。增殖后CD3+T淋巴细胞和CD56+NK细胞的比例降低(Plt;0.05),CD19+B淋巴细胞比例增加(Plt;0.05);由分泌IL- 21白血病细胞激活后的淋巴细胞对母系白血病细胞的杀伤作用明显高于对照组。由分泌IL- 21白血病细胞激活后的淋巴细胞对母系白血病细胞和其他7种肿瘤细胞均有杀伤作用,杀伤率在(28.68±9.31)%~(78.45±0.61)%之间。结论4种分泌IL- 21的白血病细胞可刺激PBMC增殖并激活其对肿瘤细胞的杀伤作用。
白血病细胞系;白介素21;肿瘤治疗
白介素21(interleukin- 21,IL- 21)是由131个氨基酸残基构成,分子质量为15 000的种蛋白质,主要由活化的CD4+Th细胞分泌。因其3级结构中包含4个α螺旋且其受体中亦包含γ链,故与IL- 2、IL- 4、IL- 7和IL- 15等同属于Ⅰ类细胞因子[1]。IL- 21的生物学功能与IL- 2和IL- 15具有相似性,其可通过对淋巴细胞的调节在自身免疫、过敏和肿瘤细胞杀伤中发挥作用[2]。本研究应用含有IL- 21和红色荧光蛋白(red fluorescence protein,RFP)基因的慢病毒感染4种白血病细胞系,使其稳定表达IL- 21。用稳定表达IL- 21的白血病细胞刺激PBMC,观察其增殖倍数、淋巴细胞表型和对肿瘤细胞的杀伤效果等。
1 材料与方法
1.1 材料
RPMI- 1640(改良)、DMEM(高糖)、胎牛血清(Fetal Calf Serum, FBS)、双抗(青霉素和链霉素)、0.25%的胰蛋白酶、K562、THP- 1、Jurkat E6- 1、RPMI8226、HEK293T、SF- 126、A549、HCT116、786- O、Raji和Colo205(中国医学科学院基础医学所细胞资源中心),浓缩人白细胞(来自健康献血员,成分输血的废弃物)(北京市血液中心),淋巴细胞分离液(MP Biomedicals公司),pVSVG和Δ8.91质粒(中国科学院生化细胞所肖磊教授馈赠),lv-c-Myc-RFP质粒由本实验室保存,人的IL- 21质粒(ORIGENE公司),所用引物均由Invitrogen公司合成,FuGENE® HD高效转染试剂(Roche公司),BamHⅠ-H内切酶、NheⅠ-HF内切酶(NEB公司),T4连接酶(日本东洋纺公司),PCR MIX(GENERAY公司),QIAquick Gel Extraction Kit和QIAquick PCR Purification Kit(QIAGEN公司),DH5α 感受态菌和去内毒素质粒大提试剂盒(TIANGEN公司),慢病毒感染增强试剂(Engreen公司),慢病毒纯化试剂盒(ExcellBio公司),ELISA检测试剂盒(ELIXIR医药公司),CCK8试剂盒(上海合元生物公司),CD3-FITC、CD56-APC和CD19-PE抗体(BD公司),人的IL-2(PEPROTECH公司)。
1.2 细胞培养
K562、THP- 1、jurkat E6- 1和RPMI8226均用含10% FBS的RPMI1640培养基置于37 ℃、5% CO2、饱和湿度孵箱中培养,待细胞汇合度达80%~90%,收集细胞,1 000 r∕min离心5 min,弃上清,重悬后按1∶5的比例传代,继续培养,以进行相关实验。293T细胞用含10% FBS的DMDM(高糖)培养基培养,待细胞汇合度达80%~90%时,用0.25%的胰蛋白酶+0.03% EDTA消化,按1∶5的比例传代,继续培养,以进行相关实验。
1.3 质粒构建
以IL- 21质粒为模板,上游引物5′-CGGGATCC ATGAGAATTTCCAAACCACATT-3′和下游引物5′-C CGGCTAGCTTAAGAAGTATTGATGAACATTT-3′,PCR扩增IL- 21,上、下游引物分别引入BamHⅠ和NheⅠ酶切位点。反应条件为94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s。变性、退火、延伸共35个循环后,72 ℃充分延伸10 min。lv-c-Myc-RFP质粒和PCR产物经BamHⅠ和NheⅠ双酶切后分别切凝胶回收,T4连接酶连接。连接产物转化DH5α感受态细胞,氨苄青霉素平板筛选重组菌。挑选单克隆,经PCR和测序鉴定。
1.4 慢病毒包装、纯化和感染
1.4.1 慢病毒包装:用FuGENE® HD2000:转染试剂将3种质粒 (lv-c-IL- 21-RFP、pVSVG和delta 8.91,质量比为4∶2∶3) 混合后转染293T细胞,转染8 h后更换新鲜培养基,置于37 ℃、5% CO2、饱和湿度孵箱中培养。48 h后收集含病毒培养基上清,用0.22 μm的滤膜过滤。
1.4.2 慢病毒纯化:将收集的病毒液与浓缩试剂按照4∶1的比例加入离心管,颠倒混匀后置于4 ℃冰箱过夜。5 000 r/min离心30 min后吸弃上清,病毒沉淀用200 μL PBS重悬,备用。
1.4.3 慢病毒感染:提前1天将细胞接种于24孔板,每孔500 μL培养基。4 μL的感染增强试剂用25 μL无血清稀释液稀释,充分混匀,4 ℃静置5 min。加入5 μL病毒原液轻柔混匀后,4 ℃静置15 min。将上述混合液加入细胞的完全培养基中。37 ℃放置8 h后,更换新鲜的完全培养基。
1.5 稳定表达IL- 21的细胞系的鉴定
感染病毒后的4种细胞每5天换液1次,到30 d时,观察细胞明显增殖,重复感染1次,再经过30 d后,流式细胞分选表达红色荧光细胞。之后细胞按1∶2比例进行传代,该天设定为D0天。分别于第5天(D5)、第10天(D10)和第15天(D15)时离心取上清,ELISA检测IL- 21的表达情况,并连续将细胞按1∶2比例传代。第15天(D15)时,取1×105个细胞接种于24孔板中,加入1 mL培养基,5 d后(D20)检测4种细胞上清中IL- 21产生量。第20天时将细胞分别命名为K562-IL- 21、THP- 1- IL- 21、Jurkat E6- 1- IL- 21和RPMI8226-IL- 21。取同一时间段未感染病毒的同种细胞上清作空白对照。
1.6 刺激淋巴细胞增殖活化
用淋巴细胞分离液分离浓缩人血液白细胞中的外周血单个核细胞(peripheral blood mononuclear cell,PBMC)并计数,分别取1×106个PBMC与表达IL- 21的4种白血病细胞按照10∶1、20∶1、50∶1和100∶1的比例混合后,置于24孔板中培养,培养基量为1 mL,同时加入100 U IL- 2。荧光显微镜观察混合细胞中荧光细胞所占比例,至荧光细胞全部死亡后,进行细胞计数并通过流式检测表达IL- 21的白血病细胞所占比例。在相同培养条件下,用母系白血病细胞刺激PBMC至相同天数,作为阴性对照。同时以相同培养基单独培养PBMC作为空白对照。
1.7 增殖活化淋巴细胞的流式分析
取1×105个增殖活化的淋巴细胞,用CD3-FITC、CD56-APC和CD19-PE流式抗体染色后用流式细胞仪检测细胞表面分子的表达情况。
1.8 肿瘤细胞杀伤实验
以上述增殖的淋巴细胞作为效应细胞,分别以K562、THP- 1、Jurkat E6- 1、SF- 126、A549、HCT116、786-O和RPMI8226肿瘤细胞作为靶细胞,效靶比设为50∶1,设2个平行孔,置37 ℃、5% CO2培养箱中孵育24 h后,每孔加入10 μL CCK8溶液,37 ℃继续孵育4 h,于酶标仪(波长450 nm)检测吸光度值(A),计算杀伤率。计算公式为:杀伤率=[1-(A实验孔-A效应孔)/A靶细胞孔]× 100%。
1.9 统计学分析

2 结果
2.1 lv-c-IL- 21-RFP重组质粒的构建
成功构建重组质粒lv-c-IL- 21-RFP,目的基因PCR产物行琼脂糖凝胶电泳,可见约500 bp处明显条带,大小与IL- 21基因相符(图1)。经测序,DNA序列与IL- 21基因100%匹配(图2)。
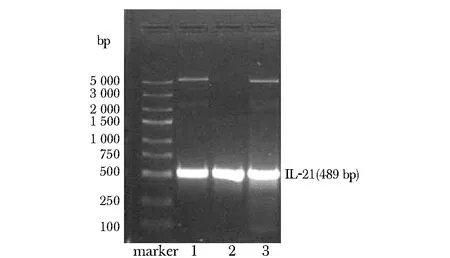
1~3.repeat 3 times图1 IL- 21的PCR产物电泳图Fig 1 Electrophoresis of PCR products of IL- 21
2.2 慢病毒的包装
慢病毒包装24 h后荧光显微镜下观察,细胞表达强的红色荧光(图3A,B)。慢病毒包装48 h后,细胞仍表达明显红色荧光(图3C,D)。
2.3 表达IL- 21白血病细胞系的建立
细胞第2次感染病毒30 d后在荧光显微镜下观察,持续表达红色荧光(图4)。表达红色荧光细胞比例达99%以上(图5),全部细胞都为表达IL- 21的细胞。ELISA法检测培养细胞上清,各细胞系均持续稳定表达IL- 21(表1)。总体上,5~15 d之间,随时间延长,分泌量增加。第15天时,4种白血病细胞各取1×105个,培养至第20天时上清中均表达IL- 21。

图2 目的基因的部分测序峰图Fig 2 The sequencing map of segmental DNA of IL- 21

A,B.lv-c-IL- 21-RFP expression in the same field after 24 hours;C,D.lv-c-IL- 21-RFP expression in the same field after 48 hours图3 293T细胞中慢病毒的包装Fig 3 The package of lentivirus-IL- 21 in 293T cell line(×100)

A,B.THP- 1- IL- 21 cell line in the same field;C,D.RPMI8226-IL- 21 cell line in the same field;E,F.jurkat E6- 1- IL- 21 cell line in the same field;G,H.K562-IL- 21 cell line in the same field
图4稳定表达红色荧光蛋白的白血病细胞系
Fig4leukemiacelllineswithRFPexpressingconstitutively(×100)
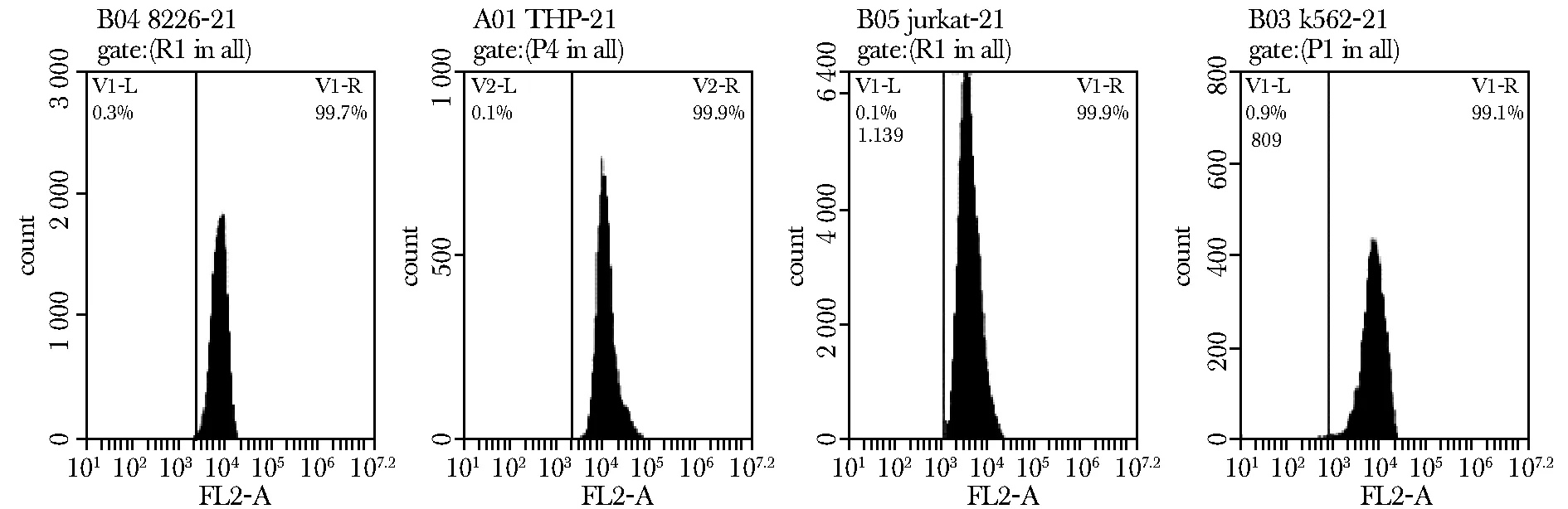
8226- 21:RPMI8226-IL- 21 cell line; THP- 21:THP- 1- IL- 21 cell line; jurkat- 21:jurkat E6- 1- IL- 21 cell line; K562- 21:K562-IL- 21 cell line
图5表达红色荧光细胞在白血病细胞群体中的比例
Fig5ThepercentageofRFP-positivecellsintheleukinmacelllines
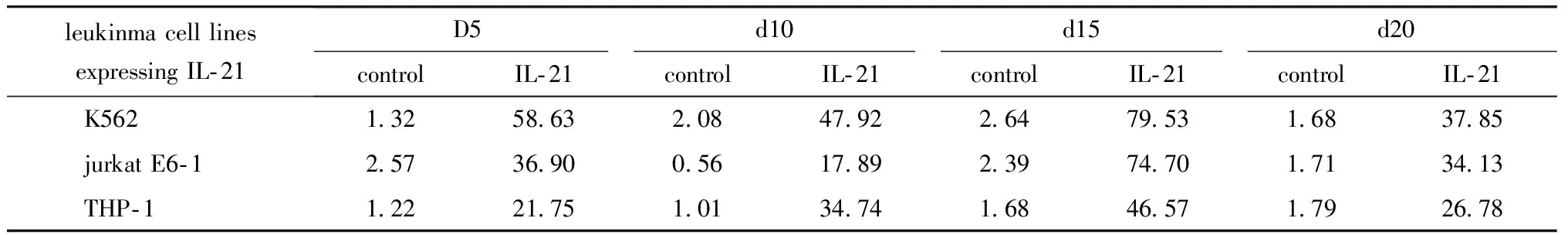
表1 不同天数4种白血病细胞IL- 21的表达水平Table 1 The concentration of IL- 21 expressed by four leukinma cell lines at different days(pg/mL)
2.4 淋巴细胞的增殖及表型分析
3份PBMC在4种分泌IL- 21白血病细胞的作用下都有增殖,增殖倍数在1.147±0.057~2.725±0.345倍之间(图6),淋巴细胞的增殖倍数在3份之间无显著性差异。不同数量的抗原细胞都可激活淋巴细胞增殖,增殖的倍数在1.127±0.152~2.213±0.200之间,增殖的淋巴细胞数量之间亦无显著性差异(图7)。

图6 4种IL- 21分泌白血病细胞刺激的3份淋巴细胞的增殖倍数Fig 6 Amplification fold of lymphocytes stimulated by four IL- 21-expressing leukemia cells in 3 samples

图7 4种数量的IL- 21分泌白血病细胞刺激的淋巴细胞增殖倍数Fig 7 Amplification fold of lymphocytes stimulated by four different numbers of leukemia cells
增殖体系中无表达红色荧光蛋白的细胞存在,全部计数的细胞均为为淋巴细胞。分泌IL- 21的白血病细胞刺激增殖后CD3+T淋巴细胞和CD56+NK细胞比例下降(Plt;0.05),CD19+B淋巴细胞比例增加(Plt;0.05)(图8)。
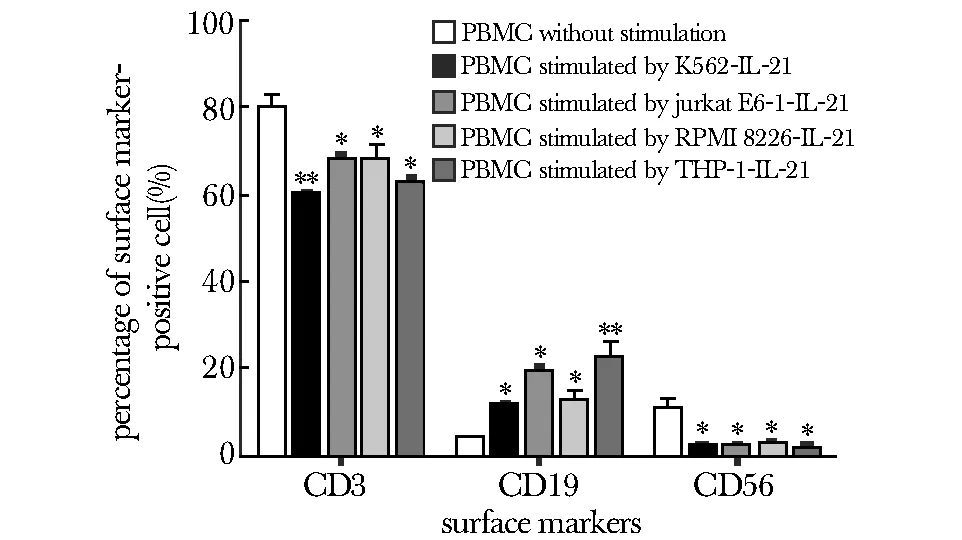
*Plt;0.05, **Plt;0.05 compared with PBMCwithout stimulation图8 增殖淋巴细胞的表型分析Fig 8 Surface marker analysis of amplified lymphocytes by flow cytometry
2.5 增殖淋巴细胞对肿瘤细胞的杀伤
由分泌IL- 21白血病细胞激活后的淋巴细胞对母系白血病细胞的杀伤作用明显高于对照组(表2)。活化淋巴细胞对母系白血病细胞和其他7种肿瘤细胞均有明显的杀伤作用,杀伤率在28.68%±9.31%~78.45%±0.61%之间(图9)。K562-IL- 21、jurkat E6- 1- IL- 21和THP- 1- IL- 21刺激活化的淋巴细胞对母系白血病细胞有较强的杀伤作用,杀伤率均高于65%。而jurkat E6- 1、K562、789-O和THP- 1这4种肿瘤细胞对4种活化淋巴细胞的杀伤作用都比较敏感,其杀伤率均高于60%。

表2 活化的淋巴细胞对母系白血病细胞的杀伤率Table 2 Cytotoxic rate of activated lymphocytes actingon original tumor cells(%)

图9 活化淋巴细胞对8种肿瘤细胞的杀伤作用Fig 9 Cytotoxic activity of activated lymphocytes acting on eight tumor cells
3 讨论
IL- 21是新型的具有潜在肿瘤治疗价值的细胞因子。IL- 21的生物学功能与IL- 2和IL- 15具有相似性[3- 4],既可以刺激Th1、Th2、Th17和CD8+T细胞的活化与增殖[5- 6],促进B细胞的成熟与抗体分泌[7- 8],从而调节获得性免疫;也可以促进NK、NKT和γδT淋巴细胞等天然免疫细胞的增殖与杀伤[9- 11],从而调节固有免疫。因其同时调节获得性免疫和固有免疫,使其在自身免疫疾病和肿瘤的治疗中有广泛的应用前景。治疗转移性黑色素瘤和肾癌的Ⅰ期临床实验中,患者能够耐受IL- 21,同时IL- 21具有抗肿瘤活性并表现出浓度依赖性,使用IL- 21治疗转移性黑色素瘤的Ⅱ期临床实验中,其有效率已得到证明[12]。
本实验成功建立K562-IL- 21、THP- 1- IL- 21、jurkat E6- 1- IL- 21和RPMI8226-IL- 21等4个细胞系,目前未见文献报道。本实验通过构建携带IL- 21基因的病毒载体质粒,包装慢病毒,感染上述4种白血病系细胞,成功建立了稳定表达和分泌IL- 21的4种细胞系,并且4种细胞可体外刺激正常人来源的PBMC的增殖。
增殖激活后的PBMC可对多种肿瘤细胞发挥杀伤活性。肿瘤与IL- 21共同作用于PBMC时,可以同时激活获得性免疫和固有免疫系统,促进淋巴细胞的增殖以及细胞因子的释放,可有效杀伤多种肿瘤细胞。有报道[13]采集分离健康人PBMC,构建表达IL- 21基因的慢病毒载体,感染PBMC使其成为细胞因子诱导的杀伤细胞(CIK细胞)并鉴定后,四甲基偶氮唑盐(MTT)法检测CIK细胞对K562细胞的杀伤率低于本实验中K562-IL- 21刺激后的淋巴细胞对K562的杀伤率。说明本方法刺激出的淋巴细胞肿瘤杀伤效果较好,且操作过程相对简单,便于临床应用。
本实验成功建立稳定表达IL- 21的四种白血病细胞系,这些细胞可更加有效的刺激T淋巴细胞和B淋巴细胞增殖和杀伤功能,为肿瘤生物治疗提供了新思路。
[1] Parrish-Novak J, Dillon SR, Nelson A,etal. Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function[J]. Nature, 2000, 408:57- 63.
[2] Stolfi C, Pallone F, Macdonald T,etal. Interleukin- 21 in cancer immunotherapy Friend or foe? [J]. OncoImmunology, 2012, 1: 351- 354.
[3] Overwijk W, Schluns K. Functions of γC cytokines in immune homeostasis: Current and potential clinical applications[J]. Clinical Immunology, 2009, 132: 153- 165.
[4] Habib T, Nelson A, Kaushansky K. IL- 21: A novel IL- 2-family lymphokine that modulates B, T, and natural killer cell responses[J]. J Allergy Clin Immunol, 2003,112:1033- 1045.
[5] Khattar M, Miyahara Y, Schroder P,etal. Interleukin- 21 Is a Critical Regulator of CD4 and CD8+T Cell Survival during Priming under Interleukin- 2 Deprivation Conditions[J]. Plos One, 2014, 9: e85882. DOI: 10.1371/journal.pone.0085882
[6] Suto A, Kashiwakuma D, Kagami S,etal. Development and characterization of IL- 21-producing CD4+T cells[J]. J Exp Med, 2008, 205:1369- 1379.
[7] Rankin A, MacLeod H, Keegan S,etal. IL- 21 Receptor Is Critical for the Development of Memory B Cell Responses[J]. J Immunol, 2011, 186:667- 674.
[8] Lindner S, Dahlke K, Sontheimer K,etal. Interleukin 21-Induced Granzyme B-Expressing B Cells Infiltrate Tumors and Regulate T Cells[J]. Cancer Res, 2013, 73: 2468- 2479.
[9] Skak K, Frederiksen K, Lundsgaard D. Interleukin- 21 activates human natural killer cells and modulates their surface receptor expression[J]. Immunology, 2007, 123: 575- 583.
[10] Caccamo N, Todaro M, Manna M,etal. IL- 21 Regulates the Differentiation of a Human γδ T Cell Subset Equipped with B Cell Helper Activity[J]. Plos One, 2012, 7:e41940.DOI:10.1371/journal.pone.0041940
[11] Coquet J, Skak K, Davis I,etal. IL- 21 Modulates Activation of NKT Cells in Patients with Stage IV Malignant Melanoma[J]. Clin Transl Immunol, 2013, 2:1038- 1043.
[12] Petrella T, Tozer R, Belanger K,etal. Interleukin- 21 Has Activity in Patients With Metastatic Melanoma: A Phase II Study[J]. J Clin Oncol, 2012, 30:3396- 3401.
[13] Zhao N, Zhao MF, Rajbhandary S,etal. Effects and mechanism on anti-leukemic activity of cytokine-induced killer cells with an endogenous expression of interleukin- 21[J]. Natl Med J China, 2013, 93:293- 299.
Establishment of leukemia cell lines expressing IL- 21 and analysis of anti-tumor function
ZHU Yan, SUN Rui, WANG Chun-jing, LIU Yu-qin*
(Dept. of Pathology, Institute of Basic Medical Sciences, CAMS amp; School of Basic Medicine, PUMC, Beijing 100005, China)
ObjectiveTo establish leukemia cell lines expressing IL- 21 constitutively, and to analyze the activation function on lymphocytes by those cell lines.MethodsFour leukemia cell lines were infected with lentivirus carrying IL- 21 and RFP genes. Fluorescent microscope was used for observing the expression of RFP and flow cytometry was used for analyzing the percentage of RFP-positive cells. The concentration of IL- 21 in the medium was detected by ELISA. After stimulation with the IL- 21 stable-expressing leukemia cell lines, the amplification of PBMC were calculated by cell counter and the surface markers were analyzed by flow cytometry, while their cytotocicity towards different tumor cells were assessed with CCK8 test.ResultsFour leukemia cell lines stable-expressing IL- 21 were established, namely, K562-IL- 21, THP- 1- IL- 21, jurkat E6- 1- IL- 21 and RPMI8226-IL- 21. The lymphocytes amplification of 3 different samples varied from 1.147±0.057 to 2.725±0.345 times and the amplification folds of lymphocytes stimulated by different numbers of leukemia cells varied from 1.127±0.152 to 2.213±0.200. The percentage of CD3+T cell and CD56+NK cell decreased(Plt;0.05)while CD19+B cells increased(Plt;0.05) after stimulation. The killing rate of activated lymphocytes is much higher than that of control. The activated lymphocytes had powerful killing capacity on their stimulating leukemia cells and 7 other tumor cells and the killing rates ranged from 28.68±9.31% to 78.45±0.61%.ConclusionsFour leukemia cell lines stable-expressing IL- 21 may activate PBMC to kill different tumor cells.
leukemia cell lines;interleukin- 21;tumor therapy
2014- 04- 10
2014- 05- 21
*通信作者(correspondingauthor):ccc5@ibms.pumc.edu.cn
1001-6325(2014)07-0961-07
研究论文
R 361+.3
A

