艾塞那肽通过调控PPARα及ACOX1改善大鼠非酒精性脂肪肝病症状
武俊紫,牛世伟,贾亚敏,陶文艳,柳 波,李 燕,李树德
(1.昆明理工大学 昆华医学院 生物化学与分子生物学系, 云南 昆明 650504;2.云南省第一人民医院 干部保健科,云南 昆明 650036; 3.太原理工大学 现代科技学院 教务处,山西 太原 030021;4.昆明医科大学 药学院 药物化学系,云南 昆明 650504; 5.昆明医科大学 基础医学院 生物化学与分子生物学系, 云南 昆明 650504)
艾塞那肽通过调控PPARα及ACOX1改善大鼠非酒精性脂肪肝病症状
武俊紫1,2,牛世伟1,2,贾亚敏3,陶文艳4,柳 波4,李 燕2*,李树德5*
(1.昆明理工大学 昆华医学院 生物化学与分子生物学系, 云南 昆明 650504;2.云南省第一人民医院 干部保健科,云南 昆明 650036; 3.太原理工大学 现代科技学院 教务处,山西 太原 030021;4.昆明医科大学 药学院 药物化学系,云南 昆明 650504; 5.昆明医科大学 基础医学院 生物化学与分子生物学系, 云南 昆明 650504)
目的研究艾塞那肽对高脂诱导的大鼠非酒精性脂肪肝病(NAFLD)的作用。方法120只SD大鼠随机分为对照组(CON)、模型组(HFD)、艾塞那肽低、中、高剂量干预组(ELD、EMD、EHD)和阳性药物多烯磷脂酰胆碱治疗组(PDC),每组20只,成功复制NAFLD模型后,给予相应治疗,治疗4周和8周后分别处死大鼠各半,肝脏切片HE染色、相应试剂盒检测肝功能、血脂指标,RT-PCR及Western blot测定PPARα及ACOX1的mRNA和蛋白表达。结果治疗8周后,肝脏HE染色除ELD外,PDC、EMD及EHD看不到任何脂肪颗粒浸润;治疗4周后,PDC、ELD、EMD以及EHD组与HFD组相比,肝功能指标AST、ALT与CHE,血脂指标CHOL与TG,明显降低(Plt;0.05),8周后进一步降低;治疗后肝脏组织过氧化物酶增殖激活受体α(PPARα)和酰基辅酶A氧化酶1(ACOX1)表达有显著改善。结论艾塞那肽可通过调控PPARα及ACOX1表达改善NAFLD大鼠症状。
艾塞那肽;非酒精性脂肪肝病;过氧化物酶增殖激活受体α;酰基辅酶A氧化酶1
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)是一种无酒精及其他明确原因所引起的肝脏脂代谢障碍型疾病[1],其疾病谱较广,包括单纯性非酒精性脂肪肝病,非酒精性脂肪肝炎及与其相关的肝纤维化和肝功能衰竭等[2]。艾塞那肽是从钝尾毒蜥蜴的唾液中提取的类似肠促胰岛素的生物活性肽,其具有促进胰岛素分泌、抑制胰高血糖素生成、刺激胰岛B细胞的增殖与分化、抑制B细胞凋亡等多项生理功能[3],另有研究显示,艾塞那肽还具有调节脂质代谢的作用[4],但关于其是否可以改善NAFLD症状,国内外均没有研究报道。
1 材料与方法
1.1 材料
1.1.1 动物来源:120只清洁级雄性SD大鼠,体质量160~180 g,昆明医科大学动物实验部提供[合格证号:SYXK(滇)2011-0004]。
1.1.2 药品与试剂:艾塞那肽注射液(Baxter Pharmaceutical Solutions LLC公司);多烯磷脂酰胆碱注射液(赛诺菲安万特制药有限公司);总胆固醇(CHOL)、三酰甘油(TG)试剂盒(南京建成生物工程研究所);谷草转氨酶(AST)、丙氨酸转氨酶(ALT)和胆碱酯酶(CHE)试剂盒(Bio-Swamp公司);总RNA提取试剂盒(天根公司);引物(英俊生物公司);抗体PPARα、ACOX1、β-actin及ECL发光试剂盒(Santa Cruz公司);二抗(中杉金桥公司)。
1.2 方法
1.2.1 分组及药量:120只SD大鼠随机分为对照组(control,CON)、模型组(high-fat diet,HFD)、艾塞那肽低、中、高(Exenatide Low、Middle和High Dose,ELD、EMD和EHD)剂量干预组及阳性药物多烯磷脂酰胆碱(positive drug polyene phosphatidylcholine,PDC)治疗组,造模成功后CON组不予干涉,HFD组予0.9%氯化钠注射液皮下注射,ELD、EMD和EHD组每天给予大鼠皮下注射艾塞那肽1、2和4 μg,PDC治疗组给予多烯磷脂酰胆碱46 mg。

PPARα引物:上游:5′-CTTGTGCATGGCTGAGA AGA-3′,下游:5′-AATTCCGTGAGCTCGGTGAC-3′,产物长度132 bps。
ACOX1引物:上游: 5′-GAGATGGATAACGGCT ACCT-3′,下游:5′-AATTCCGTGAGCTCGGTGAC-3′,产物长度190 bps。
β-actin引物:上游:5′-GTGACGAGGCCCAGAGC AAGAG-3′,下游:5′-ACGCAGCTCATTGTAGAAGG TGTGG-3′,产物长度123 bps。

1.3 统计学分析

2 结果
2.1 肝脏切片HE染色
CON无任何脂滴浸润现象,HFD有不同程度的细胞变性及脂肪空泡,4周时4个治疗组脂肪空泡明显减少;8周时治疗组脂肪空泡进一步减少,除ELD组外,PDC、EMD以及EHD4组看不到任何脂肪空泡(图1)。
2.2 肝功能
PDC组、ELD、EMD以及EHD组与HFD组相比,AST、ALT与CHE 治疗4周后明显升高(Plt;0.05),8周与4周趋势一致(表1)。
2.3 血脂
CHOL与TG,4周时,PDC组、ELD、EMD以及EHD组较HFD组明显降低(Plt;0.05)。8周后进一步降低(表2)。
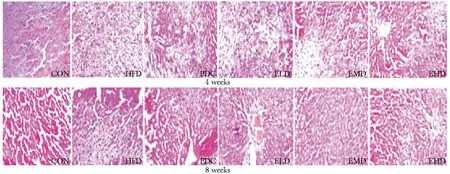
图1 肝脏切片HE染色Fig 1 HE staining of liver(×100)

表1 肝功能检查Table 1 Liver function check(±s,μmol / L, n=10)
*Plt;0.05 compared with HFD.

表2 血脂检查Table 2 Blood lipids check(±s,μmol / L, n=10)
*Plt;0.05 compared with HFD.
2.4 肝脏组织PPARα及ACOX1 mRNA表达
2.4.1 RT-PCR检测PPARαmRNA表达:PDC、ELD、EMD和EHD组与HFD组相比,4周后肝脏PPARαmRNA表达明显升高(Plt;0.05),但8周后除PDC外,ELD、EMD和EHD组没有进一步改善(图2)。
2.4.2 RT-PCR检测ACOX1 mRNA表达:PDC组、ELD、EMD和EHD组与HFD组相比,4周后肝脏ACOX1 mRNA表达明显升高(Plt;0.05)。8周时其mRNA表达进一步升高,但ELD、EMD和EHD表达均低于PDC组(图3)。
2.5Westernblot检测PPARα及ACOX1蛋白表达
2.5.1 Western blot检测PPARα蛋白表达:PDC组、ELD、EMD和EHD组与HFD组相比, 4周后肝脏PPARα蛋白表达明显升高(Plt;0.05)。8周后PDC组、ELD、EMD和EHD组PPARα的蛋白表达进一步升高(图4)。
2.5.2 Western blot检测ACOX1 蛋白表达:与HFD组相比,4周时PDC组、ELD、EMD和EHD组肝脏PPARα蛋白表达明显升高(Plt;0.05),8周PDC组、ELD、EMD和EHD组PPARα的蛋白表达进一步升高(图5)。
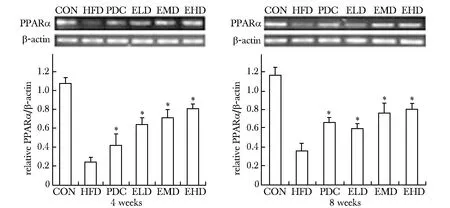
*Plt;0.05 compared with HFD图2 肝脏PPARα mRNA表达Fig 2 Liver PPARα mRNA expression

*Plt;0.05 compared with HFD图3 肝脏ACOX1 mRNA表达Fig 3 Liver ACOX1 mRNA expression
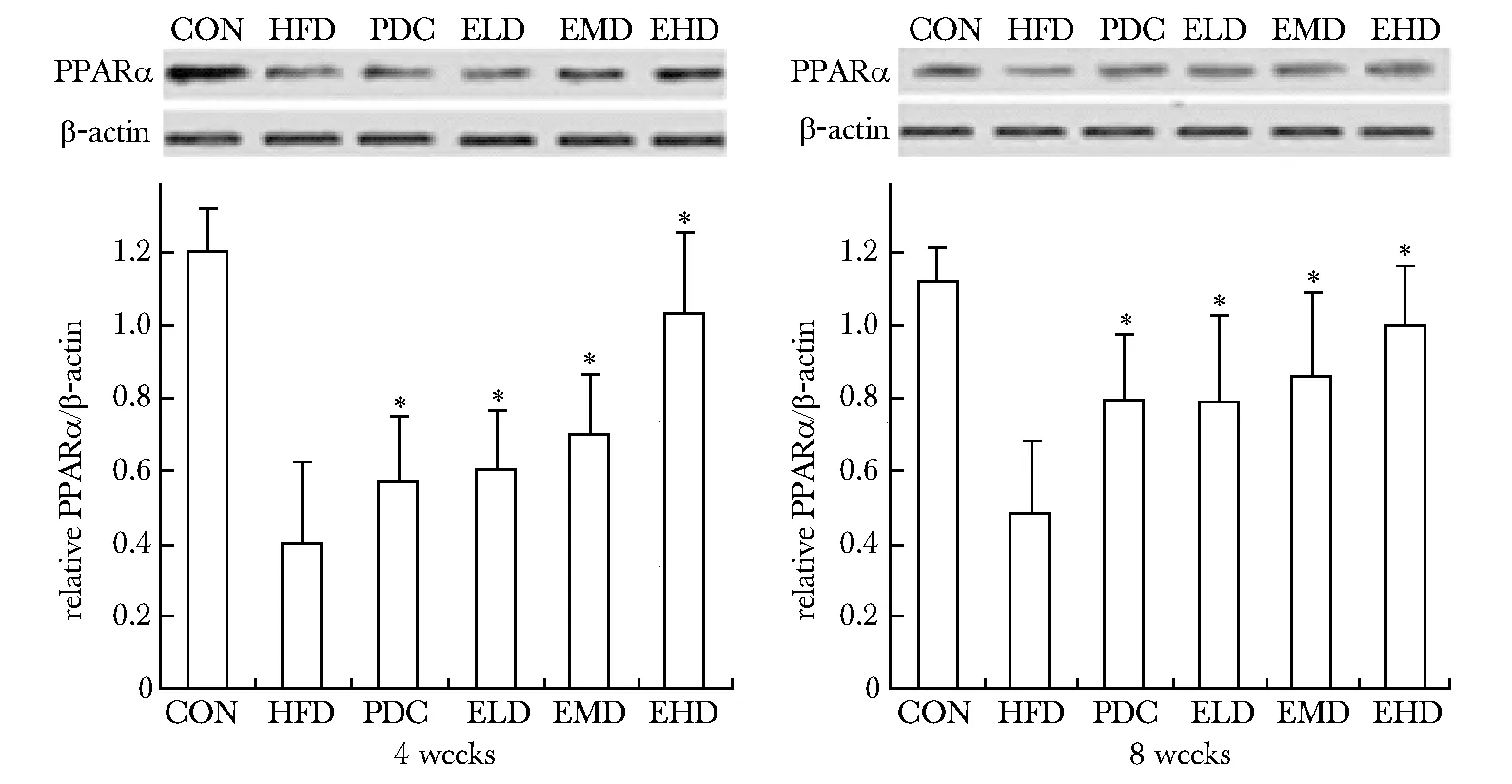
*Plt;0.05 compared with HFD图4 肝脏PPARα 蛋白表达Fig 4 Rat liver PPARα protein expression
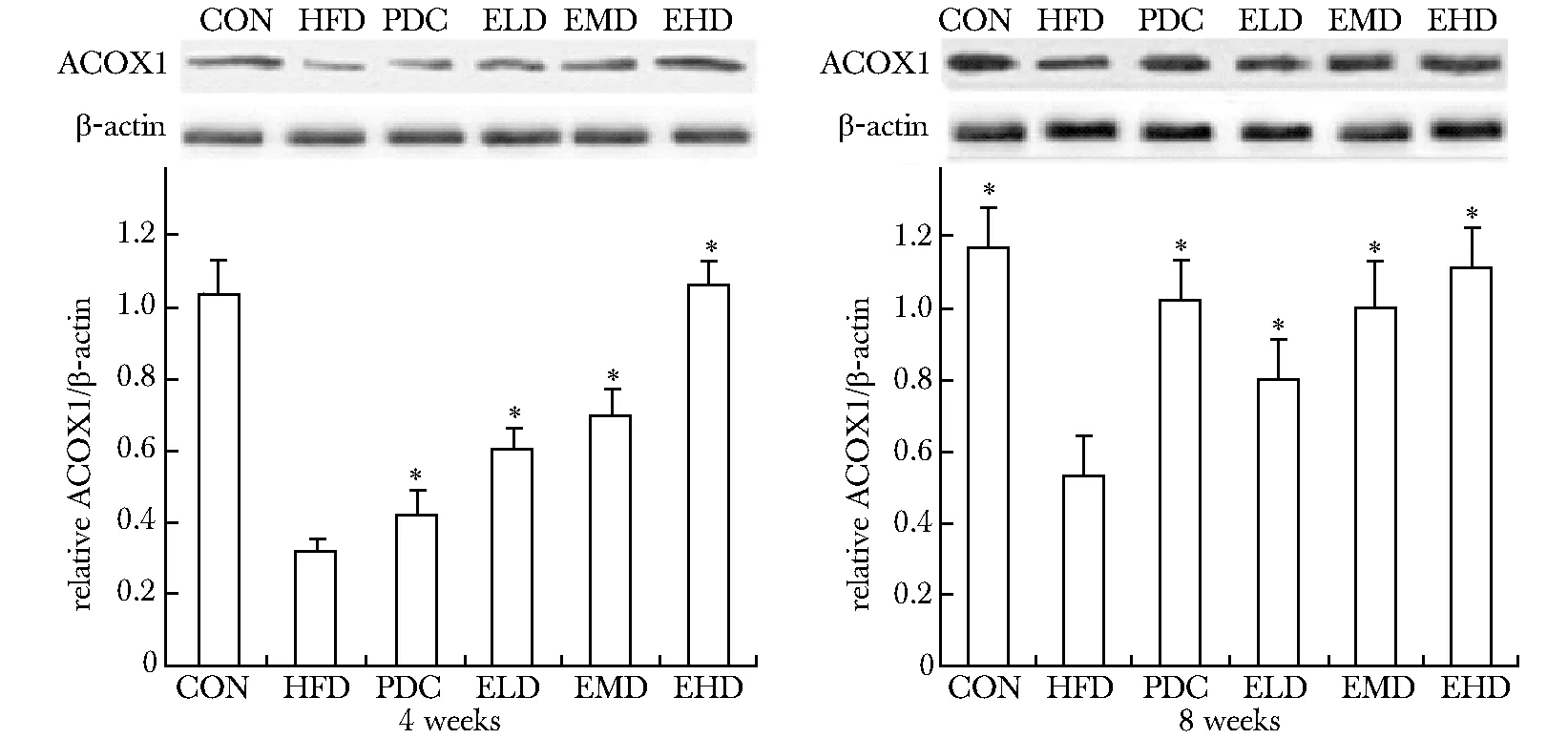
*Plt;0.05 compared with HFD图5 肝脏ACOX1 蛋白表达Fig 5 Liver ACOX1 protein expression
3 讨论
NAFLD严重威胁着人们的健康,一般而言,轻度NAFLD患者有25%左右有疲乏感,如果不加干预,任由继续发展,形成中度甚至重度NAFLD则会给患者带来肝区隐痛、全身乏力、腹泻等生活影响[5],多数学者认为NAFLD的治疗应以控制饮食,增加运动等为主,但消除或控制与NAFLD相关的因素,如糖尿病、高血脂、肥胖等的药物治疗也不容忽视[6]。
PPARα作为PPARs家族的一员,在NAFLD的发病过程中扮演着重要的角色[7],PPARα最大的功效为调节脂肪代谢,从而参与脂肪性肝病的发病[8]。ACOX1是脂肪细胞内与脂肪酸氧化相关的酶,同时也是过氧化酶体内β-氧化系统的起始酶[9]。本实验用高脂溶液灌胃SD大鼠建立NAFLD模型,艾塞那肽治疗后,肝脏HE染色EMD和EHD组肝脏切片在8周时几乎看不到任何脂肪空泡,同时艾塞那肽可明显改善大鼠PPARα 及ACOX1的mRNA和蛋白表达,PPARα 及ACOX1表达的升高促使了其血脂功能的改善,随着血清脂质代谢的好转,大鼠肝功能也发生了显著地改善。
综上所述,本研究结果提示,用高脂饮食灌胃所形成的NAFLD大鼠模型,大鼠明显具有脂代谢紊乱,肝功能异常等特征,艾塞那肽可明显且快速的调节大鼠脂质代谢,改善肝功能,有效的缓解了NAFLD相关症状,其机理可能是通过改善NAFLD大鼠PPARα及ACOX1的表达来实现的。
[1] 胡云龙, 赵彩彦, 刘晓梅. 实验性脂肪性肝病大鼠血浆内皮素与肝病理损 害的关系[J].基础医学与临床, 2005, 25:846-847.
[2] Chen QR, Braun R, Hu Y,etal. Multi-SNP analysis of GWAS data identifies pathways associated with nonalcoholic fatty liver disease[J]. PLoS One, 2013,8: e65982.doi: 10.1371/journal.
[3] Arakawa M, Ebato C, Mita T,etal. Effects of exendin-4 on glucose tolerance, insulin secretion, and beta-cell proliferation depend on treatment dose, treatment duration and meal content[J]. Biochem Biophys Res Commun, 2009, 390: 809-814.
[4] Tushuizen ME, Bunck MC, Pouwels PJ,etal. Incretin mimetics as a novel therapeutic option for hepatic steatosis[J]. Liver Int, 2006, 26: 1015-1017.
[5] Nahum Méndez-Sánchez. Non alcoholic fatty liver disease[J]. Annals of Hepatology, 2009, 8: S3.
[6] Zhang Z, Pan Q, Duan XY,etal. Establishment and identification of non-alcoholic fatty liver disease in chronic hepatitis B virus infected mice[J]. Zhonghua Gan Zang Bing Za Zhi, 2011, 19:658-663.
[7] Tailleux A, Wouters K, Staels B. Roles of PPARs in NAFLD: potential therapeutic targets[J].Biochim Biophys Acta, 2012, 1821:809-818.
[8] 王海彬, Zhang Jun-long, 王军舰,等. 基于PPARα基因为靶序列的RNA干涉作用[J]. 基础医学与临床, 2006, 26:761-765.
[9] Osumi T, Hashimoto T.Acyl-CoA oxidase of rat liver: a new enzyme for fatty acid oxidation[J].Biochem Biophys Res Commun, 1978, 83:479-485.
Exenatide treatment improves nonalcoholic fatty liver phenotype by regulation of PPARα and ACOX1
WU Jun-zi1,2, NIU Shi-wei1,2, JIA Ya-min3, TAO Wen-yan4, LIU Bo4, LI Yan2*, LI Shu-de5*
(1.Dept. of Biochemistry and Molecular Biology, Collage of Kunhua Medicine, Kunming University of Science and Technology, Kunming 650504;2.Dept. of Cadre Health Care, the First People’s Hospital of Yunnan Province, Kunming 650036; 3.Dept. of Dean’s Office,Polytechnic Institute, Taiyuan University of Technology, Taiyuan 030021; 4.Dept. of Pharmaceutical Chemistry, Collage of Pharmacy, Kunming Medical University, Kunming 650504; 5.Dept. of Biochemistry and Molecular Biology, Collage of Basic Medical, Kunming Medical University, Kunming 650504, China)
ObjectiveTo observe the exenatide effect on fat-induced nonalcoholic fatty liver disease (NAFLD) in rat.MethodsOne hundred and twenty SD rats were randomly divided into control group(CON), model group(HFD), exenatide low, medium, high dose group (ELD, EMD, EHD) and polyene phosphatidylcholine treatment group (PDC), each group was 20. After successfully established NAFLD, given appropriate treatment, half of the rats were sacrificed after 4 and 8 weeks. HE staining of liver slices, liver function test, blood lipids function, RT-PCR Western blot for PPARα and ACOX1 expression were performed.ResultsAfter 8 weeks of treatment, rat liver HE staining PDC, EMD and EHD had not any fat particles infiltration; after 4 weeks treatment, liver function AST, ALT and CHE, serum lipids CHOL and TG compared with HFD group, PDC, ELD, EMD and EHD,Plt;0.05,8 weeks further reduced; liver peroxisome proliferator-activated receptor α (PPARα) and acyl coenzyme A oxidase 1(ACOX1) expression has also undergone a significant improvement.ConclusionsExenatide improves NAFLD Phenotype by regulation of PPARα and ACOX1 expression.
exenatide, non-alcoholic fatty liver disease, peroxisome proliferator activated receptors α, acyl coenzyme a oxidase 1
2013-09-02
2013-10-25
国家自然科学基金(81360128;81360252);云南省科技厅-昆明医科大学联合专项(2011FB225);云南省应用基础研究(2013FZ052;2013FZ183)
*通信作者(correspondingauthor): liyanken@126.com; shudeli006@vip.sina.com
1001-6325(2014)04-0464-06
研究论文
R 575.5
A

