不同营养方法对胰十二指肠切除术后患者的疗效观察
刘森
(天津市第四中心医院外科,天津 300140)
在普外科疾病中胰头和胰壶腹周围癌是治疗难度大,术后患者恢复欠佳的一种常见疾病[1]。胰十二指肠切除手术是其主要治疗方法,但是由于术前患者的食欲减退,消化功能减低,恶性病的消耗,肝功能的损害及手术中复杂的消化道重建创伤较大,多种因素造成患者在围术期中营养状况及免疫功能下降使患者的并发症发生率和死亡率较高[2]。因此,如何改善患者营养及免疫状态成为研究热点问题,传统上的营养支持多为肠外营养,国外文献显示[3]术后早期应用肠内营养是安全有效的,因此本研究应用术后肠外营养和肠内营养结合的支持方法进行治疗取得很好的临床效果,现报道如下。
1 资料与方法
1.1 一般资料 收集2009 年2 月至2012 年11 月我院肝胆外科收治的胰腺恶性肿瘤患者110 例,其中男70 例,女40 例,年龄49~65 岁,平均(51.2 士2.1)岁,其中胆管中下段癌40 例、Vater 壶腹癌32 例、十二指肠乳头癌28 例、胰腺癌10 例、伴有高血压病10 例、心脏病9 例、糖尿病28 例均控制良好无手术禁忌症,排除原有免疫系统疾病及脂肪代谢异常患者,随机分为对照组60例(全肠外营养),观察组50 例(肠内营养+肠外营养),两组的年龄、性别、病变部位及术前营养指标均无显著差异,具有可比性(P >0.05)。
1.2 方法 对照组采取经中心静脉穿刺留置导管为营养入径,术后早期单纯给予肠外营养(TPN)治疗,待患者全身状态稳定、肛门有排气后采用肠内营养(EN)。观察组手术中留置空肠营养管,置于十二指肠远端,采用鼻空肠营养管输注,输注过程中采用了泵控持续滴注。对照组术后即开始经中心静脉穿刺留置导管输注静脉氨基酸、脂肪乳剂、维生素、电解质及葡萄糖等营养液,按照所需的能量需要配置,排气后给予卡文肠外营养制剂,进半流饮食后逐渐减量,本组应用肠外营养时间大约为为10 d。观察组术后先行肠外营养支持,然后联合应用含有短肽、短链脂肪酸(SCFA)的营养液进行肠内营养,患者术后3 d 先于肠内输注200 mL温水(35 ℃,15 滴/分钟),无不适后可改用肠内营养剂,营养液浓度由低到高(5%~10%),滴注速度由低增高(5~20 滴/分钟),最后根据能量要求全肠内营养。对比分析两组患者术后白蛋白、血清总蛋白、总淋巴细胞计数、三头肌皮皱厚度水平变化,及术后住院天数、术后并发症发生率比较。
1.3 统计方法 应用SPSS11.5 软件进行统计分析,计量资料以均数±标准差()表示,采用t 检验,计数资料采用χ2检验。
2 结 果
2.1 两组的年龄、性别、病变部位及术前营养指标比较,见表1。
表1 两组的年龄、性别、病变部位及术前营养指标比较()

表1 两组的年龄、性别、病变部位及术前营养指标比较()
注:两组的年龄、性别、病变部位及术前营养指标均无显著差异,具有可比性P >0.05
2.2 两组患者术后白蛋白、血清总蛋白、总淋巴细胞计数、三头肌皮皱厚度水平变化比较,见表2。
表2 两组患者术后白蛋白、血清总蛋白、总淋巴细胞计数、三头肌皮皱厚度水平变化比较()
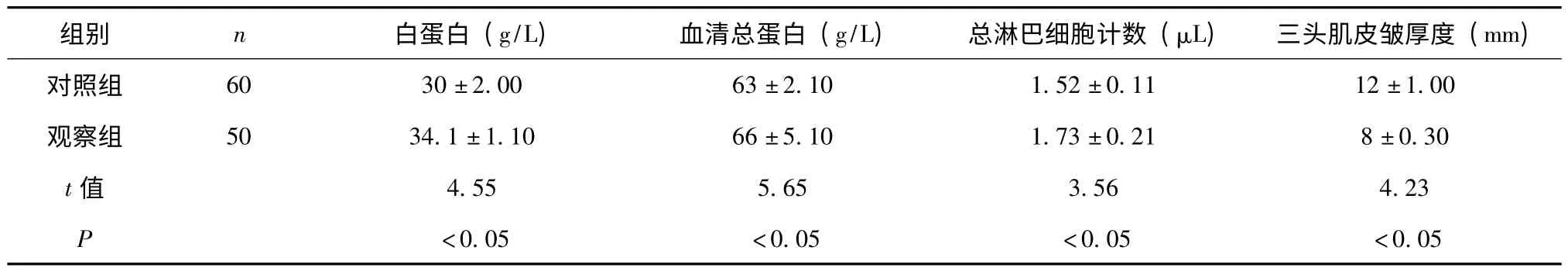
表2 两组患者术后白蛋白、血清总蛋白、总淋巴细胞计数、三头肌皮皱厚度水平变化比较()
2.3 两组患者术后住院天数、术后并发症发生率比较,见表3。
表3 两组患者术后住院天数、术后并发症发生率比较(n,%,)

表3 两组患者术后住院天数、术后并发症发生率比较(n,%,)
3 讨 论
胰头部恶性肿瘤癌是较常见的消化系肿瘤其恶性程度比较高,严重危害患者的生命,胰十二指肠切除是目前常用的手术方式[4]。由于该类患者术前常出现消化功能不良,恶性消耗及黄疸造成的消化系统功能的损害,使患者肝功能及免疫功能受损,并且胰十二指肠切除术手术复杂,消化道切除范围大,创伤重,进一步加重患者的危险及营养状况及免疫功能下降,极容易出现严重的应激反应,并发症发生率和患者的死亡[5]。那么选择一种合适的营养方式来改善病人的营养状态和提高免疫功能,降低并发症发生及死亡率,加快术后康复,是医生们关注的课题。目前消化道手术常用的是肠外营养,但是越来越多的学者认为术后早期应用肠内营养是安全有效的。因此本研究对比分析肠内外营养支方法对胰十二指肠切除术后患者营养状态和并发症发生率的影响情况。结果显示两组患者术后白蛋白、血清总蛋白、总淋巴细胞计数、三头肌皮皱厚度水平比较观察组明显优于对照组(t=4.55、5.65、3.56、4.23,P <0.05,具有显著性差异);术后住院天数、术后并发症发生率比较 (χ2=4.55、4.34,P <0.05,具有显著性差)。因此可以证实,应用肠外营养及早期肠内营养能够更好改善患者病情,能够明显减少术后并发症的发生、促进胃肠道功能的恢复。胰瘘是胰十二指肠切除术后主要的并发症,占此类手术并发症20%左右,一些学者认为肠外营养可增加胰瘘发生,但是EN +PN 营养支持可以降低PD 术后胰瘘发生率,这是由于空肠营养管于十二指肠远端,减少刺激胰液分泌[6],有防止胰瘘发生的作用,与研究相符。其次肠外营养感染发生率较高,如导管性败血症、肠源性感染等严重并发症的潜在危险。本研究方法可在一定程度上减少此类情况发生。在肝脏功能方面肠内营养可明显改善肠外营养的对肝功能的损害本研究显示未见明显肝功能损害[7]。EN+PN 营养支持不仅减少患者手术并发症的发生同时还可提高机体免疫功能促进组织愈合。报道显示,肠内营养一般可在术后不久即开始实行,早期肠内营养使小肠黏膜营养底物充足,肠黏膜屏障功能加强,避免菌群易位所引发的多脏衰[8]。所以EN+PN 营养支持在PD 术后具有其独特的优越性,术中放置空肠营养管给予肠内营养是最佳的肠内营养支持方式。但是术后应根据患者的状态,合理并早期应用肠内营养,注意腹泻、恶心、呕吐、等并发症的发生,如有上诉症状,可适当的调整营养液的输注速度、浓度和温度,减少营养液的污染等措施减少肠内营养的营养相关并发症,必要可暂时停用。
[1]黄洁夫.腹部外科学[M].北京:人民卫生出版社,2000:1512-1516.
[2]吴文川,靳大勇,秦新裕,等.胰十二指肠切除术后早期肠内营养支持[J].中国临床医学,2012,9 (2):133-134.
[3]蒋朱明,曹金铎,蔡东联,等.肠内或肠外营养对术后患者肝功能、肠通透性、血谷氨酰胺的影响及费用比较[J].中国临床营养杂志,2002,10 (1):6-9.
[4]张明,齐玉梅,许晋,等.胰十二指肠切除术后肠外营养支持[J].中国中西医结合外科杂志,2006,12 (4):346-349.
[5]刘弧光,严琦敏,牛力春,等.胰十二指肠切除术后早期肠道内营养临床应用体会[J].肝胆外科杂志,2007,15(5):372-374.
[6]Aramaki M,Matsumoto T,Etoh T,et a1.Clinical significance of combined pancreas and portal vein resection in surgery for pancreatic adenocarcinoma [J].Hepato-gastroenterology,2003,50 (49):263-266.
[7]Furukawa T,Kloppel G,Volkan Adsay N,et a1.Classification of types of intraductal papillary-mutinous neoplasm of the pancreas:a conselLsUS study [J].Vimhows ArcE,2005,447 (5):794-797.
[8]Tezel E,Kaneko T,Sugimoto H,et a1.Clinical significance of intraportal andovascular ultrasonography for the diagnosis of extrapancreatic nerve plexus S invasion by pancreatic carcinoma[J].Pancreatology,2004,4 (2):76-81.

