高效土著花生根瘤菌筛选的初步研究
刘世旺,刘建英,徐艳霞,徐君驰
(1.黄冈师范学院 生命科学学院,湖北 黄州 438000;2.黄冈市蔬菜办公室,湖北 黄州 438000)
高效土著花生根瘤菌筛选的初步研究
刘世旺1,刘建英2,徐艳霞1,徐君驰1
(1.黄冈师范学院 生命科学学院,湖北 黄州 438000;2.黄冈市蔬菜办公室,湖北 黄州 438000)
利用YMA培养基,从新鲜花生根瘤中分离得到黄冈土著花生根瘤菌6株,分别编号为HG-1、HG-2、HG-3、HG-4、HG-5、HG-6。选取黄冈地区广泛使用的3个花生品种(红花1号、红花2号、中花1号)对6个菌株进行盆栽回接实验,结果显示:接种根瘤菌的花生植株都有结瘤,所有菌株均为花生根瘤菌。通过比较根瘤数量和质量,初步筛选出与花生品种红花1号、红花2号、中花1号具有最佳共生固氮匹配关系的根瘤菌菌株分别是HG-5、HG-3、HG-2。
根瘤菌;花生;共生固氮;筛选
花生根瘤菌是与花生共生、形成根瘤并固定空气中的氮气供花生营养的一类杆状细菌。这种共生体系的固氮能力虽然很强,但也受气候、土壤类型、花生品种等多种因素的影响[1-2]。根瘤菌能最大限度发挥固氮作用的共生组合关系叫亲组合。一定自然条件下,一定区域内的花生能与该区域内的土著根瘤菌形成亲组合。筛选与当地花生品种匹配性好、固氮能力强的高效优良菌株,是提高根瘤菌应用效果的重要途径[3]。黄冈是花生种植大市,现辖7县2市1区1农场,仅红安县花生种植面积就占到了湖北省花生种植总面积的1/10[4]。为了筛选适合本地花生利用的亲组合菌株,我们选取大别山地区普遍栽种的3个花生品种作为试验材料,利用无菌接种栽培法对我们分离得到的6株土著花生根瘤菌进行了回接实验,初步筛选出了高效土著花生根瘤菌3株,为该地区进一步筛选和应用高效花生根瘤菌奠定了基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株 先分别从湖北黄冈市郊及红安、麻城、武穴等地不同类型土壤中采集花生根瘤,然后经实验室分离、纯化及生物学特征鉴定得到6个黄冈土著花生根瘤菌株,分别编号为HG-1、HG-2、HG-3、HG-4、HG-5、HG-6。
1.1.2 供试花生品种 红花1号、红花2号和中花1号,购自湖北省黄冈市种子公司,选择颗粒大小均匀、子叶饱满、种皮色泽鲜亮、无霉点的种子用于实验。
1.1.3 试剂及设备 NaCl 、KCl、CaSO4、MgSO4、Ca3(PO4)2、K2HPO4、FeSO4等均为分析纯试剂。恒温光照培养箱PYX-300G-B由韶关科力实业仪器公司生产。
1.1.4 培养基配方 牛肉膏-蛋白胨培养基和YMA培养基[5];结晶紫YMA培养基(100 mL YMA培养基中加0.1%结晶紫乙醇溶液0.1 mL);刚果红YMA培养基(100 mL YMA培养基中加0.5%刚果红液1 mL)。
1.2 方法
1.2.1 花生根瘤菌的分离纯化 用剪刀剪下采回的花生植株根瘤,用自来水清洗根瘤泥土,吸水纸吸干,用75%乙醇表面消毒1 min,0.1%升汞消毒5 min,无菌水冲洗5次,备用。将表面消毒的根瘤置于无菌培养皿中,压碎根瘤并沾取汁液,先在结晶紫YMA培养基平板上划线培养(28 ℃)。待长出菌落后,再在刚果红YMA培养基平板上划线培养,待长出菌落后挑取不吸色的单菌落再在YMA培养基平板上重复划线培养,直至分离得到圆形、表面光滑凸起、湿润黏稠、浅乳白色半透明单菌落为止。为了检验菌种纯度,可将上述纯化的菌株接种到牛肉膏-蛋白胨培养基平板上,在30 ℃下培养2~4 d,培养基上未见任何菌落即表明菌株很纯。经革兰氏染色检查为阴性杆菌后转入YMA斜面保藏备用。
1.2.2 砂培瓶的准备 选取细砂过40目筛,水洗去杂质,烘干,吸除铁屑,装入洁净干燥的口径3.7 cm、高14.2 cm、容积263 mL的玻璃质饮料瓶中,砂子装入量为瓶高的一半,瓶口用两层报纸内夹一层棉花包扎。共准备砂培瓶210个,同时准备上述砂子2袋,包扎好,165~170 ℃干热灭菌2 h后备用。
1.2.3 菌液的制备 取250 mL三角瓶6个,各装入100 mL新配制的YMA培养液,121 ℃湿热灭菌20 min,于花生播种前5 d分别向瓶内接种6种根瘤菌株,并置28 ℃摇床培养5 d。在给花生接种前,根瘤菌菌液要进行显微镜直接计数,并用无菌水将菌液中菌体浓度稀释至700~800万个/mL。
1.2.4 土壤浸出液的制备 在黄冈师范学院植物园采集土壤1 000 g,装入2 000 mL烧杯中,再向烧杯中加入自来水1 000 mL,用玻璃棒搅动,在高压灭菌锅中,120 ℃下浸提20 min,然后取上清液并用布氏漏斗过滤,滤液加水至1 000 mL,用盐酸和氢氧化钠溶液调pH为7,121 ℃湿热灭菌后冰箱冷藏备用。
1.2.5 库仑试剂的配制[6]分别取KCl 10.0 g、CaSO4·2H2O 2.5 g、MgSO4·7H2O 2.5 g、Ca3(PO4)22.5 g、FeSO42.5 g置于研钵中,研细并充分混合,称取混合物1~3 g溶于1 000 mL蒸馏水中,用盐酸和氢氧化钠溶液调pH为7,121 ℃湿热灭菌后冰箱冷藏备用。
1.2.6 花生种子的催芽 花生种子先用自来水充分洗涤,然后用25%H2O2浸泡30 min,其间可用无菌玻璃棒赶走种子表面的气泡以提高灭菌效果。将灭过菌的种子用无菌水洗涤2~3次,洗去残留的H2O2;然后把种子盛在无菌的大小合适的烧杯中,注入适量的无菌水,然后用棉花和双层报纸扎线封口,浸种24 h;将浸种后的种子置于无菌培养皿中,用无菌滤纸覆盖在培养皿上方,保持湿润,置培养箱中恒温(25 ℃)催芽4~5 d。
1.2.7 花生的播种和根瘤菌的接种 将砂培瓶分成A、B、C三组,分别对应红花1号、红花2号、中花1号等3个不同的花生品种。每组共准备70个砂培瓶,分设6个不同菌株项和1个对照项,每项重复10次。播种时,严格按实验设计要求选取健壮且萌发良好的花生种子植于砂培瓶之中央,胚根向下,每瓶1粒,其上覆盖约3 cm厚的细砂,浇入适量无菌的土壤浸出液,使砂粒全部浸湿而瓶中无积水,然后接种根瘤菌菌液1 mL。全部操作均为无菌操作。处理后的砂培瓶置25 ℃光照培养箱培养,光照时间为每天6:00~18:00。
1.2.8 花生培养和管理 花生培养的管理需每日进行并做好记录,瓶中表面砂子干燥时需在无菌条件下及时轮流浇入土壤浸出液和库仑试剂。当花生的主茎生长至瓶口或高出瓶口时,仅用棉花塞住瓶口即可。
1.2.9 数据的采集和统计 当花生生长到开花时(约50%植株开花,实际栽培43天),先用胶管把水缓缓注入瓶中,洗去沙子,再从瓶里小心地拔出花生的根和根瘤。再次将根放入清水中,可将根系中缠绕的部分解开。按不同实验处理分别统计花生结瘤特征值和营养生长特征值。
2 结果与分析
2.1 接种对红花1号花生营养生长和根瘤形成的影响
根据表1数据计算可知,培养植株茎高平均值为18.33 cm,各实验观测值围绕平均值上下波动范围<3.5%;叶片数平均值为7.29片,上下波动范围<4.3%;地上部分鲜重平均值为4.096 g,但上下波动范围较大,达14.2%。数据分析表明接种土著根瘤菌对红花1号花生主茎高度和叶片数影响较小,而对植株总生物量影响较大,植株外观上明显表现为有些实验项的植株比较纤细(如HG-4),有些实验项的植株比较粗壮(如HG-2和HG-5)。接种后,所有花生根部都结瘤(CK不结瘤),证明我们分离纯化得到的菌株确实为花生根瘤菌,但不同菌株共生结瘤能力有较大差别,其中HG-5菌株与红花1号花生共生结瘤能力最强,各结瘤指标值均优于其它菌株,其中侧根根瘤数的测定值是最少实验项(HG-6)的3.03倍,是6个菌株组平均值的1.33倍。
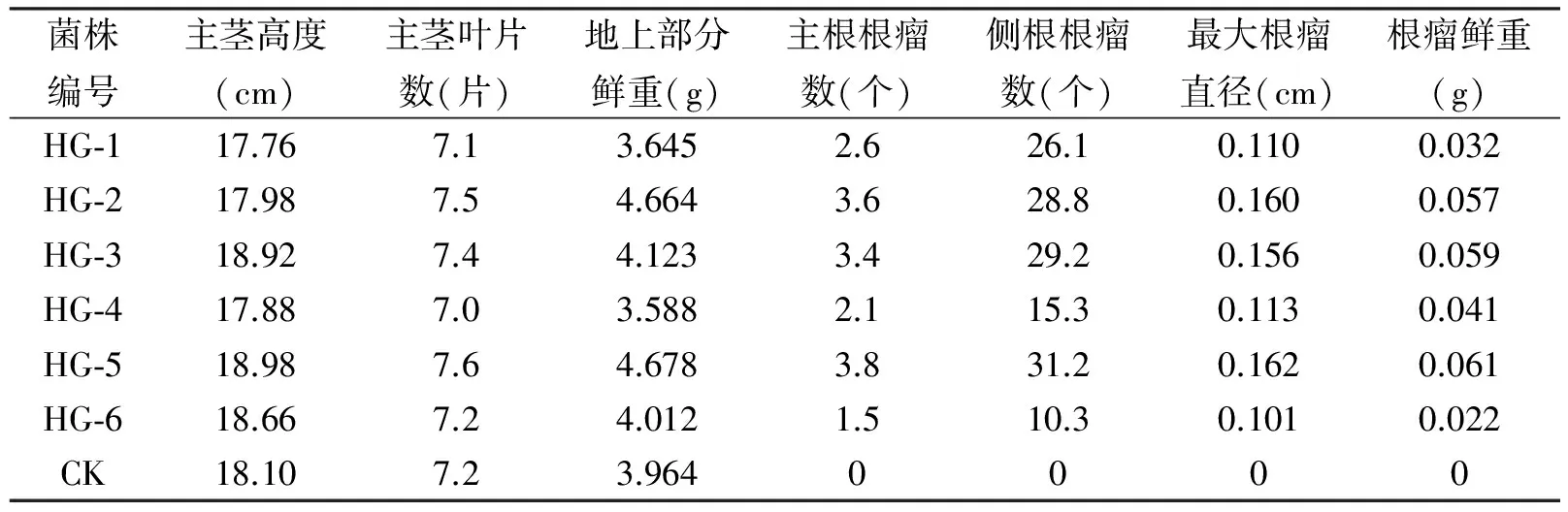
表1 接种对红花1号花生生长和结瘤的影响(株)
2.2 接种对红花2号花生营养生长和根瘤形成的影响
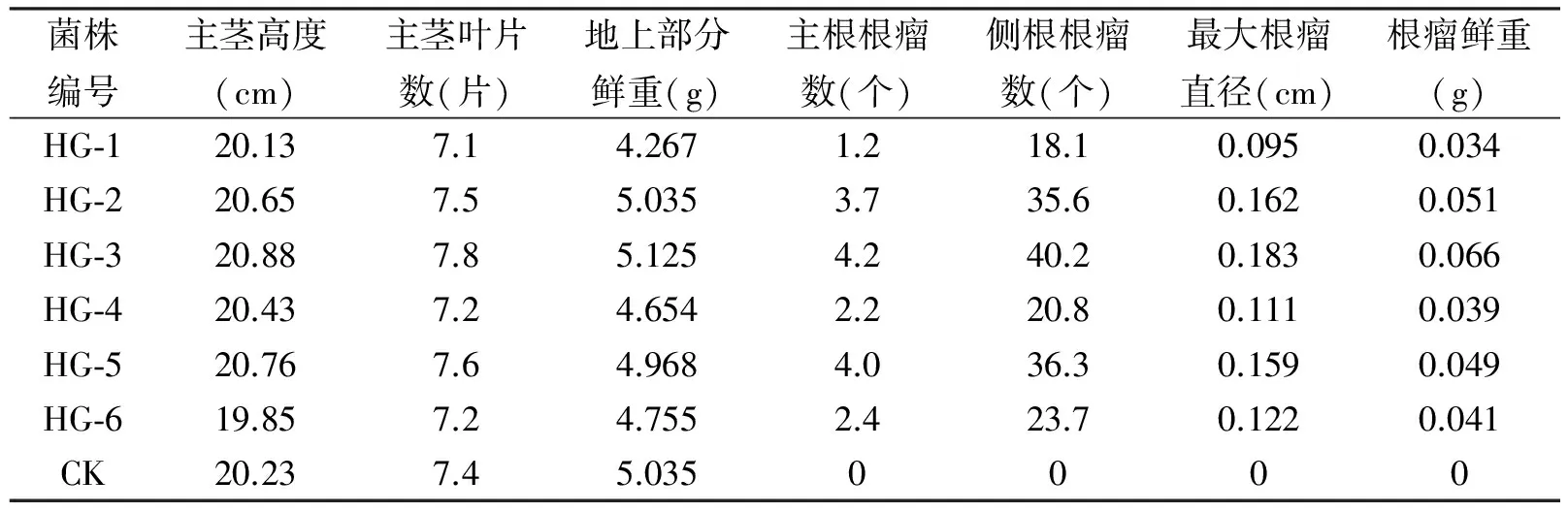
表2 接种对红花2号花生生长和结瘤的影响(株)
从表2可见,接种对红花2号花生的主茎高度和主茎叶片数影响很小,各菌株接种项与对照项之间无显著差异,实验观测值围绕平均值上下波动范围都在5%以内。对于地上部分鲜重指标,仅个别菌株实验项观测值偏离平均值较远(HG-1项比平均值低11.73%),而多数实验项的观测值波动很小,外观上植株表现为长势比较整齐。接种根瘤菌后,花生根部均有根瘤形成,但不同菌株刺激形成的根瘤数量也有较大变化,其中HG-3菌株与红花2号花生共生结瘤效果最好,其主根根瘤数、侧根根瘤数、最大根瘤直径及根瘤鲜重等四个结瘤相关观测值分别高于平均值42.37%、38.07%、31.97%和41.43%。
2.3 接种对中花1号花生营养生长和根瘤形成的影响
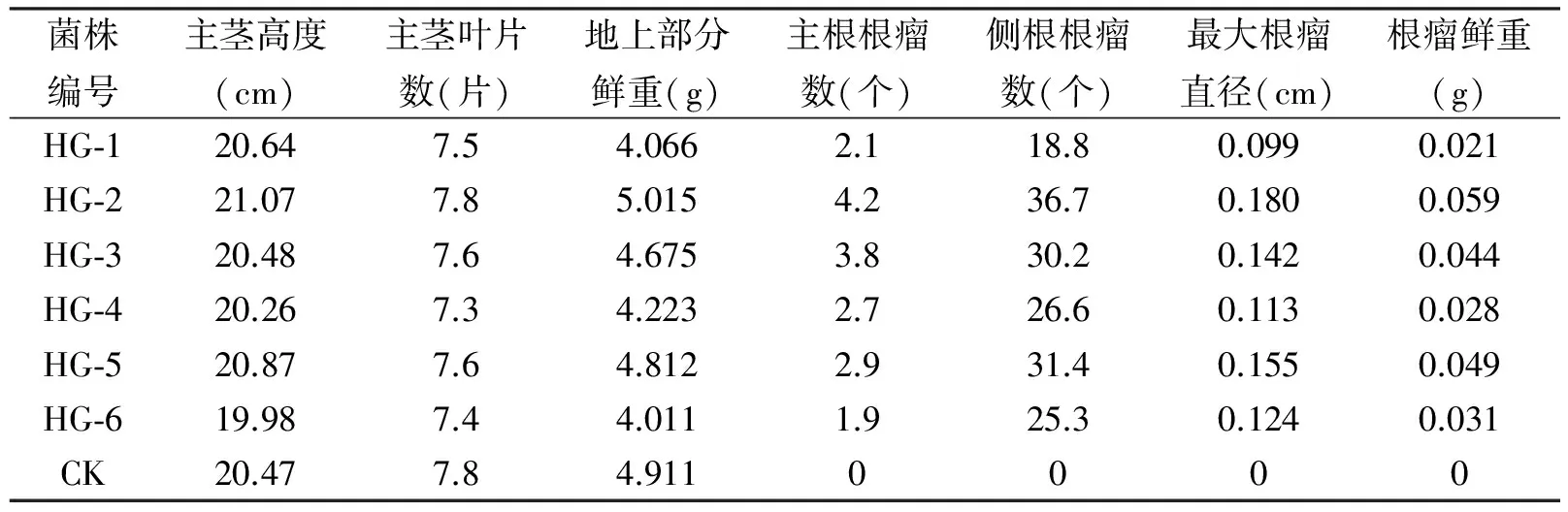
表3 接种对中花1号花生生长和结瘤的影响(株)
从表3可知,接种对中花1号花生茎高和叶片数的影响也较小,各实验组观测值围绕平均值上下波动范围<3.5%。植株地上部分鲜重值上下波动11%左右,外观上,中花1号比红花1号花生的长势要整齐一些。从结瘤情况看,HG-2菌株与中花1号共生结瘤能力最强,其主根根瘤数、侧根根瘤数、最大根瘤直径及根瘤鲜重等四个结瘤相关观测值分别高于平均值43.18%、30.30%、32.84%和52.58%。
2.4 不同花生品种对根瘤形成的影响
根瘤菌与花生之间共生固氮能力的强弱往往与回接实验时花生根部结瘤多少及质量优劣相对应。结瘤特征值通常有五项,即主根根瘤数、侧根根瘤数、最大根瘤直径、根瘤鲜重及根瘤总数。三种不同花生品种接种根瘤菌后的前4项结瘤特征值参见表1~3,第5项特征值,即根瘤总数统计如表4。由表4知,花生品种对花生根瘤总数有很大影响,表现为不同花生品种与不同菌株之间的匹配程度不同,同时还可明显看出,红花1号与HG-5、红花2号与HG-3、中花1号与HG-2之间分别具有最好的结瘤匹配性,它们两两之间共生时具有较大的结瘤固氮潜力。另外,红花2号与HG-5、HG-2之间也有较好的结瘤匹配性,根瘤总数也较多,显示出红花2号花生品种具有更好的土壤环境适应性。

表4 不同花生品种根瘤总数统计表
3 小结
花生属热带亚热带豆科植物,其根瘤正常繁殖、活动和固氮的最适温度为18~28 ℃,花生同时也是喜光的C3植物,光饱和点和CO2补偿点均较高,光合作用的最适温度为20~25 ℃。花生根瘤菌属好气异养菌,单独生长繁殖的最适温度为25~30 ℃。通过多因子比较实验,选择25 ℃、光照12 h/d的回接实验条件应是花生生长和结瘤的最适条件。
在回接实验中,所有被接种的花生植株均有根瘤形成(CK项不结瘤),这充分证明我们分离得到的6个菌株均为花生根瘤菌。
在回接实验中,红花2号花生品种不仅与HG-3菌株具有很好的结瘤匹配性,同时还与HG-2、 HG-5等具有较好的结瘤匹配性,说明红花2号品种具有较好的土壤适应性、比较适宜在黄冈地区广泛种植,这与我们早期的研究结论一致[7]。
在回接实验中,不同花生品种与不同根瘤菌株之间形成组合(共生)时,其结瘤特征值差异明显。对于匹配性好的组合,如红花1号与HG-5组合、红花2号与HG-3组合、中花1号与HG-2组合等,其结瘤特征值均明显优于其它组合。这一实验结果有力说明,在花生种植实践中筛选亲组合、推广具有亲组合关系的花生品种和高效菌肥具有重要的现实意义。
[1] 周涛,陈远学,邹依霖,等.四川高效大豆根瘤菌的筛选及初步应用研究[J].植物营养与肥料学报,2012,18(1):227-233.
[2] 罗明云.4株高效共生花生根瘤菌的筛选[J]. 西华师范大学学报(自然科学版),2003,24(4):426-430.
[3] 吴萍,何庆元,李正鹏,等.高效大豆根瘤菌筛选的初步研究[J].安徽科技学院学报,2013, 27(3):29-32.
[4] 马皓,郭爱红,冯旭东,等.红安县花生产业化发展的现状与对策[J]. 农业科技通讯,2013,(3):8-10.
[5] 何绍江,陈雯莉.微生物学实验[M].北京:中国农业出版社,2007:155-162.
[6] 土壤微生物研究会(日).土壤微生物实验法[M].北京:科学出版社,1983:329-350.
[7] 刘世旺,王宝林,陶佳喜,等.温度、光照和接种时间对花生生长和结瘤的影响[J]. 湖北农业科学,2007,46(1):49-51,67.
(李鑫)
Preliminary study on screening of efficient indigenous peanut rhizobia
LIU Shi-wang1, LIU Jian-ying2, XU Yan-xia2, XU Jun-chi1
(1.College of Life Science,Huanggang Normal University, Huangzhou 438000,Hubei, China;2.Huanggang City Vegetable Administration Office, Huangzhou 438000,Hubei, China)
6 strains of indigenous rhizobia in the area of Huanggang have been isolated from fresh peanut nodule extracts with YMA medium. They were separately named as HG-1,HG-2,HG-3,HG-4,HG-5 and HG-6. The isolated strains were inoculated back onto 3 varieties of peanut plants (Honghua-1, Honghua-2, Zhonghua-1) that are widely sowed in Huanggang. The results of the experiment in sand bottles show that all the peanut plants can nodulate after being inoculated with the strains,and all the isolated strains are peanut rhizobia. By comparing quantity and weight of nodule, it is known that the strain HG-5 symbiotic nitrogen-fixing effect matches best with the peanut plant Honghua-1. So does HG-3 with Honghua-2, and HG-2 with Zhonghua-1.
rhizobium; peanut; symbiotic nitrogen-fixing; screening
S154.39
A
1003-8078(2014)03-0019-05
2014-02-28 doi 10.3969/j.issn.1003-8078.2014.03.06
刘世旺,男,湖北武汉人,教授,硕士,研究方向为生物化学及生物资源开发利用。
徐艳霞,女,湖北武汉人,高级实验师,E-mail: swxyx@hgnu.edu.cn.
湖北省教育厅高校产学研合作资助项目(No.C2010061)资助。

