猪链球菌的分离、16SrRNA鉴定及药敏实验
傅学才
(湖南省娄底市娄星区畜牧水产技术服务中心,湖南娄底417000)
猪链球菌的分离、16SrRNA鉴定及药敏实验
傅学才
(湖南省娄底市娄星区畜牧水产技术服务中心,湖南娄底417000)
从湖南娄底某猪场病猪组织中分离出6株细菌,通过培养特性、细菌染色镜检、16sRNA基因扩增及序列BLAST分析等系统鉴定,确定为猪链球菌。并对分离菌与GenBank中收录的17株猪链球菌的16SrRNA基因序列的进行同源性比对,结果显示,6株分离菌的16SrRNA基因序列与收录菌株同源性为99%以上。药物敏感试验表明,分离细菌对头孢类、β内酰胺类药物高度敏感、对磺胺类、氨基糖苷类、喹诺酮类、四环素类药物产生耐药。而6株分离细菌对氯霉素类药物的敏感,但敏感性有差异。
猪链球菌,16SrRNA基因,药物敏感实验
猪链球菌病是一种人畜共患的急性、热性传染病,可致猪脑膜炎、关节炎、肺炎、心内膜炎、多发性浆膜炎。临床表现为急性出血性败血症、哺乳仔猪下痢和孕猪流产等,可致生猪死亡,危害较严重。据报道血清型众多,目前有35个血清型,而且变异频繁。笔者在湖南娄底某猪场剖检了疑是猪链球菌病的生猪2头,从采集的组织样中分离出6株细菌,通过细菌形态学、16SrRNA等系统鉴定,确定为猪链球菌。现将结果报告如下。
1 材料与方法
1.1 试验材料
湖南省娄底的两个猪场采集的三元仔猪2头和6份病料。鲜血琼脂、巧克力琼脂购自江门市凯林贸易有限公司。即用型PCR Mix试剂盒购自北京天恩泽基因科技有限公司,药敏纸片分别购自上杭州微生物试剂公司
1.2 细菌分离
将采集的组织病料在超净工作台内接种于鲜血琼脂培养基、巧克力琼脂培养基,于37℃培养24 h,观察细菌菌落形态特征,挑取疑是猪链球菌的菌落进行纯培养。
1.3 细菌染色镜检
挑取疑是猪链球菌纯培养菌落涂片,进行革兰氏染色、显微镜下镜检,观察细菌形态特征。
1.4 细菌PCR检测和测序
1.4.1 细菌基因组DNA的提取
用煮沸方法提取细菌DNA模板,离心过夜培养菌液,加入150μLTE缓冲液混均后,沸水中煮沸10min,冰浴后离心取上清夜做PCR反应的模板。
1.4.2 对分离菌进行PCR鉴定
按Makino S的方法设计猪链球菌16SrRNA(M23728)PCR引物。上游引物P1:
5’-ACGCGTAGGTAACCTGCCTC-3’,下游引物 P2:5’-GCCATTGTAGCACGTGTGT-3’。 扩增片段理论长度为1130bp。反应体系(50μL):10×Taq bufer 5.0μL,dNTPs(2 mmol/L)5.0μL,MgCl2(20mmol/L)3.0μL,上下游引物(20 p mol/μL)各 2.0μL,Taq DNA聚合酶(2 U/μL)1.5μL,模板2.5μL,灭菌双蒸水29.0μL。反应程序:94℃预变性 2 min;94℃ 1min,56℃ 2min,72℃ 2 min,30 个循环;72℃延伸7 min。1.0%琼脂糖凝胶电泳检测PCR产物,在凝胶成像系统下观察结果。
1.4.3 测序
PCR产物送上海生工测序,测序结果进行BLAST比对。
1.5 药敏试验
选择鉴定猪链球菌的菌株培养液涂布接种于鲜血琼脂平板,在无菌操作条件先将将药敏试纸片平贴于培养基表面,37℃培养箱培养24 h,测量其抑菌圈直径。
2 结果
2.1 细菌特性
2.1.1 从采集的病猪组织样品中分离到13株细菌,其中6株出现α溶血现象。
2.1.2 6株出现α溶血现象细菌染色镜检为呈链状排列的革兰氏阳性球菌(见图1)。
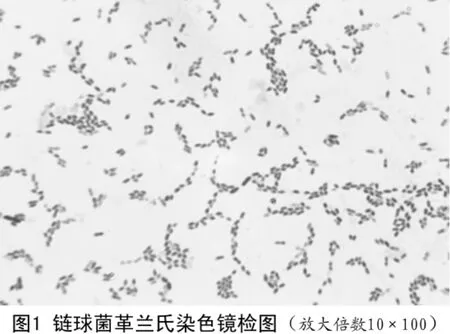
2.2 PCR鉴定
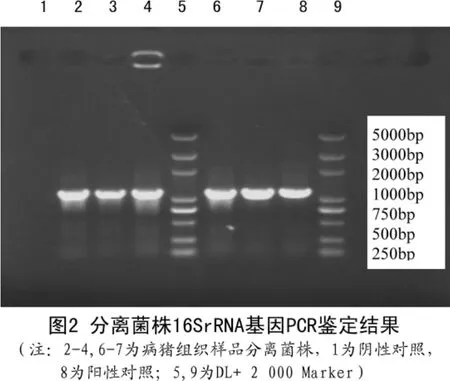
分离菌株的PCR扩增产物为1130 bp大小的片段,与预期目的片段相符(见图2)。
2.3 同源性比对
对分离菌采用16S rRNA的引物对其可变区基因进行克隆、测序和同源性比对,并用BLAST软件分析其同源性。结果表明,此6株菌株通过同源性比对,与GenBank数据库中收录的17株链球菌的16SrRNA基因序列同源性均大于99%,16SrRNA基因进行PCR扩增(图3)。


?
2.4 药敏试验
分离菌株对头孢头孢噻肟、先锋霉素、青霉素高度敏感,对复方新诺明、链霉素、强力霉素、阿奇霉素耐药,对氨苄西林、恩诺沙星、氟苯尼考的敏感性6株菌有差异。结果见表1。
2.5 疾病控制
采取栏舍彻底消毒,发病猪隔离。青霉素或头孢喹肟配合治疗,治疗期间饲料中添加一定量的复合多维和黄芪多糖,有效地控制了疫情,没有发生人的感染病例。
3 讨论
实验结果表明,在分离菌落的基础上,采用细菌16SrRNA基因可初步鉴定猪链球菌,而且可以拨开链球菌多样性的干扰,准确度高。但分型和致病性还要进行血清学分型试验和毒力测定,进一步用小白鼠实验和动物回归实验佐证。
对6株分离菌进行药敏试验,结果表明该分离菌对头孢类和β内酰胺类高度敏感,与相关文献报道猪链球菌药敏结果不一致,这可能与不同猪场药物的耐药性有关,因此,对于细菌病的治疗最好在药敏试验基础上合理用药。预防和保健时尽量少用和避免长期使用同一种药物。□
[1]陆承平.兽医微生物学(第三版)[M].北京:中国农业出版社,2001:301-307.
[2]Kaicheng Wang,Xueqiang Sun,and Cheng ping Lu.Development of Rapid Serotype-Specific PCR Assays for Eight Serotypes of Streptococcus suis[J].J Clin Microbiol.2012,50(10):3329-34.
[3]Vela AI,Goyache J,Tarradas C,et.al..Analysis of genetic diversity of Streptococcus suis clinical isolates from pigs in Spain by pulsed-field gel electrophoresis.[J].J Clin Microbiol.2003 Jun;41(6):2498-502.
[4]党京丹.细菌耐药机制研究新进展[J].临床和实验医学杂志.2009,8(9):134-135.
S858.28
A
1006-4907(2014)03-0021-02
10.3969/j.issn.1006-4907.2014.03.010
2014-05-10

