烤烟生育期相关性状的初步遗传分析
蔡长春,邓环,冯吉,程玲,余君,王欣
1湖北省烟草科学研究院,武汉 430030;
2 武汉区域气候中心,武汉 430074
烤烟生育期相关性状的初步遗传分析
蔡长春1,邓环2,冯吉1,程玲1,余君1,王欣1
1湖北省烟草科学研究院,武汉 430030;
2 武汉区域气候中心,武汉 430074
为初步掌握烤烟生育期相关性状的遗传机理,利用由开花相对稍早的品种K326和迟花品种兴烟1号杂交所得的F1植株经过组织培养和染色体加倍技术获得的双单倍体(doubled haploid,DH)群体为作图群体,以AFLP和SSR分子标记为主构建了包含23个连锁群、160个标记的烤烟遗传连锁图谱,其中包括23个AFLP标记、1个SRAP标记和136个SSR标记,图谱总长为1814.1 cM。利用复合区间作图法对烟草生育期开花时间和有效叶数进行了初步的遗传分析,结果表明,共检测到3个主效QTL位点与生育期性状相关,其中2个位点(df1和df2)与开花时间相关,分别位于第1和第11连锁群,表型变异贡献率分别为24.5%和17.3%;第3个位点与有效叶数(npl)相关,分布在第3连锁群上,表型变异贡献率为18.6%,该结果为后续利用高通量分析手段对烟草生育期性状进行精细定位奠定了基础。
烤烟,开花时间,有效叶数,遗传分析
烟草为叶用植物,它是我国云南、贵州、四川等西部省份贫困山区重要的经济作物,其开花时间和有效叶数等生育期性状对烟叶的产量和质量有较大影响[1],早花不仅导致叶片小而薄,而且有效叶数明显减少,而迟花则主要影响后期烟叶成熟采收和调制[2],对一些高海拔地区影响更显著。已有的研究表明[3-5],植物生育期性状是遗传基础较为复杂且易受环境条件影响的数量性状,影响它的环境因素主要包括温度和光照,因此,开展以开花时间和有效叶数为主要内容的烟草生育期性状遗传分析对于培育适宜生育期的烟草新品种意义重大。从1920年美国科学家Garner和Allar[6]在烟草中首次发现植物的光周期规律以来,国内外众多研究人员在拟南芥[7-11]、水稻[12-15]、油菜[16-19]、大豆[20-21]、燕麦[22]、高粱[23]和向日葵[24]等作物中广泛开展了生育期相关性状的遗传规律研究,并取得显著进展,构建了较为完整的植物开花分子控制途径[25-26]。
目前对烟草生育期的研究多集中在探讨环境因素中的温度和光照如何诱导或影响开花时间早晚和叶数多少等问题上[27],而对于其分子遗传机理研究尚未见诸报道。本研究基于烤烟品种K326/兴烟1号组合的DH群体和遗传连锁图谱对生育期性状开花时间和有效叶数进行了初步的遗传分析,旨在为与烟草生育期性状相关基因的定位和克隆打下基础。
1 材料与方法
1.1 研究材料
亲本材料K326(P1)和兴烟1号(P2)分别为开花稍早、叶数较少和开花较迟、叶数较多的优质烤烟品种,分别由湖北省烟草科学研究院和贵州省烟草科学研究院提供。2009年7月在湖北省恩施烟草基地配制F1(P1×P2)代,2010年7月中下旬在湖北省烟草科学研究院经组织培养及染色体加倍技术获得DH群体,共计112个DH系用于本试验分析,2011和2012连续两年种植在湖北省恩施烟草基地以取样和调查生育期性状。
1.2 田间试验设计
每个材料(亲本和DH系)均设3次重复,完全随机区组,每重复种30株,株距和行距按优质烟叶生产要求执行(分别为55 cm和120 cm),设保护行,按优质烟叶生产规范管理。
1.3 性状调查
1.3.1 开花时间
从烟苗移栽到DH系或亲本有50%的植株开花的时间长度为开花期(df)。
1.3.2 有效叶数
打顶后烟株可收获的有效叶片数(npl)[28]。
1.4 DNA提取
亲本K326、兴烟1号和DH群体均于壮苗期选鲜嫩叶片取样,采用李佳等[29]提出的方法提取总DNA。
1.5 标记分析
1.5.1 AFLP分析
由于烟草遗传背景比较狭窄,不同烟草类型间亲缘关系较近,因此,将本实验室2009年构建白肋烟遗传连锁图谱[30]的112个AFLP标记用于多态性引物筛选。AFLP标记试验操作程序参照文献[31]进行。
1.5.2 SRAP分析
选取本实验室2009年用于白肋烟遗传连锁图谱构建[30]的6个SRAP标记直接在双亲中进行多态性筛选,PCR反应体系完全参照文献[30]。
1.5.3 SSR分析
从Bindler等[32]发表的文章中公布的SSR标记中挑选了332个SSR标记(PT开头)用于本研究,另外, 279个TM开头的SSR标记由云南省烟草农业科学研究院提供[33],表1列出来代表性的SSR标记序列,PCR反应体系和程序完全参照文柯等[34]的方法进行。

表1 部分SSR标记序列信息Tab.1 Sequence information of partial SSR markers
以上3种分子标记序列合成均由上海生物工程技术服务有限公司完成,均采用PTC-225型热循环仪(MJR,美国)进行PCR扩增,采用浓度为6%~7%的PAGE(聚丙烯酰胺)凝胶电泳分离选择性扩增产物,仪器型号:Sequi-Gen®sequencing cell (Bio-Rad,USA),缓冲液:0.5×TBE。用恒定功率85 W电泳1.0~1.5 h,电泳后的染色与显影等操作完全参照陆光远等[31]的方法。
1.6 分子数据统计和QTL命名
显性标记根据有无带分别以1和0统计;共显性标记凡与亲本P1相同统计为A,与亲本P2相同统计为B,缺失带统计为“-”。以性状(如开花时间为df,有效叶数为npl)+序号(相同性状按1,2,3…依次编写)命名所获得的QTL。
1.7 烤烟遗传图谱的建立
利用构图软件Mapmaker V3.0[35]构建图谱,(LOD>3.0),为图谱美观,使用专业绘图软件MapDraw Ver 2.1[36]绘制遗传图谱。
1.8 QTL分析
采用定位软件WinQTLCart2.5[37]进行遗传分析,选模式6,窗口大小设置为10 cM,背景标记数量5个,QTL阈值为LOD>2.5。以DH系两年性状均值为表型值,根据运行结果计算出每个QTL对表型的贡献率和加性效应等。
2 结果与分析
2.1 标记统计
有112对AFLP引物在双亲间进行多态性筛选,检测到标记30个,多态性比例为26.78%;筛选SRAP引物6对,检测到4个稳定标记,多态性比例为66.67%;筛选SSR-PT和SSR-TM系列引物分别为332和279对,分别检测到72和70个标记,多态性比例分别为21.69%和25.09%。以χ2测试来检验标记分离情况,检测到15个偏分离标记(p<0.01),比例为8.52%(表2)。
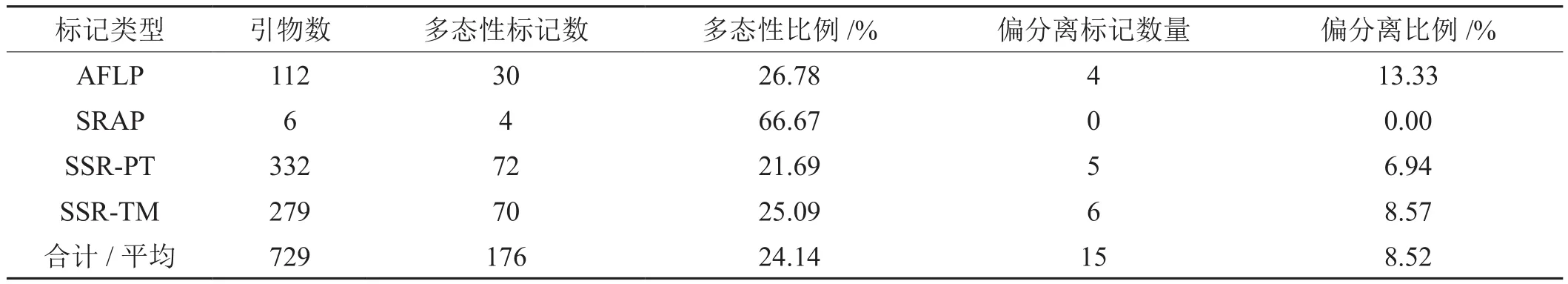
表2 构建遗传连锁图谱的分子标记分析Tab.2 Analysis of molecular markers composing genetic linkage map
2.2 遗传连锁图谱构建
利用筛选获得的176个分子标记来构建烤烟遗传连锁图谱,其中160个标记能连上图谱,16个标记未能上图,共23个连锁群,总遗传距离为1814.1 cM,连锁群的遗传距离从最短16.9 cM到最长192.8 cM,标记间的平均距离为11.3 cM,标记数量在连锁群上分布不均匀(2个到20个),在3个连锁群(LG1、LG4和LG11)集中了主要偏分离标记(表3)。3个代表性引物在DH群体中的扩增电泳图见图1。
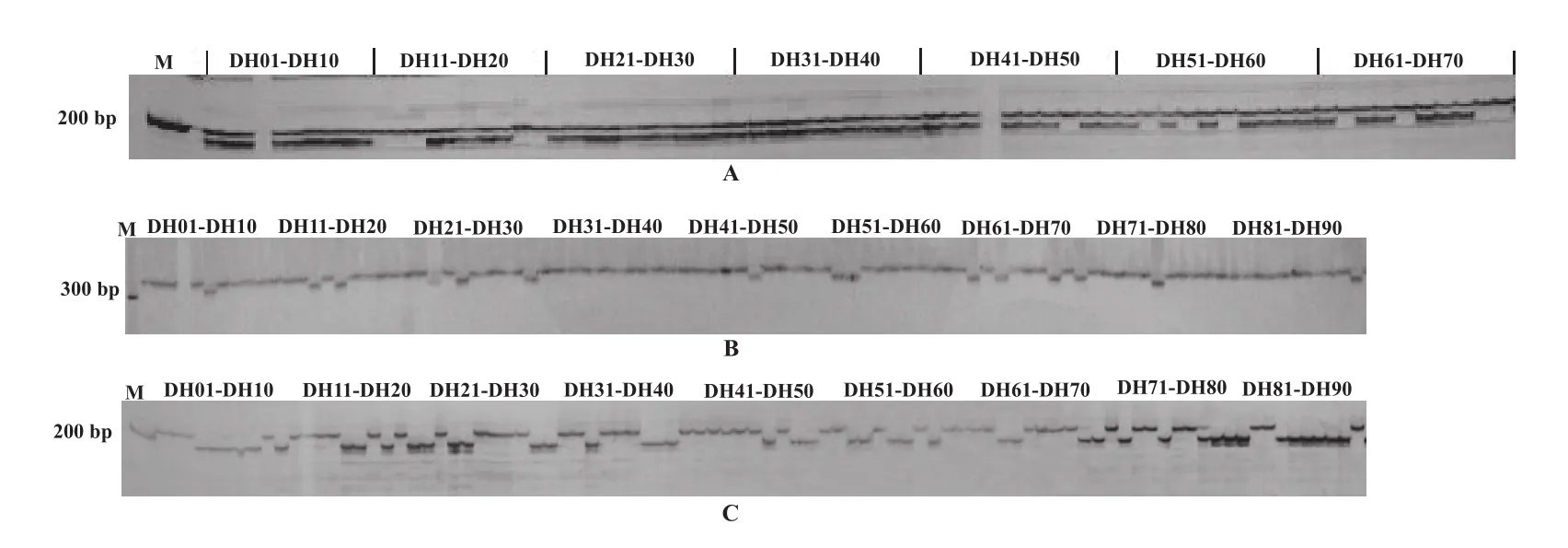
图1 AFLP引物S2M15(A)、SSR引物PT50298(B)和SRAP引物ME19EM10b(C)在DH群体中的扩增电泳图Fig.1 Amplification electropherogram of primer S2M15(A),PT50298(B) and ME19EM10b(C) in DH groups
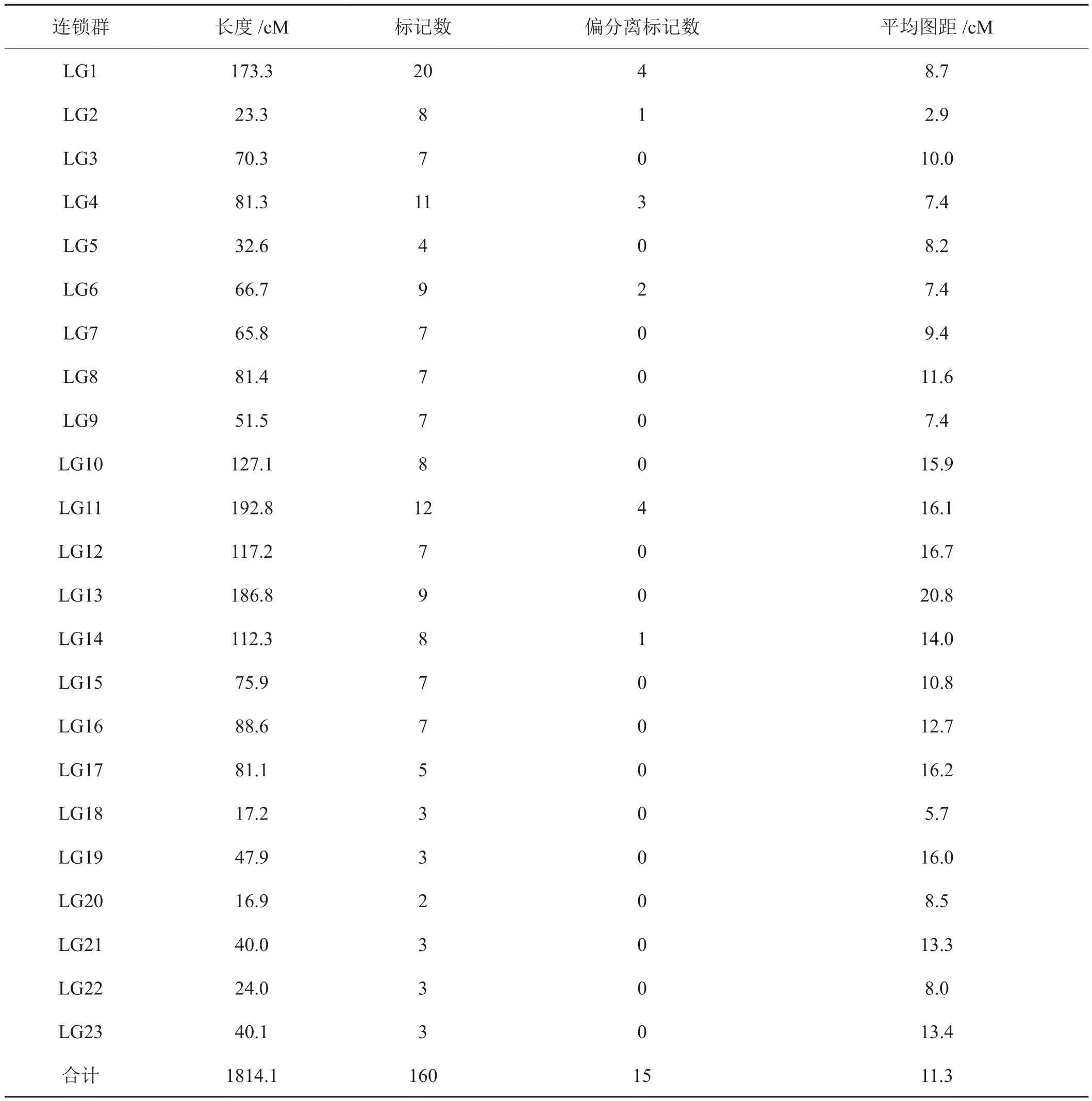
表3 连锁群上遗传距离和标记分布Tab.3 Genetic distance and marker distribution in linkage group
2.3 生育期性状的QTL分析
2.3.1 亲本和DH群体的性状表现
LSD(least significance difference,最小显著差数法)检测表明:双亲在开花时间和有效叶数上均存在显著差异(P<0.05),DH群体中各DH系在这两个性状上存在极显著差异(P<0.01)(方差分析略)。双向超亲现象一定程度存在,且两个性状均符合正态分布特征,说明这些性状具备数量性状的特征(表4)。

表4 亲本和DH群体部分性状描述性统计Tab.4 Descriptive statistics of partial traits of parents and DH group day
2.3.2 生育期性状的 QTL定位分析
应用数量性状定位分析软件Windows QTL Cartographer V2.5[37]对烤烟生育期性状进行了QTL分析,并确定LOD值>2.5作为确定某一点存在QTL的阈值。共检测到3个主效QTL位点与生育期性状显著相关,涉及3个连锁群(LG1、LG4和LG11)(图2)。与开花时间相关的两个QTL位点(df1和df2)分别位于LG1和LG11连锁群上,加性效应分别为6.7%和-2.3%,使得开花时间分别延长6.7天和减少2.3天,贡献亲本分别为兴烟1号和K326,贡献率分别为24.5%和17.3%;与有效叶数相关的QTL位点(npl)位于LG4连锁群上,加性效应为3.2%,使得开花时间延长3.2天,贡献亲本为兴烟1号,贡献率为18.6%,这3个位点均为主效QTL位点(表5)。
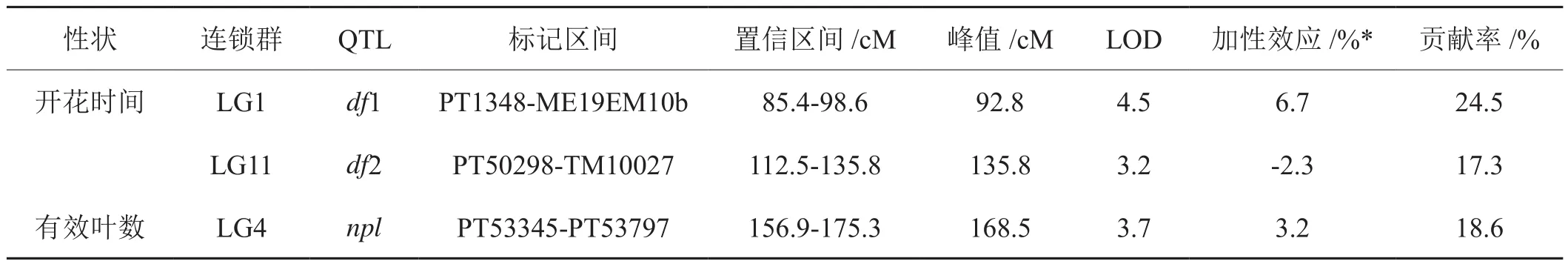
表5 烤烟生育期性状的QTL分析Tab.5 QTL analysis of growth period traits of flue-cured tobacco
3 讨论
本研究利用永久性分离的DH群体并借助AFLP、SRAP和SSR分子标记构建了一张烤烟分子遗传连锁图谱,其中72个SSR标记来自于Bindler等[32]2011年发表的烤烟遗传图谱,初步的共线性比较发现,仅有少量SSR标记存在共线性,其原因可能是亲本、群体类型、规模大小、作图方法、标记数量等有存在较大差异。
作为细胞遗传学模式植物的烟草其分子生物学方面的基础研究十分薄弱,加之其基因组规模是人类基因组的1.5倍[38],而且烟草进化历史较短,遗传背景狭窄导致,常规标记多态性较差,因此,目前见诸报道的烟草分子遗传图谱数量较少,其中以Bindler等[32]2011年构建的高密度烟草遗传图谱质量最好,包含有2363个SSR标记,24个连锁群,全长3270 cM,标记平均间距为1.41 cM。目前国内外一些研究机构和烟草企业正对野生烟草和栽培种烟草正在进行全基因组测序,随着测序的陆续完成和序列的公布[39],将极大的推动烟草以基因组学为核心的各种组学研究,今后以SNP标记为主的超高密度遗传图谱也将会产生,在这之前,可以利用公共数据库中公布的烟草和其他茄科植物的EST序列来设计引物增加图谱标记数量。

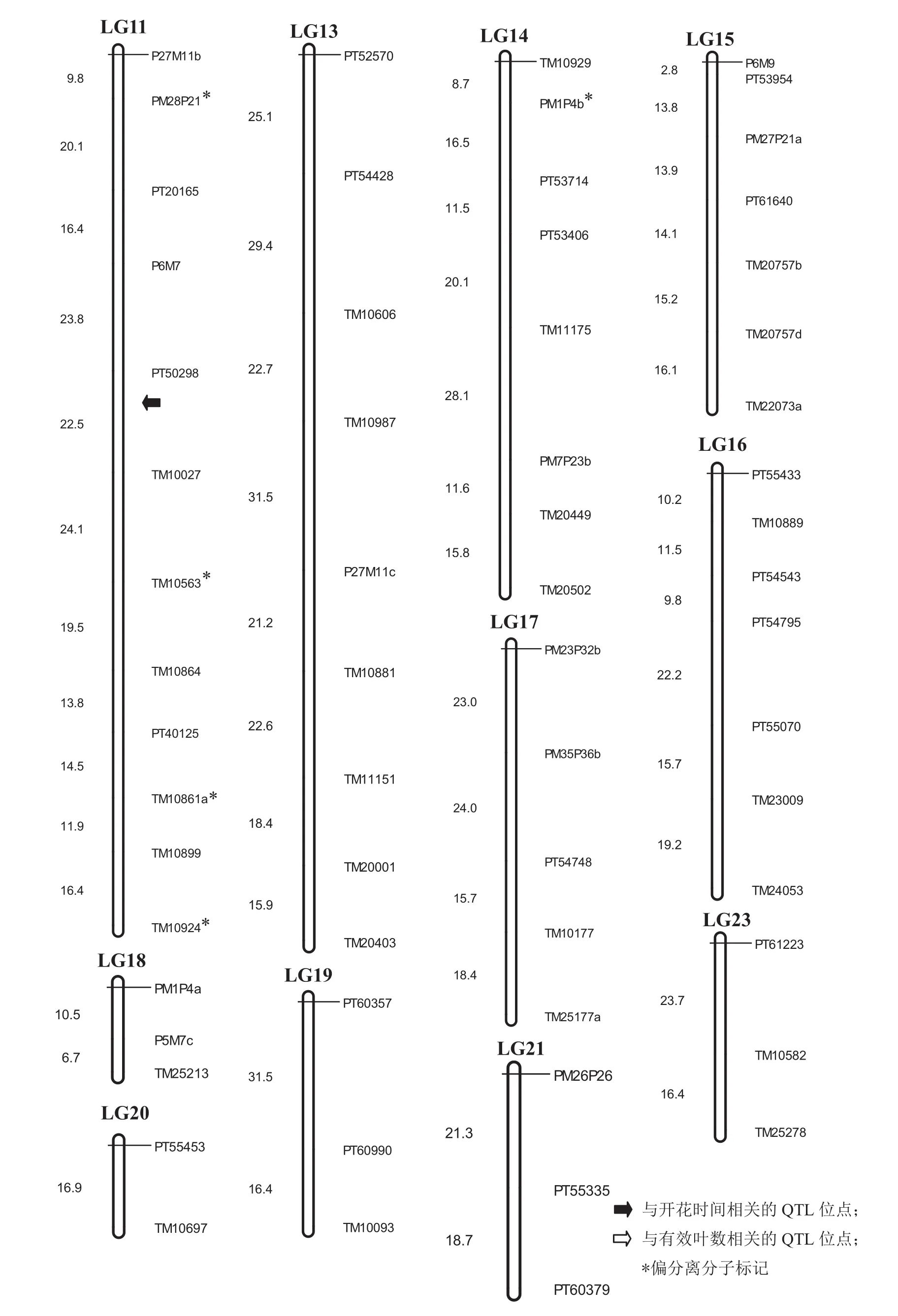
图2 烤烟分子遗传连锁图谱及生育期性状QTL位点Fig.2 QTLs for genetic linkage map and growth period traits
关于烟草生育期相关性状(主要是开花时间和有效叶数)的研究尚未见报道,本研究首次尝试利用烤烟DH群体定位了3个与此相关的主效QTL位点,其中2个与开花时间有关,一个与有效叶数有关,对表型变异的贡献率均在20%左右,其中位点df1与SSR标记PT1348的遗传距离为1.35 cM,虽然相对于巨大的烟草基因组而言,标记与目标基因距离较远,但仍然为未来精细定位奠定了良好基础。2010年我国启动了烟草基因计划,目前已完成两个野生种和栽培种的全基因组测序(尚未发表),作为可共享全部数据的参与单位,将为本研究的深入开展产生极大的促进作用,下一步研究计划将开展该DH群体的重测序或SNP芯片工作,开发大量SNP分子标记,与现有常规分子标记进行整合,基于本研究图谱新构建一张高密度的烤烟分子遗传图谱,将开展生育期性状的精细定位,为最终克隆相关基因奠定良好基础。另外,由于众多国内外研究人员在植物开花时间和光周期方面取得了显著的进展和成绩,克隆了一系列关键基因,比如拟南芥中的CONSTANS[7]、FLC[10]、FT[11]、水稻中的Hd1[13]等,下一步也将尝试通过同源克隆的方法获得烟草中的开花同源基因,这将为快速获取烟草生育期相关基因开展分子标记辅助选择筛选合适生育期的新品种奠定良好基础。
[1]贺智谋,刘信团,卢瑞杰,等.赣南烟区不同移栽期对烟叶生长状况及产质量的影响[J].安徽农业科学,2013,41 (1):63-64,67.
[2]周明昆,李国灿,张成稳,等.气候条件对大理州烤烟产量和质量的影响[J].安徽农业科学,2012,40 (6):3470-3473.
[3] Detjen L R.A preliminary report on cabbage breeding[J].Proc Am Soc Hort Sci,1926,23: 325-332.
[4] Dickson M H.Eight newly described genes in broccoli[J].Proc Am Soc Hort Sci,1968,93: 356.
[5] Baurle I,Dean C.The timing of developmental transitions in plants[J].Cell,2006,125:655-664.
[6] Garner W W,Allard H A.Effect of the relative length of day and night and other factors of the environment on growth and reproduction in plants[J].J Agric Res,1920,18: 553-606.
[7] Putterill L,Robson F,Lee K,Simon R.The CONSTANS gene of Arabidopsis promotes flowering and encodes a protein showing similarities to zinc finger transcription factors[J].Cell,1995,80: 847-857.
[8] Searle I,He Y,Turck F,Vincent C,et al.The transcription factor FLC confers a flowering response to vernalization by repressing meristem competence and systemic signaling in Arabidopsis[J].Genes Dev,2006,20:898-912.
[9] Levy Y Y,Mesnage S,Mylne JS,et al.Multiple roles of Arabidopsis VRN1 in vernalization and flowering time control[J].Science,2002,297 (5579): 243-246.
[10]Yan Z Q,Liang D W,Liu H,et al.FLC: A key regulator of flowering time in Arabidopsis.Russian Journal of Plant Physiology[J],2010,57 (2): 166-174.
[11]Corbesier L,Vincent C,Jang S,et al.FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis[J].Science,2007,316: 1030-1033.
[12]Takahashi Y,Shomura A,Sasaki T,et al.Hd6,a rice quantitative trait locus involved in photoperiod sensitivity,encodes the a subunit of protein kinase CK2[J].Proc Natl Acad Sci USA,2001,98: 7922-7927.
[13]Yano M,Katayose Y,Ashikari M,et al.Hd1,a major photoperiod sensitivity quantitative trait locus in rice,is closely related to the Arabidopsis flowering time gene CONSTANS[J].Plant Cell,2000,12,2473-2484.
[14]Yan W H,Wang P,Chen H X,et al.A major QTL,Ghd8,plays pleiotropic roles in regulating grain productivity,plant height,and heading date in rice[J].Molecular plant,2010,12: 1-12.
[15]Wu C Y,You C J,Li C S,et al.RID1,encoding a Cys2/His2-type zinc finger transcription factor,acts as a master switch from vegetative to floral development in rice[J].Proc Natl Acad Sci USA,2008,105 (35): 12915-12920.
[16]Cai C C,Tu J X,Fu T D,et al.The genetic basis of flowering time and photoperiod sensitivity in rapeseed Brassica napus L[J].Russian Journa of Genetics,2008,44(3): 326-333.
[17]Long Y,Shi J,Qiu D,et al.Flowering time QTL analysis with multi-environments in oilseed Brassica and genomewide alignment with Arabidopsis[J].Genetics,2007,177,2433-2444.
[18]Zhao J Y,Becker H C,Ding HD,et al.QTL of three important agronomic traits and their interactions with environment in a European × Chinese Rapeseed population[J]. Acta Genet Sini,2005b,32: 969-978.
[19]Osborn T C,Lukens L.The molecular genetic basis of flowering time variation in Brassica species.In: Nagata T,Lorz H,Widholm JM eds.Biotechnology in Agriculture and Forestry.In: Nagata T,Tabata S eds.Brassicas and Legumes: from Gene Structure to Breeding[M].Berlin:Springer-Verlag,2003,52: 69-86.
[20]杨志攀,周新安.大豆光周期遗传育种研究进展[J].中国油料作物学报,1999,21:67-73.
[21]Tasma I M,Lorenzen L L,Green D E,et al.Mapping genetic loci for flowering time,maturity and photoperiod insenstivity in soybean[J].Molecular Breed,2001,8: 25-35.
[22]Holland J B,Portyanko V A,Hoffman D L,et al.Genomic regions controlling vernalization and photoperiod responses in oat[J].Theor Appl Genet,2002,105: 113-126.
[23]Craufurd P Q,Mahalakshmi V,Bidinger F R,et al.Adaptation of sorghum: characterization of genotypic flowering responses to temperature and photoperiod[J].Theor Appl Genet,1999,99: 900-911.
[][]
[24]Leon A J,Lee M,Andrade FH.Quantitative trait loci for growing degree days to flowering and photoperiod response in sunflower (Helianthus annuus L.) [J].Theor Appl Genet,2001,102: 497-503.
[25]Aidyn M,Frederic C,George C.Control of flowering time:interacting pathways as a basis for diversity[J].The Plant Cell,Supplement,2002,S111-130.
[26]Putterill J,Laurie R,Macknight R.It’s time to flower: the genetic control of flowering time[J].BioEssays,2004,26:363-373.
[27]岳彩鹏,韩锦峰,陈卫华.烟草开花研究进展[J].烟草科技,2001,9: 36-40.
[28]王志德,牟建民,刘艳华,等.烟草种质资源描述规范和数据标准[M].中国农业出版社,2006.
[29]李佳,沈斌章,韩继祥,等.一种有效提取油菜叶片总DNA的方法[J].华中农业大学学报,1994,13 (5):521-523.
[30]蔡长春,柴利广,王毅,等.白肋烟分子标记遗传图谱的构建及部分性状的遗传剖析[J].作物学报,2009,35(9):1646-1654.
[31]陆光远,杨光圣,傅廷栋.甘蓝型油菜显性细胞核雄性不育基因和抑制基因的分子标记及其应用[D].博士学位论文,武汉:华中农业大学图书馆,2003:38-40.
[32]Bindler G,Plieske J,Bakaher N,et al.A high density genetic map of tobacco (Nicotiana tabacum L.) obtained from large scale microsatellite marker development [J].Theor Appl Genet,2011,123: 219-230.
[33]Tong Z J,Yang Z M,Chen X J,et al.Large-scale development of microsatellite markers in Nicotiana tabacum and construction of a genetic map of flue-cured tobacco [J].Plant Breeding,2012,131: 674-680.
[34]文 轲,张志明,任民,等.烤烟 CMV 抗性基因QTL定位[J].中国烟草科学,2013,34 (3): 55-59.
[35]Lander E S,Botstein D.Mapping mendelian factors underlying quantitative traits using RFLP linkage maps[J].Genetics,1989,121: 185-199.
[36]刘仁虎,孟金陵.MapDraw,在Excel中绘制遗传连锁图的宏[J].遗传,2003,25 (3): 317-321.
[37]Zeng Z B.Precision mapping of quantitative trait loci[J].Genetics,1993,136: 1457-1468.
[38]Galbraith D W,Harkins K R,Maddox J M,et al.Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J].Science 20: 1049-1051.
[39]Suerro N,Battey J N,Ouadi S,et al.Reference genomes and transcriptomes of Nicotiana sylvestris and Nicotiana tomentosiformis[J].Genome Biology,2013,14(6): R60.
Preliminary genetic analysis of relevant traits in flue-cured tobacco at growth and development period
CAI Changchun1,DENG Huan2,FENG Ji1,CHENG Ling1,YU Jun1,WANG Xin1
1 Hubei Academy of Tobacco Science and Research,Wuhan 430030,China;
2 Wuhan Regional Climate Center,Wuhan 430074,China
A genetic linkage map was built based on one DH population derived from one F1 in order to understand genetic control of growth period traits including days to flower (df) and number of productive leaves (npl) in flue-cured tobacco.The F1 was obtained by crossing early-flowering cultivar K326 with late-flowering cultivar Xingyan No.1.The map was composed of 23 AFLP,one SRAP and 136 SSR molecular markers assembled into 23 linkage groups (LG1 – LG23) with a total genetic distance of 1814.1 cM.Composite interval mapping (CIM) was used to detect QTLs involved in df and npl.Results showed that a total of three main-effect QTLs were detected,of which two (df1 in LG1 anddf2 in LG11) were related to df and one (nplin LG3) tonpl.Df1 anddf2 accounted for 24.5% and 17.3% of phenotypic variation of df,respectively.Npl accounted for 18.6% of npl variation.The primary conclusion can provide good reference for further study in mapping growth period traits in tobacco by using high-throughput technology.
flue-cured tobacco; days to flower; number of productive leaves; genetic analysis
10.3969/j.issn.1004-5708.2014.06.011
S572.03 文献标识码:A 文章编号:1004-5708(2014)06-0070-08
湖北省烟草公司重点科技项目“白肋烟烟碱转化性状的关联分析”[合同号:027Y2013-014]
蔡长春(1974—),博士,副研究员,主要从事烟草遗传育种和分子生物学研究。E-mail:ccchun88@sohu.com
邓环(1980—),硕士,工程师,主要从事农业气象因素对农作物影响研究等。E-mail:373709032@qq.com
2013-11-12

