中晚期肝癌患者外周血淋巴细胞亚群的研究
廖 媛 陈亚琼
中山大学附属第三医院检验科,广东广州 510630
肝细胞肝癌(Hepatocellular Carcinoma,简称肝癌或 HCC)占原发性肝癌的90%以上,其发病率和死亡率在全球范围内分别位列第6位和第3位[1]。我国是肝癌的高发区,发病人数约占全球的54%[2]。由于肝癌的自然病程较长、起病隐匿,超过80%的肝癌在就诊时已属于中晚期,无法进行根治性切除手术,疗效欠佳、预后差[3-4]。机体免疫状态对肝癌的疗效和预后有重要影响[5]。正常情况下,机体的免疫监控机制可消灭绝大多数异常的细胞。但极少数恶性细胞不仅在发生的过程中获得了免疫逃逸的能力形成肿瘤,后者更可以在发展的过程中,通过多种手段来调控机体的免疫应答来帮助自身的进展和转移[6]。淋巴细胞是免疫系统的重要组成成分,在肿瘤发生发展中起到重要作用[7]。在肿瘤微环境中,既存在杀伤型免疫细胞,如NK细胞、CTL细胞等,它们能直接或通过分泌细胞因子杀伤肿瘤细胞,抑制肿瘤生长;也存在某些调节性或抑制型免疫细胞,如Treg细胞等,它们非但不能清除肿瘤,反而在肿瘤的发生发展过程中抑制其他效应细胞的抗肿瘤作用。该文采用流式细胞术对69例中晚期肝癌患者外周血各淋巴细胞亚群进行对比性研究,旨在探讨中晚期肝癌患者细胞免疫功能的变化及意义。报道如下。
1 材料与方法
1.1 实验对象、样本采集和处理
肝癌患者外周血由中山大学肿瘤防治中心肝胆外科提供。实验符合赫尔辛基宣言(The Declaration of Helsinki)的相关规定,所有患者均已签署知情同意书并得到中山大学伦理委员会的批准[8]。肝细胞性肝癌的诊断标准依据European Association for the Study of the Liver(EASL)的标准[9]。临床肿瘤分期依据国际抗癌联盟制定的TNM分期(第6版)。所有患者治疗前未接受任何抗肿瘤治疗。20例健康人外周血由广州市血液中心提供。
1.1.1 实验组 从2011年6月—2012年5月期间,共收集中晚期(TNM III期)肝癌患者69例。其中男62例,女7例,年龄26~75岁,中位年龄50岁。
1.1.2 对照组 研究期间同时收集了28例早期(TNM I期)肝癌患者和20例健康人的外周血作为对照。其中早期肝癌患者,男27例,女1例,年龄32~69岁,中位年龄48岁;健康人,男17例,女3例,年龄25~55岁,中位年龄44岁。2个对照组与实验组性别、年龄差异无统计学意义(P>0.05)。
1.1.3 样本采集和处理 所有入组病例于治疗前2~3 d抽取清晨空腹外周静脉血6 mL进行分析。肝素抗凝管收集,收集后6 h内进行处理。
1.2 主要仪器和试剂
1.2.1 实验仪器 流式细胞仪为美国Beckman Coulter公司生产,型号为FC500。
1.2.2 实验试剂 流式细胞术荧光抗体:CD3-APC、CD3-ECD、CD4-FITC、CD4-PC7、CD8-PE、IFN-γ-PE 购自美国Beckman Coulter公司;CD3-FITC、CD56-PC7购自美国 BD公司;IL-17AAF647、FoxP3-APC购自美国eBioscience公司。IL-17固定破膜试剂盒(IntraPre Reagent)购自美国Beckman Coulter公司。FoxP3固定破膜试剂盒购自美国eBioscience公司。白细胞活化剂购自美国BD公司。Ficoll淋巴细胞分离液购自天津灏洋公司。
1.3 淋巴细胞亚群检测
采用Ficoll密度梯度离心法分离外周血单个核细胞。胞内抗原IL-17和IFN-γ的检测用白细胞活化剂刺激细胞4h之后进行染色。 取50μL细胞(1×104/μL),加入适量的表面抗体,4 ℃避光孵育30min,PBS洗1次,离心(4 ℃,380 g,8 min),弃上清。胞内抗原染色:加入50μL固定剂,室温避光孵育15min,PBS洗一次,离心弃上清,加入50μL破膜剂,室温避光孵育5 min,加入适量的胞内抗体,4℃避光孵育30 min,PBS洗1次,离心弃上清,以500μLPBS重悬细胞,用流式细胞仪FC500检测。核内抗原FoxP3染色:加入400μL固定液,4℃避光孵育30 min,PBS洗1次,离心弃上清,加入1 mL通透液,离心弃上清,加入适量Foxp3-APC抗体,4℃避光孵育45 min,加入1 mL通透液,离心弃上清,以500μLPBS重悬细胞,用流式细胞仪FC500检测。数据采用CXP analysis软件分析。
1.4 统计方法
采用SPSS 13.0软件对数据进行统计分析。连续变量以均数±标准差形式表示,组间的均值差异学分析采用Mann-Whitney U检验。分类变量以频数的形式表示,用χ2检验进行对比分析。相关性分析采用Pearson相关系数分析。
2 结果
2.1 中晚期肝癌患者临床特征
中晚期肝癌患者肿瘤负荷大、生长迅速,常伴有癌栓、肿瘤转移等,有着与早期肝癌患者不同的特征。本研究中我们首先比较了不同分期肝癌患者的生化指标,发现相对早期肝癌患者,中晚期肝癌患者肝功能的多项指标,如甲胎蛋白(AFP)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、谷氨酰转肽酶(GGT)和乳酸脱氢酶(LDH)等均显著上升;反映机体炎症状态的指标,如外周血C-反应蛋白(CRP)、白细胞总数(WBC)和中性粒细胞/淋巴细胞比值(NLR)也明显升高,而外周血淋巴细胞数目却有所下降,见表1。
2.2 中晚期肝癌外周血淋巴细胞表型
该研究利用流式细胞术分别检测了不同分期肝癌患者外周血淋巴细胞亚群的比例。该研究首先通过检测表面标记对CD3+T、CD4+T、CD8+T、NK及NKT细胞进行了分析,结果表明早期和中晚期肝癌患者外周血中上述淋巴细胞亚群比例均与健康人相当。该研究进一步通过检测胞内细胞因子以及核内转录因子水平将CD4+T和CD8+T细胞分为不同的功能亚群:Th1(IFN-γ+/CD4+T)、Th17(IL-17+/CD4+T)、Treg(CD25+Foxp3+/CD4+)、和Tc1(IFN-γ+/CD8+T)。通过各组之间的比较我们发现,与健康人相比,中晚期肝癌患者外周血Th1、Th17以及Treg比例显著升高;与早期肝癌患者相比,中晚期肝癌患者外周血Th17细胞比例也明显升高,而Tc1细胞比例却显著下降,Th1和Treg细胞则无明显差异,见图1。

表1 不同TNM分期肝癌患者临床指标对比
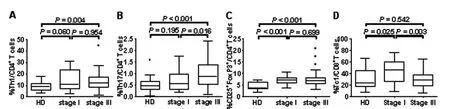
图1 健康人和肝癌患者治疗前外周血Th1、Th17、Treg和Tc1细胞亚群比例及比较
2.3 中晚期肝癌临床指标与免疫指标相关性分析
肿瘤的生长、浸润、转移状况与机体的免疫监控状态密切相关,而淋巴细胞亚群之间也可能存在相互促进或抑制的关系。因此我们将治疗前外周血炎症指标、淋巴细胞亚群比例和血浆细胞因子水平与临床指标进行相关性分析,结果发现:①外周血中CRP(r=0.295,P=0.015)和 NLR(r=0.363,P=0.002)水平均与肿瘤大小呈正相关,而外周血淋巴细胞亚群比例CD3+T%(r=-0.260,P=0.031)、Th1%(r=-0.248,P=0.043)则与肿瘤大小呈负相关;②CD3+T%(r=-0.283,P=0.019)、Th1%(r=-0.267,P=0.029)同时也与 AFP 呈负相关; ③CD4+T%(r=0.319,P=0.008)、Foxp3+/T%(r=0.275,P=0.026)与肿瘤血管侵犯呈正相关,CD8+%(r=-0.322,P=0.007)、NKT%(r=-0.263,P=0.029)则与肿瘤血管侵犯呈负相关;④WBC(r=0.337,P=0.005)、NLR(r=0.554,P=0.000)均与 CRP 呈正相关。
3 讨论
随着肿瘤的进展,肝癌细胞会不断增殖和侵袭,对正常肝细胞造成损伤,同时也会释放一系列趋化因子、炎症因子和生长因子,招募各种免疫细胞浸润至肿瘤及周围组织。该研究发现,中晚期肝癌患者外周血中一系列反应机体炎症水平的指标如CRP、WBC、NLR都明显高于早期肝癌患者,且伴随多项反映肝功能损伤指标的上升。相关性分析发现,CRP、NLR水平均与肿瘤大小呈正相关,提示这种高水平的炎症状态可能有利于肿瘤的生长及侵袭。
既往的研究表明,肝癌患者体内具有杀伤功能的CTL、NK等淋巴细胞的数目或功能被不同程度地下调或抑制[10]。该研究发现,与早期肝癌相比,中晚期肝癌外周血Tc1细胞比例显著下降,这可能与肿瘤进展过程中Tc1和Tc2平衡失调有关。
Treg细胞是一种重要的免疫抑制细胞,它可通过各种途径抑制免疫反应,介导免疫逃逸。Zhou[11]等在肝癌患者中发现Treg细胞比例升高,且与患者预后呈负相关,但该研究未对不同分期肝癌患者Treg细胞的差异进行比较。该研究发现,中晚期肝癌患者外周血Treg比例显著高于健康人,且与肿瘤血管侵犯呈正相关,但不同分期肝癌患者外周血Treg细胞的比例并无显著差异,提示Treg细胞在肝癌外周血中的升高,可能是肿瘤发生后对全身免疫状态的影响造成的,是肝癌患者免疫失衡的表现,也是肿瘤发生的一个重要的潜在检测指标。
Th17细胞是一种新型的能产生IL-17A的CD4+T细胞,已被证实参与多种自身免疫疾病,但是目前对于其在肿瘤中的作用还存在争议[12]。Zhang等[13]在肝癌中的研究发现,中晚期肝癌组织中IL-17A的表达水平高于早期肝癌,且与临床预后呈负相关。该研究发现,中晚期肝癌外周血Th17细胞比例显著高于健康人及早期肝癌。但Zhang等[13]的报道却发现,中晚期肝癌外周血Th17细胞与健康人及早期肝癌均无显著差异,这可能与其中晚期肝癌组样本量小有关。
上述淋巴细胞亚群的变化提示,肝癌在进展过程中,能够影响机体免疫平衡,使得免疫抑制型细胞占主导,从而帮助其生长侵袭。因此,中晚期肝癌除常规治疗之外,可以针对患者免疫状态采取相应的免疫干预措施,从而提高治疗效果,延长患者的生存时间。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[2]Parkin DM,Whelan SL,Ferlay J,et al.Cancer incidence in five continents[M].Volume VII.IARC Sci Publ No 143,Lyon:IARC,1997:322-325.
[3]Sangiovanni A,Manini MA,Iavarone M,et al.The diagnostic and economic impact of contrast imaging techniques in the diagnosis of small hepatocellular carcinoma in cirrhosis[J].Gut,2010,59:638-644.
[4]Shi M,Chen JA,Lin XJ,et al.Transarterial chemoembolization as initial treatment for unresectable hepatocellular carcinoma in southern China[J].World J Gastroenterol,2010,16:264-269.
[5]Budhu A,Forgues M,Ye QH,et al.Prediction of venous metastases,recurrence,and prognosis in hepatocellular carcinoma based on a unique immune response signature of the liver microenvironment[J].Cancer Cell,2006,10:99-111.
[6]Grivennikov SI,Greten FR,Karin M.Immunity,inflammation,and cancer[J].Cell,2010,140:883-899.
[7]Koebel CM,Vermi W,Swann JB,et al.Adaptive immunity maintains occult cancer in an equilibrium state[J].Nature,2007,450:903-907.
[8]World Medical Association(WMA).Declaration of Helsinki:ethical principles for medical research involving human subjects[M].Fortaleza,Brazil:WMA,2013.
[9]Bruix J,Sherman M,Llovet JM,et al.Clinical management of hepatocellular carcinoma.Conclusions of the Barcelona-2000 EASL conference.European Association for the Study of the Liver[J].J Hepatol,2001,35:421-430.
[10]Parmiani G,Anichini A.T cell infiltration and prognosis in HCC patients[J].J Hepatol,2006,45:178-181.
[11]Zhou J,Ding T,Pan W,et al.Increased intratumoral regulatory T cells are related to intratumoral macrophages and poor prognosis in hepatocellular carcinoma patients[J].Int J Cancer,2009,125:1640-1648.
[12]Korn T,Bettelli E,Oukka M,et al.IL-17 and Th17 Cells[J].Annu Rev Immunol,2009,27:485-517.
[13]Zhang JP,Yan J,Xu J,et al.Increased intratumoral IL-17-producing cells correlate with poaor survival in hepatocellular carcinoma patients[J].J Hepatol,2009,50:980-989.

