Ⅰ~Ⅱ期弥漫性大B 细胞型非霍奇金淋巴瘤化学治疗后辅助性放射治疗及同期放射化学治疗疗效比较
庄海阳,梁仁佩
(中国人民解放军第180医院,福建 泉州 362000)
自1997年美国食品药物管理局(FDA)批准利妥昔单抗应用于临床以来,非霍奇金淋巴瘤(NHL)的治疗进入了新时代[1-2]。以CHOP(环磷酰胺、多柔比星、长春新碱和泼尼松)方案+利妥昔单抗(R-CHOP)进行化学治疗(简称化疗)为主的综合治疗是非霍奇金淋巴瘤的治疗原则。研究表明,放射治疗(简称放疗)是Ⅰ~Ⅱ期弥漫性大B细胞型非霍奇金淋巴瘤(DLBCL)的有效治疗手段,放疗+化疗的综合治疗是Ⅰ~Ⅱ期侵袭性NHL的标准治疗原则,综合治疗改善了Ⅰ~Ⅱ期侵袭性NHL的5年无瘤生存率和总生存率[3]。基于上述背景,笔者探讨了Ⅰ~Ⅱ期B细胞型非霍奇金淋巴瘤化疗后辅助性放疗及同期放化疗的疗效,现报道如下。
1 资料与方法
1.1 一般资料
30例DLBCL患者均为初治,其中男17例,女13例;年龄16~73岁,中位年龄47岁;均经病理检查确诊,按Ann Arbor进行临床分期[4],均为Ⅰ~Ⅱ期。不良预后因素按国际预后指数(IPI)分组,30例均为低、中度危险组(<2分)。随机分为化疗后辅助放疗组、同期放化疗组,各15例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
化疗后辅助放疗组按CHOP方案:注射用环磷酰胺(山西普德药业股份有限公司,批号为04121003,规格为0.2 g)、注射用盐酸多柔比星(浙江海正药业股份有限公司,批号为130701,规格为10 mg)、注射用长春新碱(浙江海正药业股份有限公司,批号为130301,规格为1 mg)和醋酸泼尼松片(浙江仙琚制药有限公司,批号为130612,规格为每片5 mg)+利妥昔单抗注射液(上海罗氏制药有限公司,批号为JS20010047,规格为100 mg/10 mL)化疗,4周后开始放疗;同期放化疗组:放疗和化疗同步进行,其中化疗方案为CHOP方案+R-CHOP,化疗方案间歇3~4周1次,根据NHL国际预后指数(IPI)决定化疗周期。放射治疗方案:用6 MVX线对局部受累野放射治疗30~36 Gy,部分患者行适形放疗以减少危险器官的放疗剂量。完全缓解的患者在完成总疗程后即进入随访,随访5年。
1.3 观察指标及疗效判定标准
所有病例治疗前询问病史及全面检查:肝肾功能、LDH、心电图、骨髓细胞学检查,胸、腹部CT,详细记录肿块大小,治疗后全面复查上述指标。客观疗效采用实体瘤客观疗效评价通用标准,分为完全缓解 (CR)、部分缓解 (PR)、稳定 (SD)、进展 (PD)。以CR+PR为总有效。不良反应评价根据世界卫生组织(WHO)毒性分级标准[5]。
1.4 统计学处理
采用SPSS 16.0统计软件,组间率的比较采用 χ2检验,采用Kaplan-Meier进行生存分析,P<0.05为差异有统计学意义。
2 结果
结果见表 1。化疗后辅助放疗组 1,2,3,4,5 年生存率分别为93.33%,86.72%,73.32%,60.08%,60.00%;同期放化疗组1,2,3,4,5 年生存率分别为 93.32% ,93.37% ,80.00% ,73.36% ,66.71% 。经 log-rank 检验统计,χ2=0.9212,P=0.337 4>0.05,差异无统计学意义,结果见图1。本组30例中化疗主要的不良反应为消化道反应、骨髓抑制和脱发,消化道反应以恶心、呕吐为主,1~2级居多,发生率为 87.05%;3~4级较少,发生率为13.36%。骨髓抑制主要为白细胞下降,发生率为84.17%,其中1~2级为74.26%,3~4级为25.83%;血红蛋白、血小板下降少且不严重,部分发生脱发,发生率为36.34%。本组所有患者均可耐受放疗反应,主要的反应为放射性食管炎或口腔咽喉黏膜反应,经处理,放疗可以顺利进行。放射治疗发生放射性食管炎或口腔咽喉黏膜反应,1~2级为63.76%,抗感染、抗炎治疗后都可恢复。
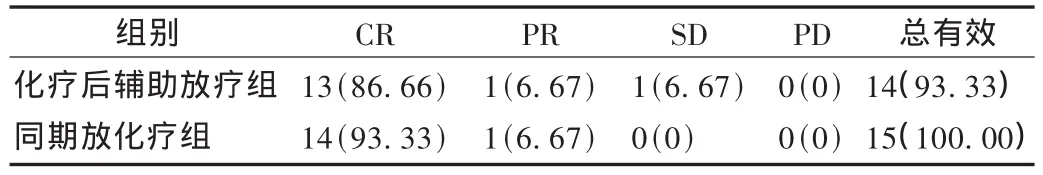
表1 两组患者客观疗效比较(n=15)
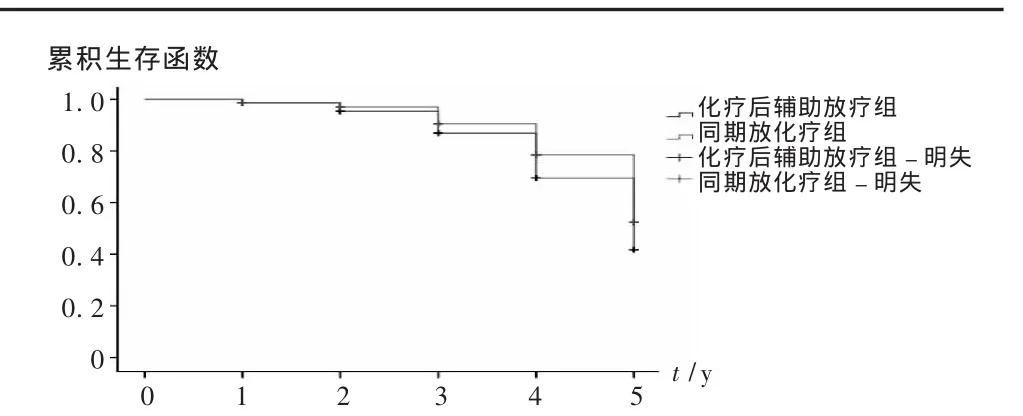
图1 两组治疗方案5年内生存率比较
3 讨论
DLBCL是非霍奇金淋巴瘤(NHL)中最大的一个亚群,是成人最常见的NHL,占所有新诊断NHL的30% 和侵袭性淋巴瘤的80%[6],约占 NHL总数的 30% ~40%[7]。在欧美国家,DLBCL的发病率约占非霍奇金淋巴瘤的31%[8],在亚洲国家NHL超过40%[9]。NHL的发病率随着年龄的增长而增加,男女发病率的比例为 3∶2。
NHL的发病率和亚型随地域分布不同而不同,T细胞淋巴瘤在亚洲比西方国家更常见,而B细胞淋巴瘤某些亚型如滤泡性淋巴瘤在西方国家更常见。NHL的一种特殊亚型鼻型结外NK/T细胞淋巴瘤有明显的地域分布倾向,最常见于亚洲和拉丁美洲的部分地区。NHL的另一亚型与感染人类T淋巴细胞病毒Ⅰ(HTLV-1)有关,特别常见于日本南部和加勒比地区。
DLBCL高度异质性,表现为形态学、分子和基因异常多样性,临床表现和预后差异很大,40%可累及结外如胃肠道、中枢神经、骨和软组织,呈侵袭性病程。此型淋巴瘤预后差,表现复杂无特异性,病变隐匿不易早期诊断,除发生在头颈部、皮肤外,常不易引起重视,容易误诊。胃肠道是好发部位,常以腹痛、腹部肿块、厌食等为首发症状,易误诊为胃癌或肠癌,因为临床表现大多数无浅表淋巴结肿大,以至于活检取材困难。X线摄片、B超、CT等检查对结外弥漫大B淋巴瘤诊断缺乏特异性,不易与胃肠道等其他疾病鉴别。
CD20抗原几乎在所有前B和成熟B细胞表面都表达,但在造血干细胞及其他正常组织中不表达,是一种膜嵌入蛋白,约90%以上的B细胞NHL表达CD20抗原。美国斯坦福大学与美国癌症研究所合作通过基因芯片技术采用超过1 000种基因的基因表达谱分析表明,DLBCL包含3种不同的分子亚型:生发中心B细胞样(GCB-like)型,表达正常生发中心B细胞特征的基因,预后较好;活化B细胞样(ABC-like)型,表达活化的外周血B细胞和浆细胞特征的基因,预后较差;第3型表达谱,其他无明确特征的异源性类型,但预后同ABC。在进一步确定临床病理学类型之后,研究通过免疫组化方法,采用少数几种具有分化谱系代表的标志,将DLBCL分为 GCB-like和NON-GCB型,后者包括基因表达谱分类的ABC和第3型,这些标记包括CD10和 bcl-6作为 GCB标记,而 MUM1作为 NON-GCB标记[10]。Rosenwald等[11]报道,GCB型5年总生存率为76%,NON-GCB型5年总生存率为34%。
本病的治疗应以根治作为治疗目标。首先应力争达到完全缓解,首次治疗就必须使用足量及正规的化疗,以后按期重复疗程,这是争取治愈的关键。R-CHOP这一治疗方案的出现具有里程碑式的意义。2010年,一个大型、长期的随机对照研究结果显示,R-CHOP组10年无瘤生存率为36.5%,10年生存率达43.5%,而CHOP组分别为20%及27.6%,充分肯定了R-CHOP的作用[12]。对于Ⅰ~Ⅱ期的DLBCL患者,强调综合治疗,这样可以使化疗药物的有效剂量达到最低并降低其不良反应。Miller等[13]将400例DLBCL患者随机分成CHOP组8疗程和CHOP 3疗程+放疗组,结果短疗程组无进展生存期及心脏不良反应明显优于长疗程组。而对发生在胃肠道的DLBCL,目前仍主张积极手术治疗,能行根治性手术治疗的要尽量行根治性手术,不管手术与否均应进行化疗,选用R-CHOP方案即可取得良好效果。
本试验采用前瞻性随机对照研究,设计合理。在诱导缓解方面,同期放化疗组优于化疗后辅助放疗组;在5年生存率方面无统计学差异,但从数据上看,同期放化疗组优于化疗后辅助放疗组。本研究不足之处为样本量少,下一步可继续纳入符合标准的病例,以增大样本量,增强统计学的可信性。
[1]McLaughlin P,Grillo-Lopez AJ,Link BK,et al.Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma:half of patients respond to a four- dose treatment program[J].J Clin Oncol,1998,16(8):2 825 - 2 833.
[2]江文华,解敏君,唐小万,等.利妥昔单抗治疗B细胞性非霍奇金淋巴瘤 32例[J].中国药业,2013,22(11):87 -88.
[3]伍 钢.放射治疗在恶性淋巴瘤治疗中的地位[J].中华肿瘤防治杂志,2009,16(16):1 201-1 205.
[4]王奇璐.恶性淋巴瘤的诊断与治疗[M].北京:北京医科大学中国协和医科大学联合出版社,1997:306.
[5]Trottl A,Cclevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176 - 181.
[6]Rossi D,Gaidano G.Molecular heterogeneity of diffuse large B -cell lymphoma:implications for disease management and prognosis[J].Hematology,2002,7(4):239 - 252.
[7]Tomita N,Kodama F,Motomum S,et al.Prognostic factors in difuse large B - cell lymphoma treated by risk adopted therapy[J].Inter Med,2006,45(5):247.
[8]Fisher SG,Fisher RI.The epidemiology of non - Hodgkin's lymphoma[J].On Cogene,2004,23(38):6 524 - 6 534.
[9]Zhang YN,Zhou XG,Zhang SH,et al.Clinicopathologic study of 369 B -cell non-Hodgkin lymphoma cases,with reference to the 2001 World Health Organization classification of lymphoid neoplasms[J].Chinese Journal of Pathology2005,34(4):193 -197.
[10]Ott G,Ziepert M,Klapper W,et al.Immunoblastic morphology but not the immunohistochemical GCB/non GCB classifier predicts outcome in diffuse large B-cell lymphoma in the RICOVER-60 trial of the DSHNHL[J].Blood,2010,116(23):4 916 - 4 925.
[11]Rosenwald A,Staudt LM.Gene expression profiling of diffuse large B -cell lymphoma[J].Leuk Lymphoma,2003,44(Suppl 3):S41 - S47.
[12]Coiffier B,Thieblemont C,Van Den Neste E,et al.Long-term outcome of patients in the LNH - 98.5 trial,the first randomized study comparing rituximab-CHOP to standard CHOP chemotherapy in DLBCL patients:a study by the Groupe d'Etudes des Lymphomes de Adulte[J].Blood,2010,116(12):2 040 -2 045.
[13]Miller TP,Dahlberg S,Cassady JR,et al.Chemotherapy alone compared with chemotherapy plus radiotherapy for localized intermediate- and high-grade non-Hodgkin's lymphoma[J].N Engl J Med,1998,339(1):21-26.

