蝴蝶兰黄花品系光合能力快速测定
王 威,黄丽娜,陈清西
(福建农林大学 园艺学院,福建 福州 350002)
蝴蝶兰Phalaenopsis amabilis为CAM植物,与C3、C4植物相比,其CO2的吸收存在着明显的时空不同步,这使传统的气体交换测量无法准确反映其光合能力。鉴于目前蝴蝶兰杂交品系众多,品系间光合能力存在明显差别,而关于蝴蝶兰光合能力的研究较少,因此,有必要建立一个新型实用的蝴蝶兰光合能力测定体系。本研究以5个蝴蝶兰黄花品系为试材,利用调制叶绿素荧光技术,通过比较其快速光曲线的相关参数,了解不同品系的光合能力,尝试建立一套蝴蝶兰光合能力快速测定技术。
1 材料与方法
1.1 植物材料与栽培管理
1.1.1 植物材料 供试蝴蝶兰盆苗购于漳州钜宝生物科技有限公司,均为出瓶栽培8~9月的无病毒健康植株(表1)。
1.1.2 栽培条件与水肥管理 试验于福建省亚热带植物研究所(厦门)进行。植株购入后,先置于人工气候培养箱(RXZ-280C,中国宁波江南生产)中。设定的栽培条件与原生长温室大棚相近。植株经适应性栽培一周后用于试验指标测定。
栽培条件:光照强度 300 μmol·m-2·s-1,光照时间12 h·d-1,日夜温度30/25 ℃,相对湿度75%~80%。
肥水管理:每周施用商用肥料Hyponex(20-20-20) 1 g·L-1,浇水量依盆内基质湿度而定。

表1 供试的5个黄花蝴蝶兰品系Table1 5 cultivars of yellow Phalaenopsis used for test
1.2 测量项目及方法
1.2.1 快速光曲线测量 快速光曲线测量于每日上午9∶00~11∶00进行。选取植株从上往下数第二片叶进行测量,每品系测3株,每植株重复测量至少3次,选取数据较好的曲线用于数据分析。
将超便携调制叶绿素荧光仪(MINI-PAM,Walz,Germany)与计算机连接,使用WinControl-3-3.18软件运行Light Curve程序,对样品进行测量。设置8个PAR梯度:151、285、424、581、847、1138、1715和2452 μmol·m-2·s-1,每梯度持续20 s,软件自动给出并记录对应的rETR。rETR随PAR的变化趋势图即为快速光曲线。
1.2.2 快速光曲线拟合 利用公式P = Pm×(1-e-α•PAR/Pm)×e-β•PAR/Pm拟合快速光曲线[1],其中,P为光合速率,即相对电子传递速率rETR;Pm为最大光合速率,即最大相对电子传递速率rETRmax;α为初始斜率,反映光能利用效率;β为光抑制参数;半饱和光强Ik = Pm/α,反映强光耐受能力。曲线拟合采用最小二乘法,使用SPSS软件进行。
2 结果与分析
2.1 蝴蝶兰5个黄花品系快速光曲线
对 5个蝴蝶兰黄花品系的快速光曲线测量结果如图1所示。rETR随着光强的升高而升高,当光强达到光饱和点后,rETR达到最大值,即rETRmax;此后,rETR随光强升高而逐渐降低。由图1可知,大部分品系快速光曲线变化趋势基本一致,在较低光强下即达到饱和,仅Dtps.Fusheng Sweet Paradise‘Golden Leopard’表现为需较高光强达到光饱和,并具有较高的rETRmax。
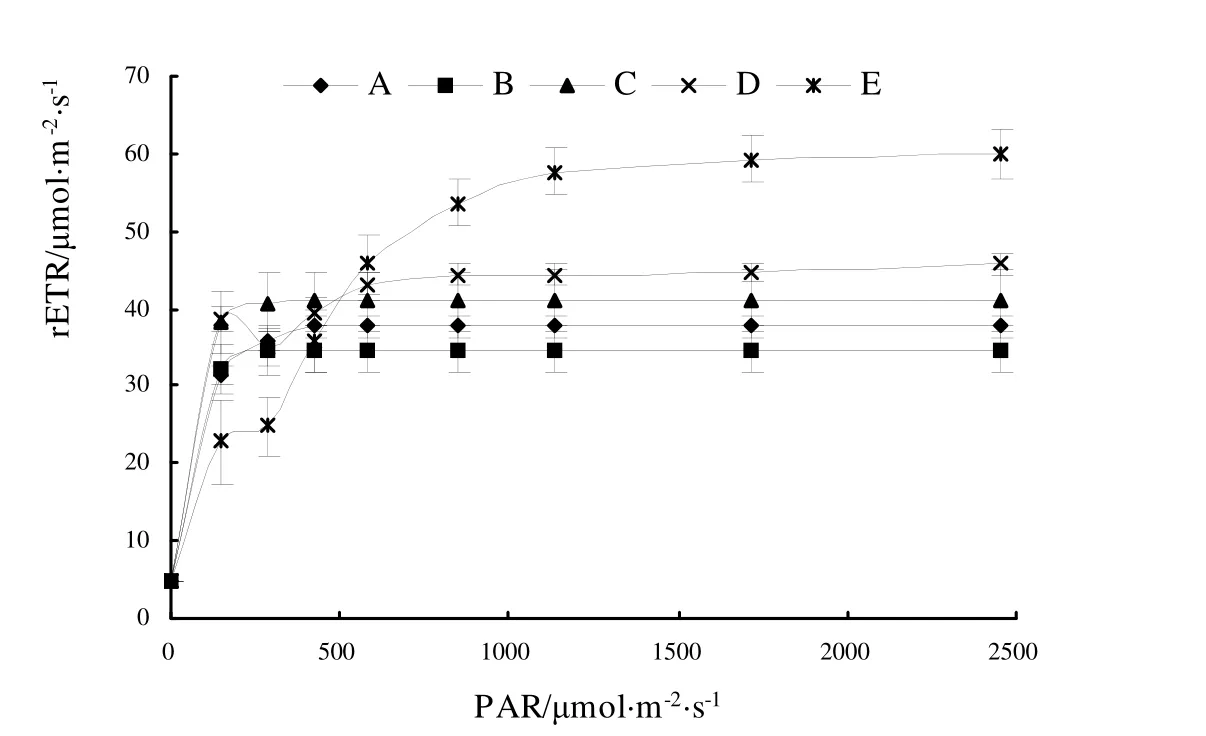
图1 5个蝴蝶兰黄花品系的快速光曲线Fig.1 RLCs of 5 cultivars of yellow Phalaenopsis
2.2 快速光曲线拟合参数比较
对所得快速光曲线进行拟合,可得到各品种的最大相对电子传递速率rETRmax、初始斜率α与半饱和光强Ik。
2.2.1 最大相对电子传递速率比较 由图2可知,Dtps.Fusheng Sweet Paradise ‘Golden Leopard’的最大相对电子传递速率(rETRmax= 59.383 ± 3.096 μmol·m-2·s-1)最高,Dtps.Chain Xen Queen(rETRmax=44.432 ± 1.428 μmol·m-2·s-1)次之;Dtps.Fuller’s Sunset的最大相对电子传递速率最小(rETRmax= 34.717± 3.026 μmol·m-2·s-1);其他品种Dtps.Fuller’s Sunset ‘Golden Girl’和Phal.Taida Smile(按降序排列)的最大相对电子传递速率介于 37.000~41.000 μmol·m-2·s-1之间。
2.2.2 初始斜率比较 比较 5个蝴蝶兰黄花品系快速光曲线的初始斜率 α,结果如图 3所示。Dtps.Fuller’s Sunset ‘Golden Girl’的初始斜率(0.233 ± 0.028)最高;Dtps.Fuller’s Sunset(0.213 ± 0.024)次之;Dtps.Fusheng Sweet Paradise ‘Golden Leopard’和 Dtps.Chain Xen Queen(按降序排列)介于 0.180~0.210之间,其中Phal.Taida Smile的初始斜率最小(0.148 ± 0.005)。
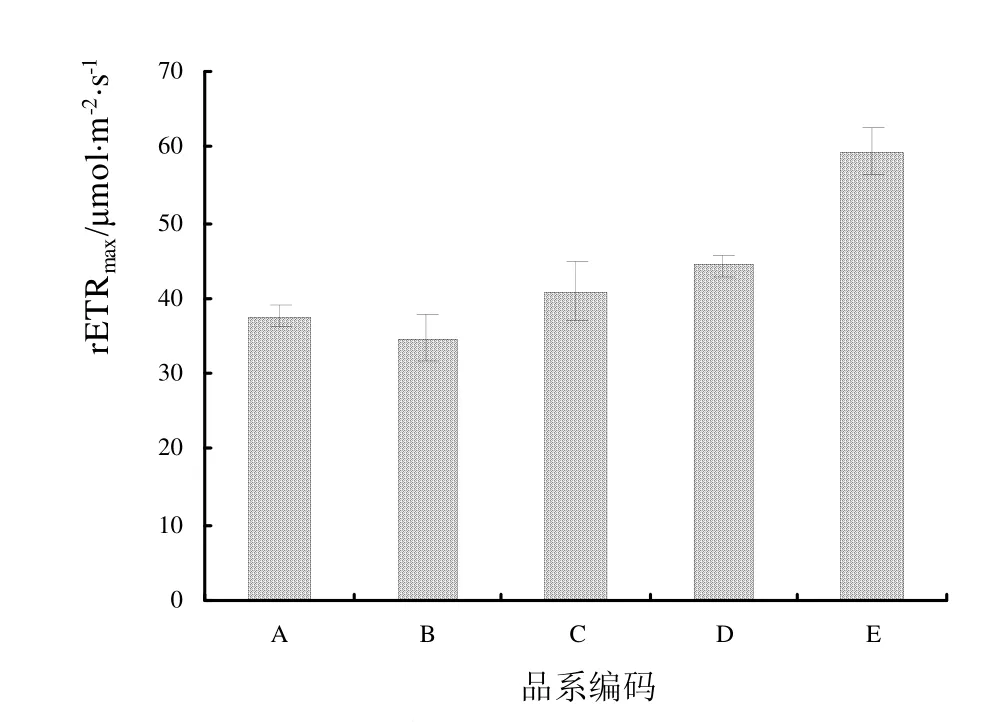
图2 5个蝴蝶兰黄花品系最大相对电子传递速率比较Fig.2 Comparisons of rETRmax of RLCs in 5 cultivars of yellow Phalaenopsis
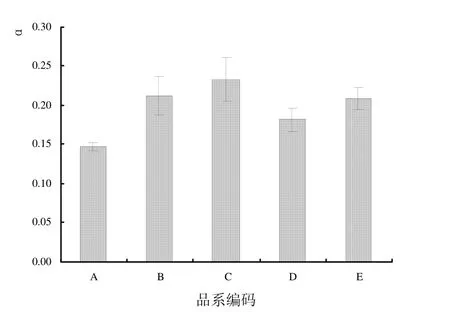
图3 5个蝴蝶兰黄花品系初始斜率比较Fig.3 Comparisons of α of RLCs in 5 cultivars of yellow Phalaenopsis
2.2.3 半饱和光强比较 5个蝴蝶兰黄花品系的半饱和光强Ik如图 4所示。Dtps.Fusheng Sweet Paradise ‘Golden Leopard’的半饱和光强(Ik = 288.425 ± 13.398 μmol·m-2·s-1)最高;Phal.Taida Smile和Dtps.Chain Xen Queen(按降序排列)介于 250.000~256.000 μmol·m-2·s-1之间;Dtps.Fuller’s Sunset ‘Golden Girl’和Dtps.Fuller’s Sunset较低,均低于200.00 μmol·m-2·s-1,其中Dtps.Fuller’s Sunset最低,仅有 166.310 ± 9.245 μmol·m-2·s-1。
需要指出的是,Dtps.Fusheng Sweet Paradise ‘Golden Leopard’具有最高的半饱和光强和最大相对电子传递速率;Dtps.Fuller’s Sunset具有最小的最大相对电子传递速率和半饱和光强。
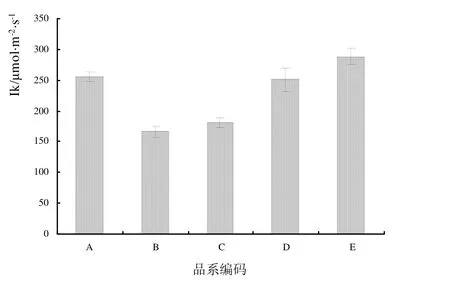
图4 5个蝴蝶兰黄花品系半饱和光强比较Fig.4 Comparisons of Ik of RLCs in 5 cultivars of yellow Phalaenopsis
3 讨论
光强-光合速率曲线(P-I Curve)测量是了解植物光合作用对光强响应的重要手段,被广泛用于植物生理学、生态学、农学、林学、园艺学和遗传学等研究。曲线可以通过便携式光合作用测定仪进行叶片气体交换测定。通过Photosyn Assistant软件用经验方程对光响应数据进行计算和拟合,绘制而成的曲线一般可以分为光限制、光饱和与光抑制3个阶段,同时可以得到光补偿点、光饱和点、表观量子效率等重要数据。但是,以气体交换为原理的测量存在一些问题[2-3]:(1)耗时较长 一般一条P-I曲线需要20个点左右的数据,在每个光强下停留2~3 min,数值稳定后再记录光合速率值,因此,一条曲线不计算重复就需耗时40 min左右;(2)数据可靠性有待检验 曲线测量前,受测植株需要经过充分光合诱导,测得的光合速率才能反映叶片的稳态水平。测量前有无光合诱导,所得曲线差异较大,直接影响数据的可靠性。此外,利用经验方程拟合曲线所得的饱和光强亦不可靠,有时会低估饱和光强;(3)不适合CAM植物 CAM植物夜间气孔开放,吸收CO2,将CO2固定于苹果酸中,白天气孔关闭,CO2释放,参与C3途径,与C3、C4植物相比存在明显的时空不同步。传统的气体交换测量是根据一系列光强梯度下CO2吸收量计算光合速率绘制曲线,这与CAM植物的光合呼吸模式不符。笔者曾使用GFS3000(Walz,Germany)系统,试图测量蝴蝶兰的P-I曲线,但由于蝴蝶兰白天叶片气孔关闭,导致气孔导度很低,且光合速率无法稳定进行记录。同时,参考目前已发表的关于蝴蝶兰光合测定的研究[4],由于所选用的技术手段不同,结果差异巨大,若以二氧化碳吸收作为指标,则光饱和点约为200.000 μmol·m-2·s-1左右,而如以叶圆片的氧气释放量为指标,则光饱和点约为 1354.000 μmol·m-2·s-1[4],相差6倍以上。目前尚未见到通过传统气体交换系统测量绘制出蝴蝶兰P-I曲线的报道。
本研究利用调制叶绿素荧光技术,通过设置8个梯度,每个梯度持续时间20 s光化光照射叶片,得出相对电子传递速率rETR随光合有效辐射PAR变化的快速光曲线,该技术具有快速、测量过程对受测植株光合状态影响小的特点,目前被越来越多地应用于植物光合作用研究[5-6];所得数据通过SPSS软件利用公式P = Pm×(1-e-α•PAR/Pm)×e-β•PAR/Pm拟合曲线得出相应的参数用于蝴蝶兰光合能力分析。
通过对5个蝴蝶兰黄花品系快速光曲拟合参数比较可以看出,除Phal.Taida Smile和Dtps.Fuller’s Sunset ‘Golden Girl’外,其他三个品系的最大相对电子传递速率rETRmax和半饱和光强Ik的趋势一致,有较高rETRmax的品系具有较高的Ik。Ik是植物强光耐受力的重要指标[7],因此,具有较高强光耐受力的品系也相应具有较高的光合速率。
初始斜率α反映叶片光能利用效率,它与叶片的吸光系数Abs和PSⅡ对捕获光能的利用能力有关。由于本试验所用仪器MINI-PAM无法测量各品种叶片的Abs,因此无法用rETR公式进行计算,但仍可通过测得的α估计品种叶片Abs,结果显示,Phal.Taida Smile虽然有较高的Ik,具有较强的强光耐受力,但其α值均较低,因此其PSⅡ对捕获光能的利用能力也较低,导致其最大光合速率并不高;而Dtps.Fuller’s Sunset ‘Golden Girl’虽然Ik值较低,但有最高的α值,能更有效的利用光能,故其具有较高的光合速率。
综上所述,大部分品系可以按快速光曲线拟合所得的Ik大小来估测品系栽培需光量,但仍有少部分品系因其叶片的吸光系数Abs和初始斜率α的原因,导致其rETR的大小与Ik的趋势不一致,即品系光能利用效率存在差异。因此,根据本试验结果,将参试品系按光合能力强弱排列为:Dtps.Fusheng Sweet Paradise ‘Golden Leopard’、Dtps.Fuller’s Sunset ‘Golden Girl’、Dtps.Chain Xen Queen、Phal.Taida Smile、Dtps.Fuller’s Sunset。
其次,通过品系快速光曲线测定,得到参数Ik,估测品系栽培需光量,并结合品系rETRmax和α情况,综合评价品系光合能力强弱。生产上,可依据品系光合能力合理制定栽培温室的光环境管理模式,而非统一的光管理模式,这样不仅利于植株生长,同时可以有效提高温室大棚光能利用率,达到节能与增产的目的。
目前,快速光曲线已广泛用于植物光合能力测定[8-9],因此,调制叶绿素荧光技术不仅可用于蝴蝶兰的光合能力快速测定,也可应用于其他光合生理研究。
[1] Platt T, Gallegos C L, Harrison W G.Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton[J].Journal of Marine Research, 1980,38(4): 687-701.
[2] 许大全.光合作用测定及研究中一些值得注意的问题[J].植物生理学通讯, 2006,42(6): 1163-1167.
[3] 陈根云,俞冠路,陈悦,许大全.光合作用对光和二氧化碳响应的观测方法探讨[J].植物生理与分子生物学学报,2006,32(6): 691-696.
[4] 米田和夫.蝴蝶兰[M].台中: 国立中兴大学农业暨自然资源学院农业推广中心, 2007: 68-69.
[5] Ralph P J, Gademann R.Rapid light curves: a powerful tool to assess photosynthetic activity[J].Aquatic Botany, 2005,82(3): 222-237.
[6] White A J, Critchley C.Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus[J].Photosynthesis Research, 1999,59(1): 63-72.
[7] Kühl M, Chen M, Ralph P J, Schreiber U, Larkum A W D.A niche for cyanobacteria containing chlorophyll d[J].Nature,2005,433: 820.
[8] Rascher U, Liebig M, Lüttge U.Evaluation of instant light-response curves of chlorophyll fluorescence parameters obtained with a portable chlorophyll fluorometer on site in the field[J].Plant, Cell and Environment, 2000,23: 1397-1405.
[9] Belshe E F, Durako M J, Blum J E.Photosynthetic rapid light curves (RLC) of Thalassia testudinum exhibit diurnal variation[J].Journal of Experimental Marine Biology and Ecology, 2007,342(2): 253-268.

