金银花叶HPLC指纹图谱及最佳采收期的研究
杨鹏飞,熊建华,2* ,杜华英,2,罗秋水,2,吴国平,2
(1.江西农业大学 食品科学与工程学院,江西 南昌 330045;2.南昌市农产品加工与质量控制重点实验室,江西 南昌330045)
金银花(Lonicera japonica Thunb)为忍冬科植物,具有清热解毒[1-2]、抗菌消炎[3-4]、保肝利胆[5-6]等功能,是药食两用的大宗中药材,其叶片因产量较高,绿原酸、黄酮等多酚类物质含量丰富[7-8],抑菌[9-10]、抗氧化[11]等药理活性较好,在许多中药、中成药及饮料中广泛使用,然而,金银花叶不仅化学成分复杂[12-13],绿原酸在干叶中含量可达 5.69%,3,4-二咖啡酰奎宁酸(异绿原酸 B),3,5-二咖啡酰奎宁酸(异绿原酸A)等同系物在叶中也有一定含量,木犀草苷含量达干叶的3.48%,另外,还含有裂环氧化马钱素、β-谷甾醇,胡萝卜苷等,并且随着采收期的不同存在差异。中药材的品质鉴定一直是人们关注的重点,人们常限制于采用一种或几种成分作为药材品质的评价指标,然而中药材为多组分复杂体系,单一地测定一个或几个成分不能全面地反映中药材的内在质量,指纹图谱技术[14-18]能提供丰富鉴别信息,较为全面地反映中药及其制剂中所含化学成分的种类与数量,进而对药品质量进行整体描述和评价,已被WHO、FDA和其他权威机构采纳作为中草药质量评价方法。因此,为了更全面评价金银花叶药材质量和控制质量的稳定性,本文对一年逐月采收共12批金银花叶药材进行了高效液相指纹图谱研究,并采用国家药典委员会推荐使用的“中药色谱指纹图谱相似度评价软件(2004A)”对不同采收期金银花叶药材的指纹图谱进行相似度评价,以期为更全面评价金银花叶一年品质变化规律、确定金银花叶最佳采收期提供参考。
1 材料与方法
1.1 材料与仪器
原材料:金银花叶,采自江西南昌,共12批,经江西中医学院邹嘉玉老师鉴定,具体见表4。
主要仪器:Waters 1525型高效液相色谱仪(配Waters 2487型紫外双波长检测器,Breeze色谱工作站),美国 Waters 公司;Alltech Alltima C18 柱(250 mm×4.6 mm i.d.,5 μm),美国 GRACE 公司;TGL-16G高速冷冻离心机,上海精密仪器有限公司;FA1104N型电子天平,上海精密仪器有限公司;KQ3200DA型数控超声波清洗器,昆山市超声仪器有限公司。
主要试剂:绿原酸对照品(批号:110753-200413),购自中国药品生物制品检定所,乙腈、甲醇为色谱纯,乙醇、磷酸等为分析纯,超纯水自制。
1.2 试验方法
1.2.1 色谱条件 色谱柱:Alltech Alltima C18(250 mm×4.6 mm i.d.,5 μm);流动相:乙腈(A)-0.4%磷酸水溶液(B),分别抽滤(滤膜为 0.45 μm)、超声脱气。按表 1梯度洗脱,流速:0.7 mL/min;柱温:40 ℃;检测波长:238 nm;进样量:10 μL。

表1 梯度洗脱程序Tab.1 Procedure of linear gradient elution
1.2.2 对照品溶液的制备 分别准确称取一定量的绿原酸标准品置50 mL小烧杯中,加入50%甲醇溶解,洗入50 mL容量瓶定容,各配制浓度为20、30、40、50、60 μg/mL的标准溶液,摇匀。以上标准液均用封口胶封口置于4℃冰箱中、避光存放。
1.2.3 供试品溶液的制备 分别定量称取0.5 g预处理后的样品于100 mL锥形瓶(已编号)中,加入50%甲醇50 mL称定质量,超声提取30 min,冷却然后再称定质量,补足损失,以4 000 r/min转速离心20 min,取上清液,微孔滤膜过滤,即得。
1.2.4 指纹图谱建立的方法学考察 为了考察检测方法的可靠性,采用相对保留时间和相对峰面积标定共有指纹峰。以图谱中绿原酸色谱峰(2号峰)的保留时间为1和峰面积为100。计算其它各共有峰的相对保留时间及相对峰面积。取同一样本平行制备2份,在其中一份样品中加一定量的绿原酸(2号峰)平行测定3次,计算出样品的含量及方法的回收率。取同一份样本制备液,连续进样6次,做精密度试验。取同一样本,分别在制备后0 h、5 h、10 h、15 h、1 d、5 d进样(冰箱中冷藏),做稳定性试验。取同一样本平行制备6份,分别进样分析,做重复性试验。
2 结果与分析
2.1 指纹图谱建立的色谱条件分析
金银花叶所含成分较丰富,选用250 mm C18反向柱。试验比较了Agilent Zorbax SB C18(250 mm×4.6 mm i.d.,5 μm)、Alltech Alltima C18 柱(250 mm×4.6 mm i.d.,5 μm)、Venusil XBP C18(250 mm×4.6 mm i.d.,5 μm)3种色谱柱,在相同的色谱条件下,色谱峰峰形、分离度、保留时间等均以 Alltech Alltima C18 柱(250 mm×4.6 mm i.d.,5 μm)为最佳。
比较甲醇-水、乙腈-水、甲醇-0.4%磷酸、乙腈-0.4%磷酸等多种流动相分离金银花叶供试品溶液中性质差异较大的各个组分,结果表明乙腈色谱系统较甲醇系统好,系统信息量相对较多,能较全面地反映金银花叶的化学成分,而且金银花叶中含较多的酚酸类物质,含磷酸的流动相可较好解决拖尾现象,峰形较好,因此,乙腈-0.4%磷酸溶液系统为较好的流动相。
比较检测波长238、325、254、280、300、360 nm金银花叶活性物质色谱图。检测波长为238 nm所获色谱图的峰较多,包括了所有其他波长检测到的色谱峰,而且有较强吸收,故选择238 nm作为指纹图谱检测波长。柱温也是检测关键因素,经过试验金银花叶指纹图谱检测柱温选择40℃。
2.2 指纹图谱建立的样本提取条件分析
不同提取方法会影响金银花叶活性物质的提取效果(图1)。对比超声提取和回流提取,超声提取金银花叶的效果比回流提取好,并且超声提取比较简便,提取时间较短,所以选用超声提取金银花叶活性物质。

图1 不同提取方法色谱图Fig.1 HPLC chromatogram of different extraction methods
提取时间不同会影响金银花叶活性物质的提取效果(图2)。金银花叶成分的浸提量随着超声时间而逐渐增多,超声提取30 min的金银花叶成分含量高于提取10 min、20 min提取量,30 min之后提取的量较30 min的量相差不是很明显,故选用超声提取30 min。
不同提取溶剂对金银花叶活性物质的提取效果影响较大(图3),不仅使其活性成分有所差异,还会影响其活性物质的含量。金银花叶可用水、不同浓度的甲醇或乙醇进行提取,乙醇对HPLC有溶剂干扰;水的极性较大,能提取极性较大的成分且提取的组分较为单一、提取液过滤困难;不同浓度的甲醇较适宜做提取测定。其中50%甲醇提取效果最好,提取成分较多,峰形好且整体分离效果较好,因此选用50%甲醇提取金银花叶活性物质。

图2 不同超声时间提取色谱图Fig.2 HPLC chromatogram of different ultrasonic extraction time

图3 不同溶剂提取的色谱图Fig.3 HPLC chromatogram of different extraction solvents
2.3 方法学评价
2.3.1 回收率 取同一样本按1.2.3项方法平行制备溶液2份,在其中一份样品中加一定量的绿原酸(2号峰)平行测定3次,计算出样品的含量及方法的回收率,结果见表2。

表2 回收率试验结果Tab.2 The results of recovery rate test
由表2可知,样品加标的平均回收率达99.46%,RSD为1.83%,方法的准确性高。
2.3.2 仪器精密度 取同一供试品溶液,按上述色谱条件,连续测定6次,以“中药色谱指纹图谱相似度评价系统”(版本2004A)进行数据处理,输出9个共有峰保留时间的RSD 0.17%~0.29%,峰面积RSD为 0.52%~2.7%,仪器精密度良好。
2.3.3 稳定性考察 取同一供试品溶液,按上述色谱条件,于0 h、5 h、10 h、15 h、1 d、5 d测定,以“中药色谱指纹图谱相似度评价系统”(版本2004A)进行数据处理,输出9个共有峰保留时间的RSD 0.21%~0.28%,峰面积RSD为0.65%~2.8%,结果表明,样品测试液放在冰箱中冷藏,组分的性质稳定,5 d内未见明显变化。
2.3.4 重现性考察 准确称取同一供试样品6份,按1.2.3项方法制备供试品溶液,按上述色谱条件测定,以“中药色谱指纹图谱相似度评价系统”(版本2004A)进行数据处理,输出9个共有峰保留时间的RSD 0.31%~0.38%,峰面积 RSD 为 0.61%~2.7%,6 个样品色谱图相似度经分析大于 0.97,证明提取工艺及分析方法的重现性良好。
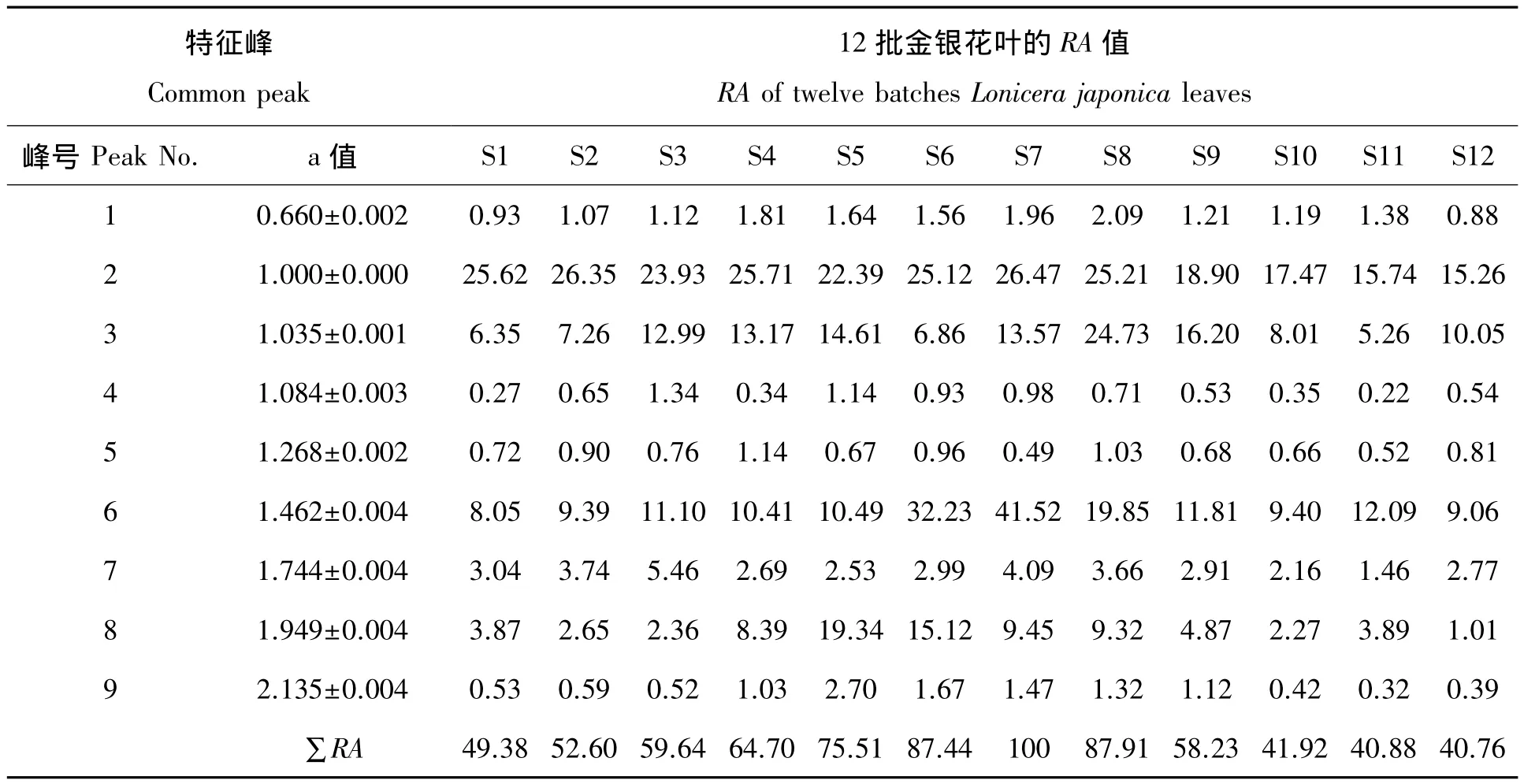
表3 12批金银花叶的9个特征峰的相对保留值a和相对峰面积值RATab.3 Relative retention time(a)and areas(RA)of common peaks for fingerprint of twelve batches Lonicera japonica leaves
2.4 指纹图谱的建立
在同一个色谱条件下,对收集的12批金银花叶进行测定,比较样品的HPLC指纹图谱,得9个共有特征峰,并且它们峰面积之和占总峰面积的90%以上,因此确定这9个峰为共有指纹峰。本试验中绿原酸的出峰时间居中(出峰时间21.72 min,2号峰)各样品中均具有较高含量,且为金银花产品的主要功能成分,选择绿原酸为内参照峰,按照文献[19]的计算方法得出各样品的特征峰的相对保留时间值a。12批样品以7号金银花叶的特征峰面积总和最大,再以7号金银花作对照,按照文献[20]的计算方法得出各样品的特征峰的相对峰面积值RA。结果见表3,指纹图谱见图4。
通过RA值的比较,可以清楚地知道各样品中具有相同a值组分的相对含量为多少。从表3可以看出,7号样品的∑RA值明显比其它样品高,它绿原酸的RA值也最高,属于质地最好的药材。特征峰的a值偏差较小,可见该指纹图谱法重现性好,通过相对峰面积的比较就可以大致识别金银花叶的质量,结果准确。
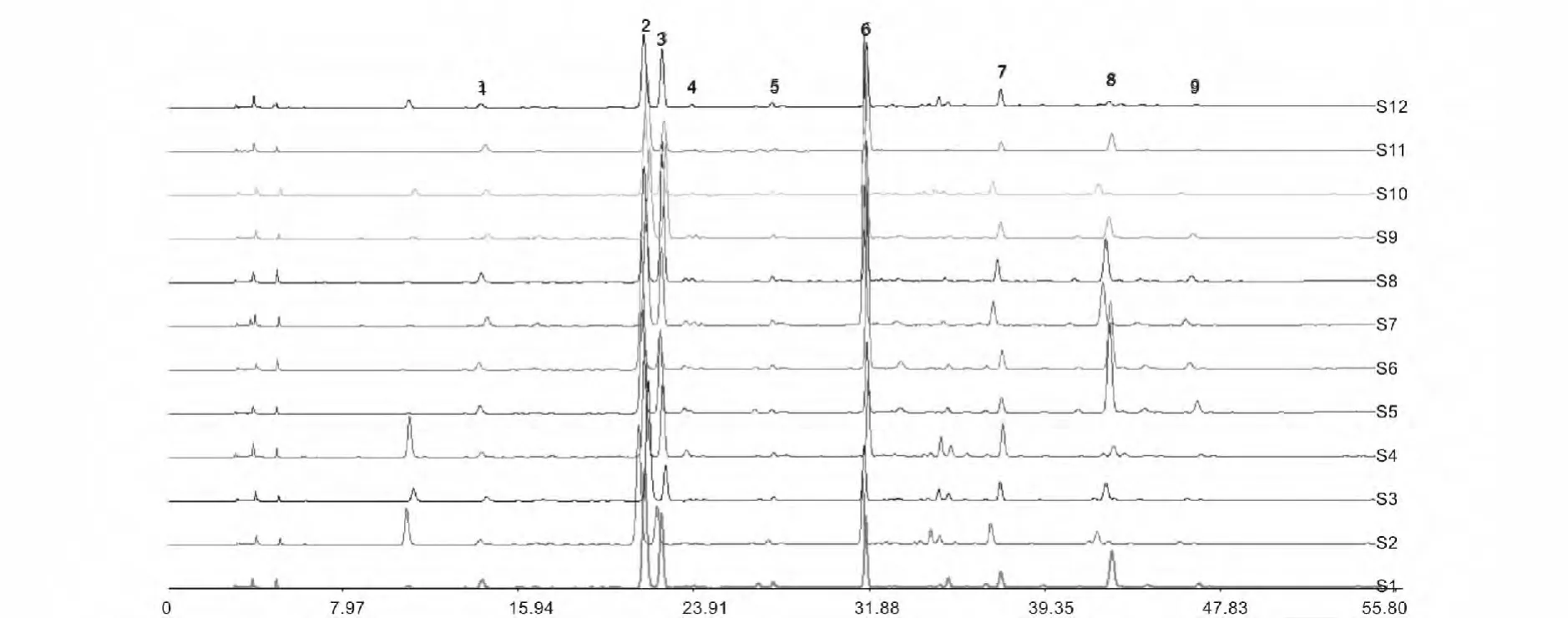
图4 不同月份采收金银花叶HPLC指纹图谱Fig.4 HPLC fingerprint of Lonicera japonica leaves in diferent collecting time
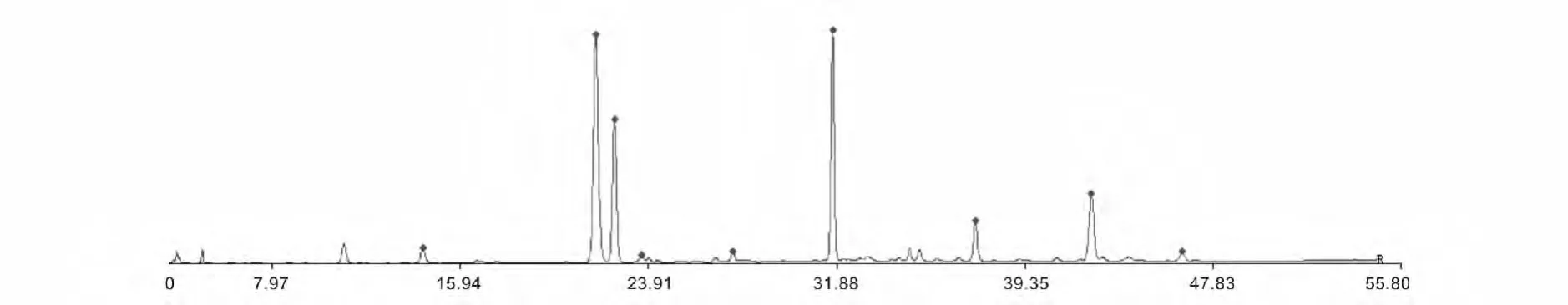
图5 不同采收月份对照色谱图Fig.5 The reference chromatogram of Lonicera japonica leaves in diferent collecting time
将12个不同月份采收金银花叶样品图谱数据导入中药色谱指纹图谱相似度计算软件(版本2004A)进行数据处理,采用自动匹配方法进行相似性分析。用中位数法生成对照谱图(图5),时间窗宽度为0.5 min,与对照谱图比较,计算12个不同月份样品的相似度系数。结果见表4。
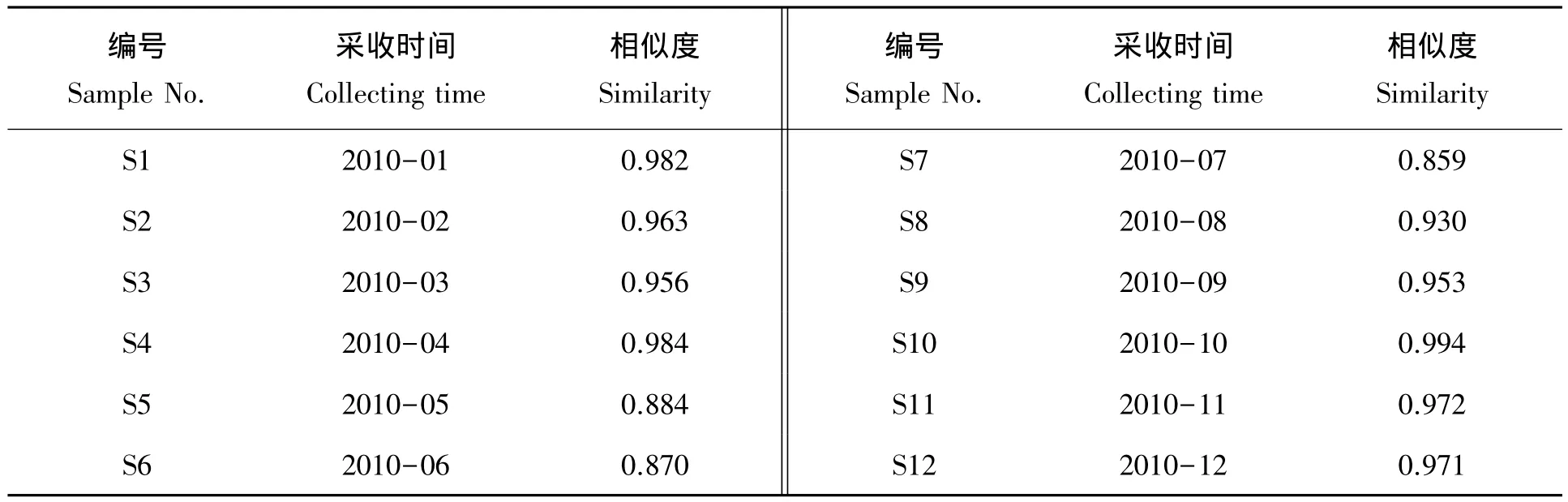
表4 不同月份采收金银花叶药材相似度结果Tab.4 HPLC chromatogram similarity of Lonicera japonica leaves in diferent collecting time
从色谱图及表4上可以看出,1、2、3、4、8、9、10、11、12月份采收的金银花叶与对照谱图相似度较高,在 0.93 以上,而 5、6、7 与对照谱图相似度稍低,分别为 0.884、0.870、0.859。
2.5 金银花叶最佳采收期的选择
将峰面积最大的2号峰(绿原酸)峰面积及总峰面积与采收月份做柱形图(图6),从图6可以看出,绿原酸在1、2、3、4月含量均较高,5月份较低,6月份有上升趋势,7月份达到最高,8月份之后开始下降,至12月份最低,可能的原因是金银花植物在春天时大量生长,产生较多的酚性物质,而5月份开花,多酚类物质会从叶片中向花中运输,从而产生低点,这与李杨昕等[21]研究发现葡萄植株的酚类物质在结果期间会大量向果实运输产生低点相一致,之后的6、7月,天气晴好,光合作用旺盛,又产生大量的酚性物质,Ning等[22]利用采后的金银花进行试验也发现紫外照射能促进产生次生代谢物质。而总峰面积积累的规律则是从1月份一路上升,到7月份达最高峰,8月份之后开始下降。在7月绿原酸含量最高时,总峰面积也最大,并且此时花已收获,植株需修枝剪叶,因而,金银花叶片最佳的采收期为7月。

图6 不同月份采收金银花叶绿原酸、总峰峰面积图Fig.6 Area of chlorogenic acid peak and the total peak of different collecting time Lonicera japonica leaves HPLC chromatogram
3 讨论与结论
单一地测定一个或几个成分不能全面地反映中药材的内在质量,不能满足对中药材深入研究的需要,指纹图谱技术是指采用现代分析手段测定得到的能够标示样品中共有特性的图谱,从多组分的角度反映原材料的内在特征[23-24],并且方法回收率高、重现性、精密性、稳定性均较好,具有一定科学性。
研究[25]显示,植物在不同生长期内成分会产生较大差异影响品质,目前关于金银花叶不同生长期质量变化规律、品质鉴别和最佳采收期的研究工作较少,本文通过对一年中逐月采收得到的12批样本的HPLC指纹图谱进行研究,不同月份金银花叶指纹峰之间即有相关性,又有差异,主要体现在化学成分上较为相似,但相对峰面积并不相同,说明各样品内在质量有差别,12份样品相似性来看,1、2、3、4、8、9、10、11、12月份采收的金银花叶与对照谱图相似度较高,在 0.93以上,而 5、6、7月与对照谱图相似度稍低,分别为 0.884、0.870、0.859,说明在 5、6、7月的药材成分变化较大,同时比较 2 号峰(绿原酸)峰面积及总峰面积,均以7月份最大,并且此时花已收获,植株需修枝剪叶,因此,金银花叶最佳采收期为7月。
金银花叶有效成分中含有较多的酚性物质,与50%甲醇极性相似,采用50%甲醇作为溶剂,超声提取,超声波产生机械振动和空化作用,提取效果较好,但超声波同时产生热效应,时间长了会对酚性物质具有破坏作用,因而,提取时间不能过长,30 min为宜。
金银花叶成分丰富,体系复杂,并含有较多酸性酚类成分,高效液相检测时选用Alltech Alltima C18色谱柱(250 mm×4.6 mm i.d.,5 μm)梯度洗脱,流动相以乙腈-水体系为好,流速较慢为 0.7 mL/min,加入磷酸有助于解决酸性成分的拖尾现象,温度40℃,检测波长238 nm。
[1]Shang X F,Pan H,Li M X,et al.Lonicera japonica Thunb.:Ethnopharmacology,phytochemistry and pharmacology of an important traditional Chinese medicine[J].Journal of Ethnopharmacology,2011,138(1):1-21.
[2]葛冰,卢向阳,易克,等.金银花活性成分、药理作用及其应用[J].中国野生植物资源,2004,23(5):13-15.
[3]Rahman A,Kang S C.In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb[J].Food Chemistry,2009,116(3):670-675.
[4]Qian Z M,Li H J.Simultaneous qualitation and quantification of thirteen bioactive compounds in Flos Lonicerae by high-performance liquid chromatography with diode array detector and mass spectrometry[J].Chemical and Pharmaceutical Bulletin,2007,55(7):1073-1076.
[5]Sun C H,Teng Y,Li G Z,et al.Metabonomics study of the protective effects of Lonicera japonica extract on acute liver injury in dimethylnitrosamine treated rats[J].Journal of Pharmaceutical and Biomedical Analysis,2010,53(1):98-102.
[6]Rumalla C S,Avula B,Zhao J P,et al.Quantitative determination of phenolic acids in Lonicera japonica Thunb using high performance thin layer chromatography[J].Journal of Liquid Chromatography & Related Technologies,2011,34(1):38-47.
[7]武雪芬,李玉贤,魏炜,等.金银花越冬老叶有效成分测定[J].中药材,1997,20(1):6-7.
[8]刘婵娟,陈四平.忍冬叶的化学成分[J].中国实验方剂学杂志,2010,16(17):90-92.
[9]赵彦杰.金银花叶提取物的抑菌效果研究[J].食品科学,2007,28(7):63-65.
[10]孙德梅.金银花叶提取物的抗氧化活性和抑菌作用研究[J].河南科学,2002,20(5):511-513.
[11]张宁,曹光群.金银花叶的抑菌活性和抗氧化性研究[J].牙膏工业,2008(3):29-32.
[12]Xiong J H,Li S C,Wang W J,et al.Screening and identification of the antibacterial bioactive compounds from Lonicera japonica Thunb.leaves[J].Food Chemistry,2013,138(1):327-333.
[13]李世传,熊建华,罗秋水,等.不同干燥方法对金银花叶成分和抑菌效果的影响[J].中国食品学报,2012,12(12):78-83.
[14]Wei H,Sun L N,Taia Z G,et al.A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera[J].Analytica Chimica Acta,2010,662(1):97-104.
[15]Jin X F,Lu Y H,Wei D Z,et al.Chemical fingerprint and quantitative analysis of Salvia plebeia R.Br.by high-performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis,2008,48(1):100-104.
[16]Shen D D,Wu Q L,Sciarappa W J,et al.Chromatographic fingerprints and quantitative analysis of isoflavones in Tofu-type soybeans[J].Food Chemistry,2012,130(4):1003-1009.
[17]Kong W J,Wang J B,Zang Q C,et al.Fingerprint-efficacy study of artificial Calculus bovis in quality control of Chinese materia medica[J].Food Chemistry,2011,127(3):1342-1347.
[18]Li Y,Wu T,Zhua J H,et al.Combinative method using HPLC fingerprint and quantitative analyses for quality consistency evaluation of an herbal medicinal preparation produced by different manufacturers[J].Journal of Pharmaceutical and Biomedical Analysis,2010,52(4):597-602.
[19]王倩,王建新,于治国,等.金银花药材高效液相色谱指纹图谱研究[J].中成药,2005,27(7):751-754.
[20]胡海山,余燕影,万春花,等.金银花的高效液相色谱指纹图谱和聚类分析[J].南昌大学学报:理科版,2009,33(3):253-256.
[21]李杨昕,张元湖,田淑芬,等.玫瑰香葡萄生长期酚类物质含量及抗氧化活性的变化[J].园艺学报,2007,34(5):1093-1097.
[22]Ning W,Peng X,Ma L Y,et al.Enhanced secondary metabolites production and antioxidant activity in postharvest Lonicera japonica Thunb.in response to UV radiationInnovative[J].Food Science & Emerging Technologies,2012,13(5):231-243.
[23]曹慧,李祖光,沈德隆.桂花品种香气成分的GC/MS指纹图谱研究[J].园艺学报,2009,36(3):391-39.
[24]Zhou J L,Qi L W,Li P.Quality control of Chinese herbal medicines with chromatographic fingerprint[J].Chinese Journal of Chromatography,2008,26(2):153-159.
[25]王祥培,吴红梅,王祥森,等.不同采收期头花蓼药材指纹图谱相似度评价[J].时珍国医国药,2010,21(11):2980-2981.

