大鼠Ⅰ型肺泡上皮细胞的分离、培养及生物学特性研究
李勇,杜娟,余静,王海燕,岳彩黎,曾灵,蒋建新
肺泡上皮(alveolar epithelium)由两种细胞组成,即Ⅰ型肺泡上皮细胞(alveolar type Ⅰ cell,ATI)和Ⅱ型肺泡上皮细胞(alveolar type Ⅱ cell,ATⅡ)。传统的观点认为ATⅡ是肺泡上皮中具有生物学活性的细胞,而终末分化的ATI只是被动地参与气血屏障的形成,不增殖,也不具有可塑性[1]。但最近的研究发现ATI可能不只是传统意义上的终末分化细胞,而具有多样的生物学功能,并在损伤修复过程中发挥一定作用[2]。虽然ATI数量只占全肺总细胞数的8%,但却覆盖了95%~98%的肺泡表面积[3]。ATI参与气血屏障的形成,对于正常的换气功能非常重要。由于ATI易破裂,缺少生物学标记,分离相对困难,因此目前针对ATI的研究主要采用由ATⅡ分化而来的ATI样细胞,但其生物学特性与ATI细胞存在一定差异[4]。T1α是一种跨膜蛋白,研究表明其在肺脏中特异性表达于ATI细胞[5],已广泛应用于ATI细胞的分离与鉴定[6-9]。本研究的目的是改良细胞分离方法,利用酶消化法、IgG贴壁法和免疫磁珠技术等分离得到高纯度的原代ATI,并初步观察其生物学特性,为研究以ATI损伤为特征的肺部疾病提供可靠的体外模型。
1 材料与方法
1.1 实验动物 SPF级雄性SD大鼠,体重约120g,由第三军医大学大坪医院实验动物中心提供,生产许可证号SCXK(渝)2012-0005,使用许可证号SYXK(渝)2012-0010。
1.2 主要试剂及仪器 EDTA、EGTA、DAPI(Sigma公司),Dispase(BD公司),DNase Ⅰ、兔抗大鼠Podoplanin多克隆抗体(Sigma-Aldrich公司),高糖DMEM培养基、RPMI 1640培养基(Hyclone公司),胎牛血清(FBS,Gibco公司),大鼠IgG(中杉金桥公司),磁珠包被的抗兔IgG(Miltenyi Biotec公司),山羊抗大鼠小窝蛋白1(caveolin-1,Cav-1)多克隆抗体、兔抗大鼠水通道蛋白5(AQP5)多克隆抗体、兔抗大鼠Ki67(Abcam公司),兔抗大鼠表面活性蛋白C前体(pro-SPC)多克隆抗体(Millipore公司),驴抗山羊IgG/AF549、驴抗兔IgG/AF488(Invitrogen公司),山羊抗兔IgG/TRITC(中杉金桥公司),正常驴血清(Jackson公司)。CO2培养箱(Thermo公司),倒置显微镜(Leica公司),活细胞工作站(API公司)。
1.3 实验方法
1.3.1 肺脏单细胞悬液的制备 大鼠称重、麻醉,全身肝素化,采用无菌PBS(含50U/ml肝素)灌肺至完全变白;用37℃预热的PBS(pH7.4,5mmol/L EGTA,5mmol/L EDTA)灌洗肺泡腔3次;向肺中灌入10ml预热的Dispase(10U/ml),37℃消化40min,其间配合机械摇动;消化完毕后保留肺叶,加入1ml分散液(RPMI 1640培养基,20% FBS,100μg/ml DNase Ⅰ),充分剪碎;用100μm滤网过滤1次、40μm滤网过滤2次后收集滤液,离心弃上清,重悬细胞沉淀,获得单细胞悬液。
1.3.2 ATI的纯化 将单细胞悬液转移至大鼠IgG包被的培养皿中,37℃孵育60min。收集未贴壁细胞,离心后重悬于0.5ml 抗体孵育液中(RPMI 1640培养基,1%FBS,50μg/ml DNase Ⅰ);加入5μg兔抗大鼠T1α,4℃摇床上孵育35min,用PBS(pH7.2,0.5%BSA,2mmol/L EDTA)漂洗2次,将细胞离心后重悬于80μl抗体孵育液中,加入20μl磁珠标记的山羊抗兔IgG,4℃孵育15min;用PBS(pH7.2,0.5%BSA,2mmol/L EDTA)漂洗1次后过分选柱2次;用PBS(pH7.2,0.5%BSA,2mmol/L EDTA)漂洗4次,每次0.5ml;取出分选柱,收集阳性细胞。取少量进行细胞计数和台盼蓝染色判断活力。
1.3.3 ATI的培养 细胞以2×104/cm2密度接种于培养皿中,加入高糖DMEM培养基、10%FBS、100μg/ml青霉素和链霉素,在5%CO2、37℃恒温育箱中孵育。
1.3.4 ATI的纯度鉴定 计数并调整细胞浓度至1×106个/ml,细胞爬片,次日将玻片放在丙酮溶液中并置于冰上固定15min,10%山羊血清37℃封闭1h,加入驴抗山羊IgG/AF549(1:400),37℃避光孵育1h,DAPI染核,封片,观察并采集荧光。镜下随机视野计数细胞,计算阳性细胞百分比。
1.3.5 ATI表型鉴定 取培养5d的ATI细胞爬片放在丙酮溶液中并置于冰上固定,10%山羊血清封闭,实验组加入一抗(山羊抗大鼠Caveolin-1多克隆抗体,工作浓度1:100;兔抗大鼠AQP5多克隆抗体,工作浓度1:400;兔抗大鼠proSPC多克隆抗体,工作浓度1:1000;兔抗大鼠Ki67抗体,工作浓度1:200)孵育液,对照组加等量PBS,4℃过夜孵育,次日在37℃孵箱中复温;加入二抗(驴抗山羊IgG/AF594,工作浓度1:400;山羊抗兔IgG/TRITC,工作浓度1:200;驴抗兔IgG/AF488,工作浓度1:400;驴抗兔IgG/AF488,工作浓度1:400)孵育液,37℃避光孵育,DAPI染核。
1.3.6 生长曲线的绘制 取原代分离的ATI接种于12孔板,每孔2×104个细胞,共接种2板。48h后开始计数,以后每隔48h计数1次,每次计数3孔,计算平均值和标准差。具体计数方法:吸弃培养孔的培养基,PBS漂洗2次,加入0.5ml预热的0.25%胰酶,37℃消化5~7min,其间轻拍孔底数次,待镜下观察见全部细胞悬浮后,将细胞转移至1.5ml EP管,1000r/min离心5min,弃上清,用100μl PBS重悬细胞,充分混匀,取10μl细胞计数,数4个大格中的细胞总数。每孔的细胞数=(4大格细胞总数/4)×104×0.1。
2 结 果
2.1 ATI的产量及活力 每只体重120g左右的SD雄性大鼠可分离获得的ATI细胞数为(2.1±0.5)×106个,台盼蓝染色显示其活力为93.8%±1.6%。
2.2 ATI纯度鉴定 分离出细胞后进行细胞爬片,免疫荧光染色检测其T1α的表达,结果显示其阳性率为91.0%±0.6%(图1A–C),分选阴性细胞不表达T1α(图1D)。
2.3 ATI的生物学特性
2.3.1 ATI的生长规律 倒置显微镜观察细胞的生长规律,培养1d时,细胞贴壁但是仍然保持圆形以及致密状(图2A)。培养3d时,ATI完全贴壁、伸展,出现伪足(图2B),包括板状伪足和丝状伪足。培养7d时,细胞汇合形成单层扁平状,形态多样,呈多边形、类圆形、梭形(图2C)。
2.3.2 ATI表型检测 培养5d的细胞呈单层扁平状,呈多边形,免疫荧光染色显示Cav-1、AQP5阳性,pro-SPC阴性(图3)。

图1 细胞纯度的鉴定(DAPI ×200)Fig. 1 Purity identification of alveolar type Ⅰ cells (DAPI ×200)
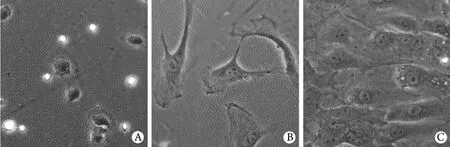
图2 原代培养ATI的形态(倒置显微镜 ×200)Fig. 2 Morphology of primary cultured alveolar type Ⅰ cells (Inverted microscope ×200)

图3 原代培养ATI的表型(DAPI ×600)Fig. 3 Phenotype of primary cultured alveolar type Ⅰ cells (DAPI ×600)
2.3.3 ATI的增殖能力 接种第1~3天,细胞贴壁、伸展,数量较稳定,从第4天开始,细胞生长加速,约第8天开始进入对数增长期,对数增长期细胞倍增时间约为66h,直至第12天细胞出现接触抑制、增殖减慢。体外培养的细胞生长曲线见图4。免疫荧光检测显示,体外培养的ATI表达增殖相关抗原Ki67,表明其能够体外增殖。
3 讨 论
肺脏是一个具有多重组织结构的复杂的分支器官,由来自内胚层和中胚层的多种细胞组成,据估计含有40~60种细胞[10]。肺脏由于其独特的解剖结构及与外界相通的特征,是各种危重疾病时最易受累的靶器官,如在严重创伤时易出现急性肺损伤(acute lung injury,ALI)[11]。肺损伤后修复的关键之一是肺泡上皮的修复,既往相关研究主要关注于ATⅡ,但近年发现ATI可能不只是传统意义上的终末分化细胞,同时还具有多种生物学功能[2]。Yamamoto等[12]研究发现在肺炎球菌引起的肺炎中ATI参与了固有免疫反应。Wong等[13]研究发现采用LPS刺激ATI细胞能够产生细胞因子,且该效应受肾素-血管紧张素系统调节。以上研究表明ATI除了传统的对水和离子的转运功能外,还具有一定的免疫调节作用。因此,分离出高纯度的ATI对以其损伤为特征的肺部疾病的体外研究具有重要意义。

图4 ATI生长曲线Fig. 4 Growth curve of primary cultured alveolar type Ⅰ cells
本研究参照已报道的分离纯化ATI的方法[6-9],并结合实际情况进行了改良。首先,关于实验动物的选择,各实验室差别较大,所用动物体重从100~300g不等,本研究选择120g左右的SD大鼠,因为该体重大鼠肺泡已经发育成熟[14],且肺部质量较好。第二,关于消化酶的选择,目前国内文献分离肺泡上皮细胞多采用胰蛋白酶,国外文献通常采用弹性蛋白酶。胰酶消化后获取的细胞特异性不强,且对细胞损伤较大,弹性蛋白酶虽然对上皮具有一定特异性,对细胞损伤较小,但是价格昂贵,不易获得。本研究采用的中性蛋白酶又称分散酶,是一种非特异性的金属蛋白酶,作用迅速有效且温和,能保持细胞的完整性,对细胞膜无损伤,同时该酶为非哺乳动物来源,无被支原体或动物病毒污染的风险,对温度、pH改变以及血清成分都很稳定,已被广泛应用于肺脏干/祖细胞的分离。第三,在纯化步骤中,采用大鼠IgG贴壁筛选去除细胞膜上具有Fc片段的免疫细胞(主要是巨噬细胞),因为部分巨噬细胞和其他免疫细胞亚群也表达ATI特异性标志物T1α[15];贴壁时间选择60min,因为时间过长ATI细胞也会贴壁[11]。第四,在分选步骤中,以T1α作为特异性标志物,通过磁珠分选获得高纯度的ATI,与流式分选相比,该方法的操作相对简单,分离时间短,对细胞的损伤小,获得细胞的活力好。
本研究通过倒置显微镜观察细胞生长状况、采用免疫荧光检测其特异性蛋白的表达、绘制细胞生长曲线了解所获ATI的生物学特性。结果显示,ATI细胞呈集落样生长,胞质丰富,培养7d后汇合形成单层扁平样细胞。免疫荧光检测时选择T1α[15]、AQP5[16]、Caveolin-1[17]作为阳性标志物,因为它们在肺脏中特异性表达于ATI。T1α是一种高度保守的跨膜蛋白,在正常组织和肿瘤中均可表达,对心脏、肺、淋巴系统的发育具有重要作用[5,15]。AQP5是水通道蛋白的一个亚群,参与水的代谢[16],免疫荧光染色可见其在胞膜上有一定聚集现象,与文献报道一致[6,9],但是具体原因目前尚不清楚,可能与AT1细胞的功能相关,因为AT1细胞参与气血屏障的形成,在水和离子转运过程中发挥重要作用。Caveolin-1是膜整合蛋白,在信号转导、胆固醇代谢、细胞内化及肿瘤转移、肌细胞合成等方面具有重要作用[17]。生长曲线显示ATI和传统意义上的终末分化细胞不同,在体外能够增殖,对数生长期的倍增时间约为66h。
综上所述,本实验通过改良单细胞制备及分选操作从成年大鼠肺脏中分离出了纯度较高的ATI,并初步观察了其生物学特性,培养后细胞生长良好,可以为后续以ATI损伤为特征的肺部疾病的研究提供可靠的体外模型。
[1]Weibel ER. A note on differentiation and divisibility of alveolar epithelial cells[J]. Chest, 1974, 65(Suppl): 19S-21S.
[2]Zea B, Edward DC. More life for a "terminal" cell[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(6): L1042-L1044.
[3]Stone KC, Mercer RR, Gehr P, et al. Allometric relationships of cell numbers and size in the mammalian lung[J]. Am J Respir Cell Mol Biol, 1992, 6(2): 235-243.
[4]Dobbs LG, Johnson MD, Vanderbilt J, et al. The great big alveolar TI cell: evolving concepts and paradigms[J]. Cell Physiol Biochem, 2010, 25(1): 55-62.
[5]Williams MC, Cao Y, Hinds A, et al. T1 alpha protein is developmentally regulated and expressed by alveolar type I cells,choroid plexus, and ciliary epithelia of adult rats[J]. Am J Respir Cell Mol Biol, 1996, 14(6): 577-585.
[6]Wang S, Hubmayr RD. Type I alveolar epithelial phenotype in primary culture[J]. Am J Respir Cell Mol Biol, 2011, 44(5):692-699.
[7]Randell SH, Fulcher ML. Epithelial cell culture protocols[M]. 2nd ed. London: Springer Science Business Media, 2013. 145-159.
[8]Chen J, Chen Z, Narasaraju T, et al. Isolation of highly pure alveolar epithelial type I and type II cells from rat lungs[J]. Lab Invest, 2004, 84(6): 727-735.
[9]Downs CA, Montgomery DW, Merkle CJ. Cell culture models using rat primary alveolar type I cells[J]. Pulm Pharmacol Ther,2011, 24(5): 577-586.
[10]Bertoncello I, McQualter JL. Endogenous lung stem cells: what is their potential for use in regenerative medicine[J]? Respir Med, 2010, 4(3): 349-362.
[11]Thompson BT, Moss M. A new definition for the acute respiratory distress syndrome[J]. Semin Respir Crit Care Med,2013, 34(4): 441-447.
[12]Yamamoto K, Ferrari JD, Cao Y, et al. Type I alveolar epithelial cells mount innate immune responses during pneumococcal pneumonia[J]. J Immunol, 2012, 189(5): 2450-2459.
[13]Wong MH, Chapin OC, Johnson MD. LPS-stimulated cytokine production in type I cells is modulated by the renin-angiotensin system[J]. Am J Respir Cell Mol Biol, 2012, 46(5): 641-650.
[14]Ornitz DM, Yin Y. Signaling networks regulating development of the lower respiratory tract[J]. Cold Spring Harb Perspect Biol,2012, 4(5): a008318.
[15]Astarita JL, Acton SE, Turley SJ. Podoplanin: emerging functions in development, the immune system, and cancer[J]. Front Immunol, 2012, 3: 283.
[16]Borok Z, Lubman RL, Danto SI, et al. Keratinocyte growth factor modulates alveolar epithelial cell phenotype in vitro: expression of aquaporin 5[J]. Am J Respir Cell Mol Biol, 1998, 18(4): 554-561.
[17]Newman GR, Campbell L, von Ruhland C, et al. Caveolin and its cellular and subcellular immunolocalisation in lung alveolar epithelium: implications for alveolar epithelial type I cell function[J]. Cell Tissue Res, 1999, 295(1): 111-120.

