水蕹菜浮床对草鱼主养池塘轮虫群落结构的影响
李 爽 谢从新 何绪刚 张 敏 游 鑫 董加沙 黄海平 段晓姣
(1. 华中农业大学水产学院, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心, 武汉 430070;3. 沧州市农牧局, 沧州 061000)
由于我国传统池塘结构上只有蓄水养殖功能,缺乏必要的水体净化功能, 饲料和肥料等投入产生的累积导致水质恶化严重[1]。近年来已深入开展了养殖池塘水质净化和修复技术研究以改善养殖环境、提高养殖效率, 其中生物浮床技术最受关注。典型的湿式有框浮床组成包括 4部分: 浮床框体、浮床床体、浮床基质和浮床植物[2]。水蕹菜作为浮床植物因其生长周期长、花期晚、净化能力强等特点倍受研究人员的青睐。研究表明, 水蕹菜浮床对养殖水质有良好的净化作用[3—6]。此外, 水蕹菜浮床还为池塘中不同藻类创造适宜的生存空间, 提高了池塘藻种数、优势种数量和多样性指数[7]。但水蕹菜浮床对池塘浮游动物群落结构的影响并未报道。轮虫是浮游动物的重要组成部分之一, 轮虫个体较小, 但它的发育时间短, 周转快, 生产量高, 通常整个浮游动物生产量的 10%—44%由其提供[8], 所以轮虫在水生态系统结构、功能和生物生产力等方面具有重要作用。因此, 研究水蕹菜浮床对养殖池塘轮虫群落结构的影响十分必要, 其结果对完善水蕹菜浮床等池塘水质原位修复技术具有重要的参考价值。
1 材料与方法
1.1 试验池塘
试验池塘为湖北省崇湖渔场 6口面积同为7000 m2的草鱼主养池塘, 水深1.5 m左右, 其中浮床池塘4口, 非浮床池塘2口, 各池塘鱼类放养量基本一致。
1.2 浮床的构建
使用本课题组优选的适合华中地区浮床栽培的大叶白梗水蕹菜构建生物浮床, 浮床覆盖率为7.5%[9]。浮床与采样点的设置见图1。
1.3 样品采集与测定

图1 浮床与采样点的布置图Fig. 1 The floating beds and sampling sites
采样: 6月下旬浮床铺设完毕, 进行第1次采样,此后每月下旬采样1次, 至10月底结束, 共采集5次样品。晴天上午进行采样, 现场测定溶解氧(DO)、水温(T)、pH和透明度; 每个采样点在距水面和水底30 cm处各采水5 L进行混合, 取500 mL作测定TN、TP等水化学指标之用, 取300 mL加1 mL 1%碳酸钙溶液避光保存作测定叶绿素 a(Chl. a)之用,取1L混合水样现场加鲁哥氏液固定, 经48h沉淀浓缩后添加甲醛保存, 用以轮虫的定量分析; 轮虫的定性样本用25号浮游生物网在水面以“∞”形拖取采集。
测定: DO、T和pH用HACH58258-00测定; 透明度用萨氏盘测定; 水化学指标测定方法参照文献[10]; 浮游动物的定性和定量采集和测定方法参照文献[11,12]。
1.4 轮虫优势种
根据优势度(Y)确定, 视Y≥0.02的种类为优势种。
1.5 轮虫多样性
按下式计算轮虫的多样性指数和均匀度指数:


式中: Pi为第i种轮虫类的个体数; S为轮虫总种数;N为观察到的轮虫总数。
1.6 数据分析与统计
采用SPSS 13.0分析浮床池塘与非浮床池塘间的理化指标以及浮游动物种群差异。
2 结果
2.1 理化指标的变化情况
池塘水体理化指标见表 1。池塘水温变化于16.3—33.6℃, 平均 26.3℃, 适宜鱼类和水蕹菜生长,不同类型池塘水温无显著差异; 不同类型池塘表底响不显著(P>0.05), 实验结果与其他学者的研究结果基本一致[9,13,14]。
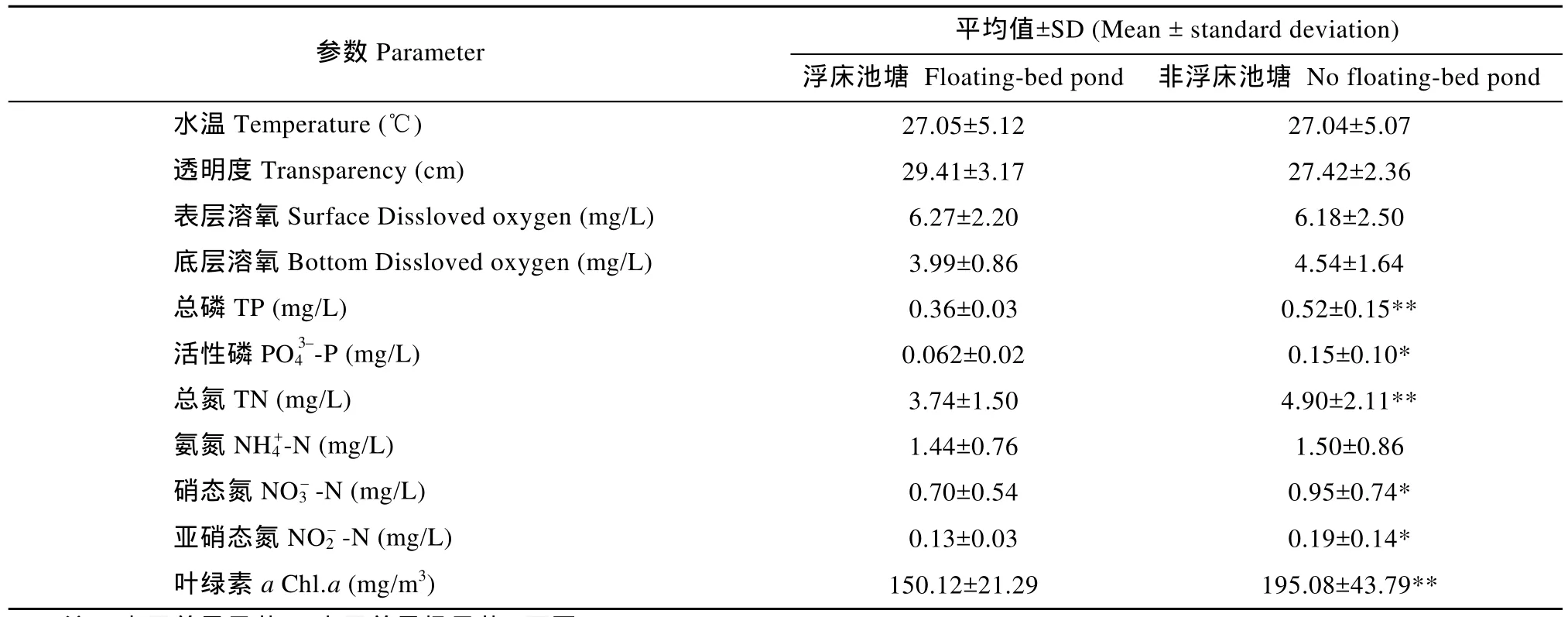
表1 池塘水体理化指标Tab. 1 Physical and chemical indicators of pond water
2.2 轮虫种类组成与多样性
共检出轮虫38种, 隶属于2纲14属, 其中臂尾轮虫属出现的种类最多。浮床池塘出现轮虫 36种,非浮床池塘出现轮虫 28种(表 2); 浮床池塘轮虫多样性指数及均匀性指数均显著高于非浮床池塘(P<0.05)(表 3)。
2.3 轮虫优势种
浮床池塘与非浮床池塘轮虫优势种组成基本类似(表4), 萼花臂尾轮虫(Brachionus calyciflorus)、裂足臂尾轮虫(Brachionus diversicornis)、裂痕龟纹轮虫(Anuraeopsis fissa)、暗小异尾轮虫(Trichocerca pusilla)以及长肢多肢轮虫(Polyarthra dolichoptera)为共有优势种, 转轮虫(Rotaria rotatoria)从 8月份开始成为优势种, 角突臂尾轮虫(Brachionus angularis)和三肢轮虫(Filinia longiseta)仅在10月份时才成为非浮床池塘优势种。
2.4 轮虫密度和生物量
在实验期间, 浮床池塘轮虫平均密度[(1892±228) ind./L]显著低于非浮床池塘[(2255± 630) ind./L](P<0.01)。浮床池塘轮虫月变化幅度较小(图2A), 而非浮床池塘在 7月份和 9月份出现了两次高峰, 8月份出现低谷, 10月份又回落到 6月份水平(图2B)。非浮床池塘轮虫密度月变化与其主要优势种—裂痕龟纹轮虫和暗小异尾轮虫密度剧烈波动相关(图 3A、B)。
在实验期间, 浮床池塘裂痕龟纹轮虫密度[(522±337) ind./L, 占轮虫总密度的24%]与暗小异尾轮虫密度[(347±128) ind./L, 占轮虫总密度的18%]之和占轮虫总密度的 42%; 非浮床池塘裂痕龟纹轮虫密度[(550±152) ind./L, 占轮虫总密度的 28%]与暗小异尾轮虫密度[(486±418) ind./L, 占轮虫总密度的22%]之和约占轮虫总密度的 50%, 其过高的密度增加了非浮床池塘轮虫的小型化趋势(图3A、B)。
个体相对较大的萼花臂尾轮虫和裂足臂尾轮虫在浮床池塘平均密度分别为(131±42)和(309±105) ind./L, 占轮虫平均密度的 6%和16%; 在非浮床池塘平均密度分别为(76±42)和(126.5±96) ind./L,占轮虫的平均密度的 3%和 5%。在浮床池塘中, 裂足臂尾轮虫和萼花臂尾轮虫优势度各月份均高于非浮床池塘。浮床池塘中大个体优势轮虫密度显著大于非浮床池塘(P<0.05), 有助于减缓浮床池塘轮虫的小型化(图3C、D)。
浮床池塘中的长肢多肢轮虫和转轮虫的平均密度分别为(191±69)和 (63±51) ind./L, 占轮虫平均密度的10%和3%; 非浮床池塘中的长肢多肢轮虫和转轮虫平均密度分别为(211±56)和(120±117) ind./L,占轮虫平均密度的9%及5%。长肢多肢轮虫在不同类型池塘中的优势度不稳定, 浮床池塘与非浮床池塘长肢多肢轮虫差异不显著(P>0.05); 而非浮床池塘转轮虫密度显著大于浮床池塘(P<0.05)(图 3E、F)。
浮床池塘轮虫平均生物量[(1.405±0.197) mg/L]与非浮床池塘[(1.535±0.602) mg/L]差异不显著(P>0.05)。浮床池塘轮虫生物量6—8月份保持平稳,9月份开始降低, 且 9月份生物量显著低于非浮床池塘(P<0.05); 非浮床池塘轮虫生物量 6—9月份呈递增趋势, 10月份显著下降至浮床池塘水平(图2B)。

图2 不同类型池塘轮虫密度及生物量变化Fig. 2 Rotifer density and biomass in different types of ponds

表2 轮虫种类组成Tab. 2 Species composition of rotifer
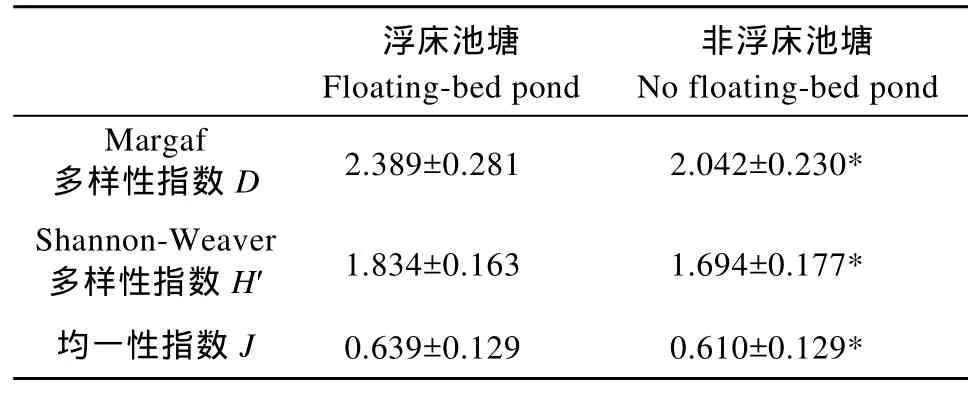
表3 不同类型池塘轮虫多样性指数(平均数±标准差)Tab. 3 Rotifer diversity index in the different types ponds (mean± standard deviation)
3 讨论
3.1 浮床对轮虫群落结构的影响
在整个试验期间, 浮床池塘中的多样性指数及均匀性指数显著大于非浮床池塘(P<0.05); 浮床池塘中各优势种优势度相对稳定, 波动较小;非浮床池塘中暗小异尾轮虫和裂痕龟纹轮虫优势度显著,且波动较大。水蕹菜浮床能够影响轮虫的群落结构, 使其多样性均匀度升高, 水体自动调节能力增强, 池塘生态系统更趋稳定, 更有利于水产养殖。

图3 试验期间不同类型池塘优势轮虫密度季节变动Fig. 3 Seasonal changes of density of dominant rotifers in different types of ponds
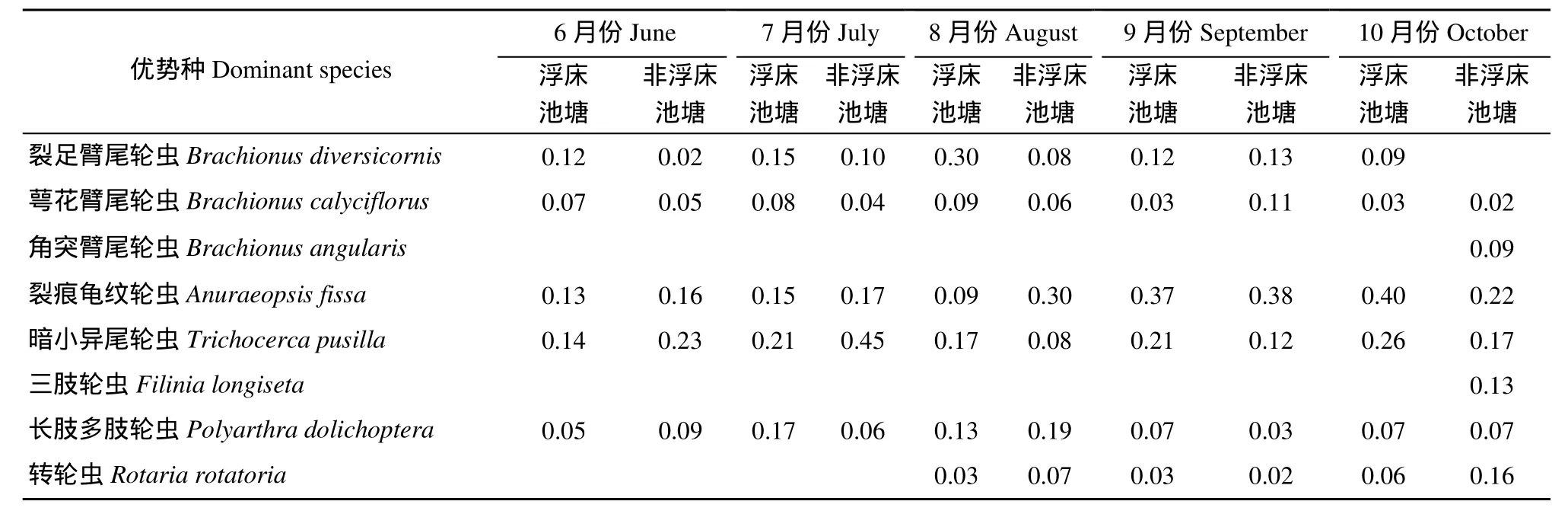
表4 不同类型池塘优势种及其优势度Tab. 4 Dominant species and their dominance in different types of ponds
轮虫是池塘生态系统的重要组成部分, 造成其种类组成和群落结构变化的原因很多。有学者认为溶解氧是影响轮虫变化的主要环境因子之一, 溶解氧不足会限制轮虫的发生[15]。高等水生植物具有通气组织, 空气中的氧可经由通气组织输送到水下的根系中, 满足根系生长需求的盈余氧气可被释放到根区周边的环境中, 形成富氧微环境[14]; 根系的富氧环境可以减轻污染水体因溶解氧不足所带来的不利影响, 有利于浮游动物的生长[16]; 同时, 水生物浮床的覆盖区存在的富氧–厌氧微环境使几种氮循环细菌同时存在成为可能, 促进了水体氮循环[17]; 养殖水经固定化微生物(含有光合细菌、芽胞杆菌、硝化细菌以及反硝化细菌)处理后, 水体中藻的种数增加,藻类细胞(或丝状体)数量及生物量减少; 水体中浮游动物种类和生物量增加, 从而浮游动物的群落组成发生了变化[18]; 因此, 水蕹菜浮床对改善池塘环境,促进水体中轮虫种类的增加有积极作用。也有学者认为造成轮虫变化的主要原因为水温[19]。但在本实验中, 浮床池塘与非浮床池塘温度基本无差异, 因此温度并非是影响不同池塘轮虫差异的主要原因。
轮虫大多数为滤食性种类, 只有少数为捕食性如晶囊轮虫。浮游动物的食性决定了浮游动物的取食对象, 尽管有些捕食性种类以原生动物、轮虫以及小个体的甲壳类和幼体为食, 浮游动物最根本的食物来源是藻类和细菌等[20]。食物的多样性和不同食物的营养价值差异可以影响浮游动物的生长发育和群落结构的变化[21]。藻类的季节变化通常也会引起浮游动物的种群变动, 不同湖泊之间的浮游植物的差异也反映出浮游动物的变化[22]。在实验期间, 浮床池塘中浮游植物优势种为28种, 显著大于非浮床池塘的14种(P<0.05);浮床池塘浮游植物的多样性指数显著高于非浮床池塘(P<0.05); 浮床池塘铺设水雍菜浮床对提高浮游植物多样性、平衡藻相、稳定养殖水质有积极作用[7]。因此, 水蕹菜浮床提高了浮游植物多样性, 进而促进轮虫种类和多样性变化。
3.2 浮床对轮虫小型化的抑制作用
浮床池塘中轮虫生物量显著低于非浮床池塘(P<0.05), 但不同池塘轮虫密度不存在显著性差异(P>0.05), 轮虫密度与生物量的变化趋势不同, 这与不同季节的轮虫优势种有关。浮床池塘中的萼花臂尾轮虫与裂足臂尾轮虫两类个体较大的轮虫密度高于非浮床池塘(图3C、D), 而非浮床池塘中主要以暗小异尾轮虫以及裂痕龟纹轮虫两种小型个体为主,因此, 虽然非浮床池塘中的密度显著高于浮床池塘(P<0.01), 但两种类型的池塘的生物量差异不显著(P>0.05)。且在整个实验过程中, 浮床池塘中各优势种密度变化与非浮床池塘相比更加的稳定, 波动较小, 这可能与浮床池塘相对稳定的水质有关。
裂痕龟纹轮虫是一种小型轮虫, 常见于富营养化水体, 为狭温性。裂痕龟纹轮虫以腐殖质为食, 从6至 8月浮床池塘中裂痕龟纹轮虫密度一直低于对照塘, 而 9、10月份浮床池塘中的裂痕龟纹轮虫高于非浮床池塘。在试验过程中, 我们对水蕹菜根系观察发现, 水蕹菜根系大量吸附悬浮物, 可降低养殖水层中的悬浮物浓度, 从而对裂痕龟纹轮虫密度产生影响。暗小异尾轮虫是吮吸性种类, 它以丝状藻的细胞内容物为食物。由表 1可知, 浮床池塘中Chl.a的含量一直低于非浮床池塘, 这可能造成非浮床池塘中暗小异尾轮虫的密度高于非浮床池塘, 且浮床池塘中暗小异尾轮虫的密度与非浮床池塘中相比波动较小。
Roche & Kennedy[23]认为, 萼花臂尾轮虫一般出现在水温高于13—15℃、氨浓度较低、挥发性有机化合物较少和溶解氧浓度较高的适宜环境中。温新利等[24]在对镜湖萼花臂尾轮虫种群调查时发现,萼花臂尾轮虫密度的高低除了和水温具有密切的关系外, 还可能与食物的密度等具有很大关系。在整个实验过程中, 浮床池塘的萼花臂尾轮虫密度均大于非浮床池塘, 但浮床池塘与非浮床池塘的水温及溶解氧浓度不存在显著性差异, 且非浮床池塘的 Chl.a含量明显高于浮床池塘, 因而可以推断这种现象产生可能与浮床池塘较为稳定适宜的生活环境有关。
在实验期间, 草鱼主养池塘中的轮虫显著特征是以小型浮游动物占主导地位, 赵爱萍[25]在对镇江金山湖水体浮游动物做调查时指出, 富营养化有利于小型浮游动物的生长, 从而抑制了大型浮游动物。而池塘中轮虫的小型化可能与水体中营养盐含量过高有关, 此外, 鱼类的捕食一直被认为是决定浮游动物群落密度、结构及导致浮游动物群落演替的最主要的因素[26]。与不同类型池塘相比, 非浮床池塘轮虫密度高出浮床池塘19.18%, 但两者轮虫生物量差距并不显著(P>0.05), 因此可以推断, 浮床池塘在一定程度上减缓了轮虫的小型化, 且覆盖率为7.5%水蕹菜浮床并不会造成鳙鱼的减产。

