连翘酯苷A对全身内毒素血症小鼠调节性T细胞的影响
苑 伟,杨 慧,谢 勇,傅颖珺*
(1.南昌大学药学院,江西南昌 330006;2.江西省医学科学研究院,江西南昌 330006;3.南昌大学第一附属医院消化科,江西南昌 330006)
细菌内毒素又称脂多糖 (Lipopolysaccharide,LPS),为革兰氏阴性菌细胞壁外膜的主要结构成分,是创伤、感染等引起的全身炎症反应综合征的重要致病因子[1]。在严重感染机体中,机体免疫功能的紊乱是导致感染患者死亡的重要原因[2]。研究发现免疫系统内存在一类CD4+CD25+调节性T淋巴细胞 (Treg),不仅能抑制自身反应性T细胞,还能参与免疫调节,分为天然的和诱生的,均能够抑制体外CD4+T细胞的增值和体内免疫应答,与自身免疫活动的异常密切相关[3]。
连翘酯苷A(Forsythoside A)是从连翘中提取的苯乙醇苷类中药单体,具有抗菌、抗病毒、抗氧化和免疫调节等作用[4]。近年来有学者研究发现,中药连翘具有很强的摧毁细菌内毒素和免疫调节等作用[5-6],其开发利用的前景十分广阔。但目前连翘酯苷A确切的作用机制还不清楚,对Treg的影响也尚未见报道。本实验通过探讨连翘酯苷A对内毒素血症小鼠外周血Treg和脾脏Foxp3的影响,阐明连翘酯苷A的免疫调节作用及机制,为连翘防治内毒素血症提供新的思路和靶点。
1 材料与方法
1.1 材料 清洁级雄性BABL/C小鼠,6~8周龄,体质量 (18±2)g,购自南昌大学动科部。连翘酯苷A(20mg,批号L28-110506)购于江西本草天工科技有限公司;LPS(Escherichia coli,026:B6)购自Sigma公司。荧光标记抗体Anti-Mouse CD4 FITC,Anti-Mouse CD25 PE,Anti-Mouse CD3e PE-Cy5均购自美国eBioscience公司;流式细胞仪为美国BD公司产品。抗小鼠CD25单克隆抗体 (PC61)购自Biolegend;兔抗Foxp3单克隆抗体购自英国Abcame公司;β-actin鼠抗单克隆抗体购自中山金桥。总RNA提取试剂盒和逆转录试剂盒购于美国Omega公司;SYBR@Premix Ex TaqTMII荧光定量PCR试剂盒购自日本Takara公司;StepOneTM实时荧光定量PCR仪为美国ABI公司产品;PCR引物由上海生工生物技术服务公司合成。红细胞裂解液购自天根生物技术有限公司;小鼠白细胞介素 (IL)-10、转化生长因子 (TGF)-β1酶联免疫吸附测定 (ELISA)检测试剂盒均购自武汉优尔生科技股份有限公司。
1.2 方法
1.2.1 实验分组、造模及标本留取 将BABL/C小鼠随机分成正常对照组,模型对照组,抗体对照组,连翘酯苷A高、中、低3个剂量组,每组8只。正常组、模型组、抗体组腹腔注射 (Intraperitoneal injection,ip)生理盐水0.5 mL/d,连续7 d;其中抗体组第2天腹腔注射Anti-CD251.2 mg/kg来耗竭Treg;3个药物组分别腹腔注射连翘酯苷A 80 mg/kg、20 mg/kg、5 mg/kg,连续7 d;第8天正常对照组腹腔注射生理盐水0.5 mL,其他组均腹腔注射LPS 10 mg/kg。4 h后无菌取血,并取脾组织置液氮冷冻后-80℃保存。用流式细胞术测外周血Treg比例变化;实时PCR和Western blot法测定脾脏组织Foxp3表达。
1.2.2 一般情况观察 观察腹腔注射LPS后小鼠饮食饮水、排便、行为活动等,记录小鼠死亡情况。
1.2.3 流式细胞仪检测Treg 流式上样管中加入肝素钠抗凝血100μL,加入 FITC-anti-CD4,PE-anti-CD25,PE-Cy5-anti-CD3e各5 μL,并设立同型对照管。充分震荡混匀,室温避光孵育15 min,加入1 mL红细胞裂解液,混匀,室温避光孵育10 min,然后1000 r/min离心5 min,弃去上清液。加2 mL PBS洗1次,最后加500 μL PBS重悬,应用 BD公司FACS Calibur流式细胞分析仪上机检测。用BD FACS Diva软件分析数据,并减去非特异性对照,以FSC/SSC和SSC/CD3+设门,检测门内10000个细胞中CD4+CD25+双阳性细胞与FITC标记的CD4+细胞的比率,即为Treg百分率。
1.2.4 Real-time PCR检测Foxp3 mRNA 取50~100 mg脾组织提取总RNA,以紫外分光光度计测定吸光度值,-80℃保存。逆转录并进行real time PCR,引物序列如下:Foxp3正向:5-CTCATGATAGTGCCTGTGTCCTCAA-3,反向:5-AGGGCCAGCATAGGTGCAAG-3,扩增片段93 bp;以 β-actin为内参,正向:5-CATCCGTAAAGACCTCTATGCCAAC-3,反 向:5-ATGGAGCCACCGATCCACA-3,扩增片段171 bp。反应体系20 μL,每个样本均重复3个复孔,采用两步法PCR扩增标准程序:预变性95℃ 30 s,变性95℃ 5 s共40个循环,退火60℃34 s。所有扩增产物用融解曲线和琼脂糖凝胶电泳检测扩增产物单一性。数据由荧光定量PCR仪收集并计算CT值。CT(Threshold Cycle)值的含义:每个反应管内荧光强度达到系统能够辨认的目的DNA合成时的循环数,cDNA含量越低,所对应的CT值越高。采用2-ΔΔCT相对定量的方法表示Foxp3 mRNA的相对表达水平。公式如下:
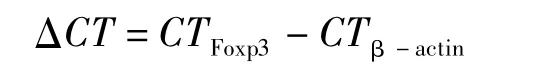
ΔΔCT= (CTFoxp3-CTβ-actin) 实 验 组 -(CTFoxp3-CTβ-actin)正常组 (平均值)
mRNA 相对表达量 =2-ΔΔCT×100%。
1.2.5 脾脏Foxp3蛋白表达的测定 组织称定质量,放入含有蛋白酶抑制剂的裂解缓冲液中冰浴裂解,-20℃保存。采用BCA法测蛋白浓度,通过Western印迹法进行分析。取各待测样品以4X上样缓冲液煮沸5 min,经12%聚丙烯酰胺凝胶电泳,采用半干电转移法,将蛋白转移至NC膜上。5%脱脂牛仔封闭1.5 h后,经一抗 (鼠源抗β-actin 1∶2000;兔源抗Foxp31∶1000)孵育4℃过夜,辣根过氧化物酶标记的二抗 (山羊抗小鼠1∶5000,山羊抗兔1∶10000)孵育4 h及ECL显色。Bio-Rad软件分析图像,读取A值,Foxp3蛋白的相对表达量=AFoxp3/Aβ-actin。
1.2.6 ELISA法检测血清IL-10、TGF-β1 小鼠摘眼球取血,室温凝固4 h,3500 r/min离心15 min,收集上清,待测。以双抗体夹心法检测血清IL-10、TGF-β1水平,具体步骤参照试剂盒说明书。
1.2.7 统计学分析 所有数据采用SPASS 16.0统计软件进行方差分析处理。结果以表示,单因素方差分析进行显著性检验,多组间比较采用LSD检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组小鼠一般表现情况 正常对照组小鼠饮食活动正常,反应机敏,生理状态未见明显改变。模型组小鼠造模后与正常组相比,精神不振,皮毛竖立无光泽,畏寒颤抖且卷缩抱团;自主活动减少嗜睡,抓取时反应迟钝。抗体和药物干预组小鼠无明显异常变化。整体无死亡现象。
2.2 各组小鼠外周血CD4+CD25+/CD4+T比例变化 通过流式细胞术检测发现,与正常对照组相比,模型组小鼠外周血CD4+CD25+/CD4+T比例显著上升 (P<0.01);与模型组相比,连翘酯苷A高剂量组能够达到与抗体组相似的疗效,即明显降低小鼠外周血CD4+CD25+/CD4+T比例 (P<0.01),且双阳性细胞比例随连翘酯苷A剂量增加而相应降低,呈明显的剂量-效应关系 (P<0.05)(见表1)。
表1 各组小鼠外周血CD4+CD25+/CD4+T比例的变化(%,)Tab.1 Changes of perpheral blood CD4+CD25+/CD4+T ratio in each group of mice(%,)
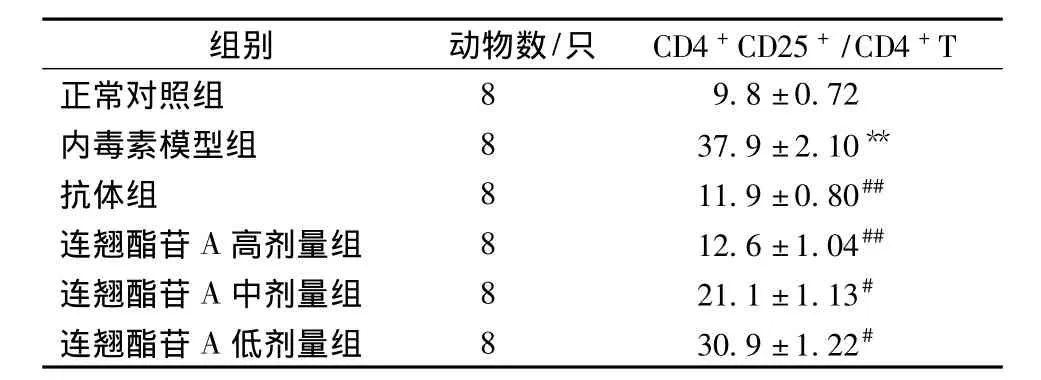
表1 各组小鼠外周血CD4+CD25+/CD4+T比例的变化(%,)Tab.1 Changes of perpheral blood CD4+CD25+/CD4+T ratio in each group of mice(%,)
注:与正常对照组比较,**P<0.01;与内毒素模型组比较,##P <0.01,#P <0.05
组别 动物数/只 CD4+CD25+/CD4+T正常对照组89.8±0.72内毒素模型组 8 37.9 ±2.10**抗体组 8 11.9±0.80##连翘酯苷A高剂量组 8 12.6±1.04##连翘酯苷A中剂量组 8 21.1±1.13#连翘酯苷A低剂量组 8 30.9±1.22#
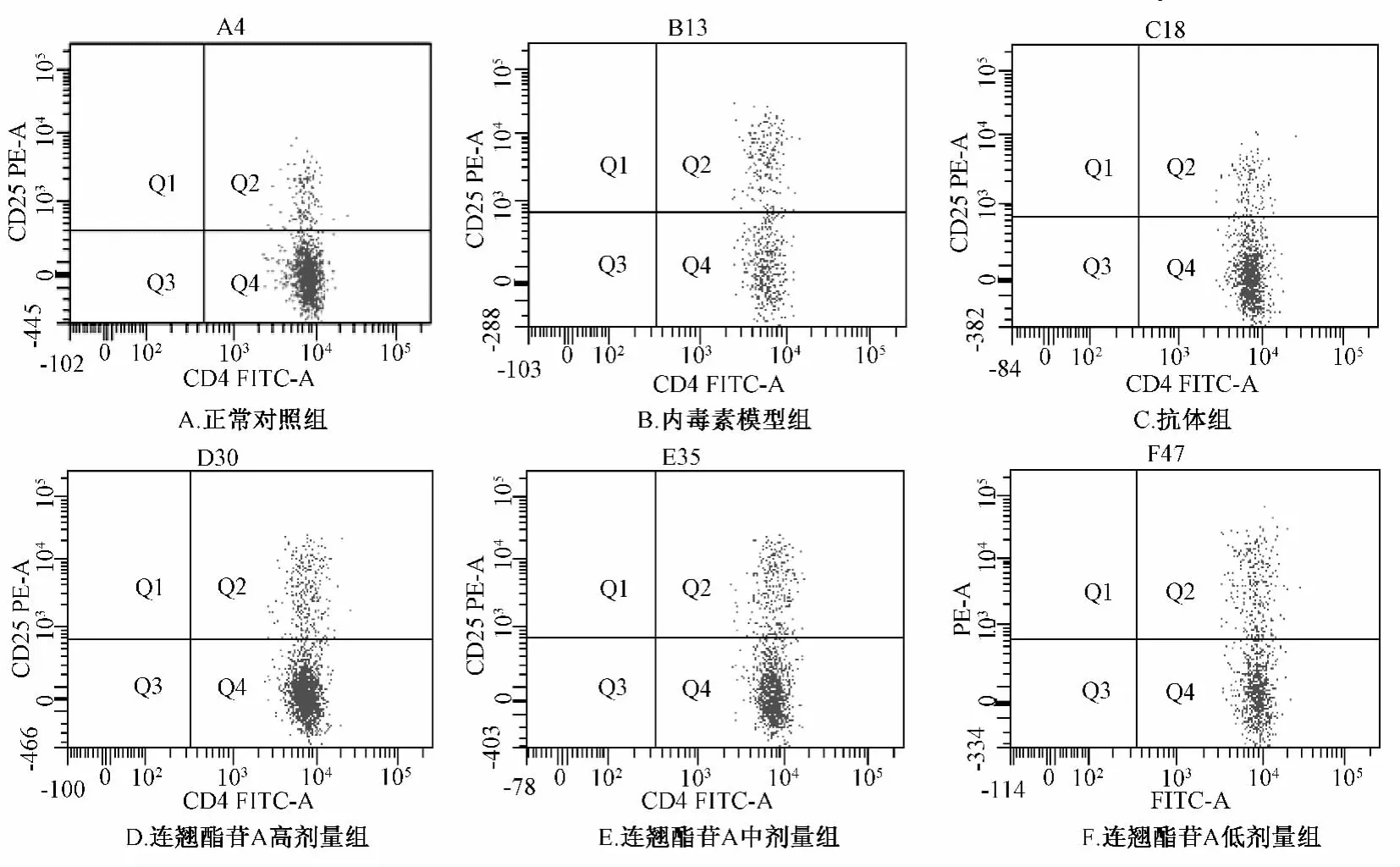
图1 流式细胞术检测小鼠外周血CD4+CD25+/CD4+T细胞比例Fig.1 Peripheral blood CD4+CD25+/CD4+T cell ratios in mice measured by flow cytometry
流式结果图 (图1)中,Q4象限表示CD4+T细胞,Q2象限表示CD4+CD25+双阳性细胞。由图可见,内毒素模型组Q2象限的双阳性细胞比例与Q4象限的总CD4+T细胞相差不大,而正常对照组和连翘酯苷A高剂量组的Q2细胞比例明显少于Q4。
2.3 各组小鼠脾组织Foxp3 mRNA和蛋白的表达 Foxp3 mRNA在正常小鼠脾组织内均有一定程度的表达,与正常对照组比较,模型组小鼠Foxp3 mRNA表达上调非常显著,差异有统计学意义(P<0.01);用抗体以及连翘酯苷A干预后Foxp3 mRNA表达明显下降且呈剂量依赖关系,与模型组比较,差异有统计学意义 (P<0.01,P<0.05);各组Foxp3蛋白的表达变化与Foxp3 mRNA相似。见表2,图2。
表2 各组小鼠脾组织中Foxp3 mRNA及蛋白表达的变化(IOD值,)Tab.2 Changes of Foxp3 mRNA and protein expression on spleen tissue in each group of mice(%,)
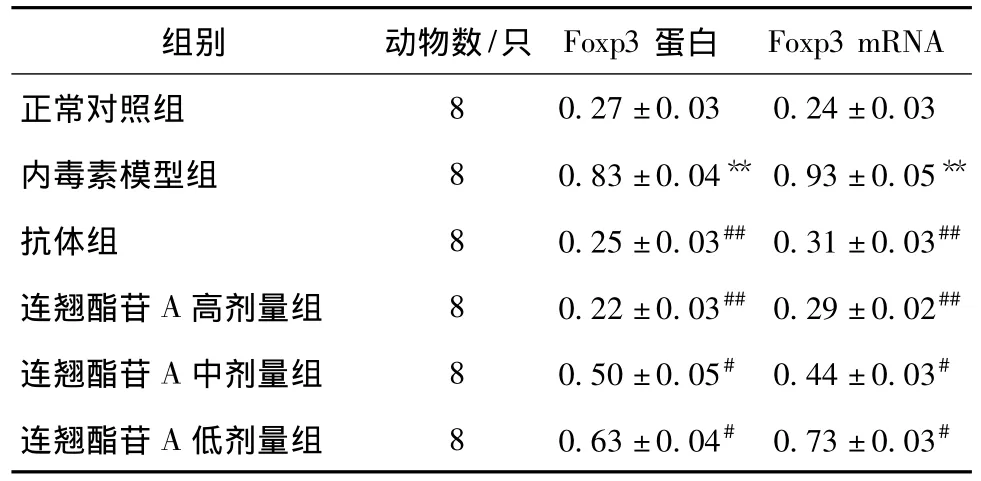
表2 各组小鼠脾组织中Foxp3 mRNA及蛋白表达的变化(IOD值,)Tab.2 Changes of Foxp3 mRNA and protein expression on spleen tissue in each group of mice(%,)
注:与正常对照组比较,**P<0.01;与内毒素模型组比较,##P <0.01,#P <0.05
Foxp3 mRNA正常对照组组别 动物数/只 Foxp3蛋白8 0.27±0.03 0.24±0.03内毒素模型组 8 0.83 ±0.04** 0.93 ±0.05**抗体组 8 0.25±0.03##0.31±0.03##连翘酯苷A高剂量组 8 0.22±0.03##0.29±0.02##连翘酯苷A中剂量组 8 0.50±0.05# 0.44±0.03#连翘酯苷A低剂量组 8 0.63±0.04# 0.73±0.03#
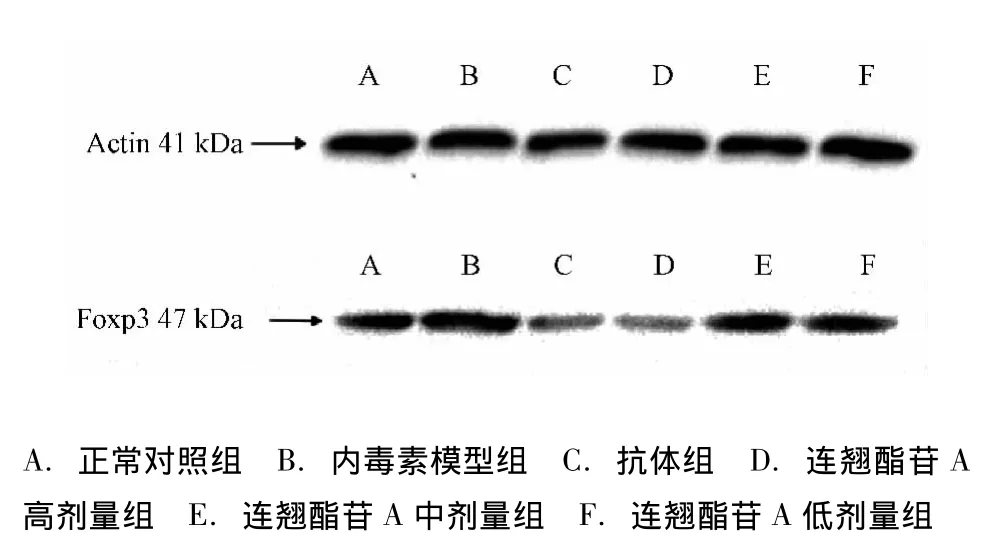
图2 Western blot检测LPS对小鼠脾组织Foxp3蛋白表达的影响Fig.2 Effect of Foxp3 protein expression from LPS on spleen tissue in mice by Western blot
2.4 各组小鼠血清IL-10和TGF-β1的变化 内毒素模型组小鼠血清IL-10水平显著高于正常对照组(P<0.01);抗体以及药物干预后,能有效降低小鼠血清IL-10分泌,且随药物剂量降低作用减弱(P<0.01,P<0.05)。TGF-β1变化水平不如 IL-10明显,与正常对照组相比,模型组表达升高 (P<0.01);抗体和高、中剂量药物干预后均能降低该变化 (P<0.05);但药物低剂量组与模型组相比,差异不显著 (P>0.05)无统计学意义。见表3。
表3 各组小鼠外周血血清中IL-10及TGF-β1的水平变化(pg/mL,)Tab.3 Changes of IL-10 and TGF-β1 levels in peripheral blood serum of each group of mice(pg/mL,)
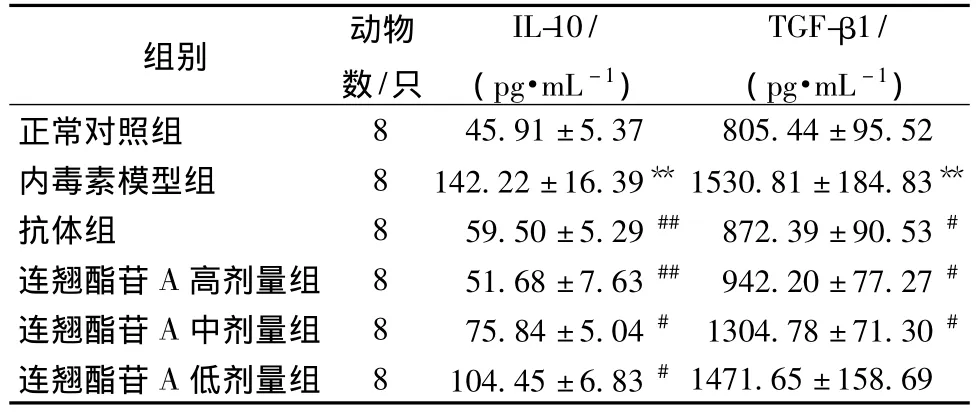
表3 各组小鼠外周血血清中IL-10及TGF-β1的水平变化(pg/mL,)Tab.3 Changes of IL-10 and TGF-β1 levels in peripheral blood serum of each group of mice(pg/mL,)
注:与正常对照组比较,**P<0.01;与内毒素模型组比较,##P<0.01,#P <0.05
组别 动物数/只IL-10/(pg·mL-1)TGF-β1/(pg·mL-1)1471.65±158.698 45.91±5.37 805.44±95.52内毒素模型组 8 142.22 ±16.39** 1530.81 ±184.83**抗体组 8 59.50±5.29## 872.39±90.53#连翘酯苷A高剂量组 8 51.68±7.63## 942.20±77.27#连翘酯苷A中剂量组 8 75.84±5.04# 1304.78±71.30#连翘酯苷A低剂量组 8 104.45±6.83#正常对照组
3 讨论
中药由于资源广阔,药性温和,毒副作用小且较少出现耐药性,而越来越受到关注。近年来研究发现,中药某些有效成分对内毒素血症导致的免疫调节异常作用显著。内毒素血症是由于血液受到细菌或外源内毒素污染而引起的病理生理表现,属于全身性感染的一种症状。在内毒素致病过程中,产生的各种生物学效应引起机体免疫调节异常,以及产生一系列炎症介质和细胞因子等均参与疾病的发生[2]。Treg是一种表型与功能特异的T淋巴细胞亚群,在机体免疫平衡中起重要作用。Caramalho等[7]报道,LPS能与暴露于Treg上的TLR4受体结合,提高Treg的生存与增殖能力,并10倍增强Treg的免疫抑制功能。因此,本研究从Treg的免疫学角度,通过建立小鼠内毒素血症模型,观察小鼠外周血Treg和脾脏Foxp3的变化等来探讨受试药物连翘酯苷A对Treg的影响。
Treg能有效预防和消除病原体感染,抑制过强的免疫应答来维持机体免疫平衡,与自身免疫性疾病、移植耐受以及肿瘤免疫等方面密切相关[8]。Treg在自然状态下表现免疫无能性,对IL-2等特异性抗原的刺激呈无反应状态;Treg活化后,其免疫抑制性是抗原非特异的,能够通过直接接触或分泌抑制性细胞因子如IL-10和TGF-β1等来抑制效应性CD4+、CD8+T细胞的生物活性[9]。本研究中通过流式细胞术检测发现,内毒素模型组小鼠的外周血Treg比例明显升高 (P<0.01),提示小鼠感染内毒素后,机体的免疫功能明显受抑,可能是由于LPS引起Treg过度活化,从而抑制了CD4+、CD8+T细胞的增殖。而用连翘酯苷A干预后,小鼠外周血Treg比例明显下降,且随药物剂量的增加而程度更加明显,呈剂量-效应关系 (P<0.05),其中高剂量药物组与正常对照组比较差异无统计学意义 (P>0.05),说明连翘酯苷A可以通过抑制Treg活化来纠正内毒素所致的机体免疫受抑状态。
细胞因子IL-10、TGF-β1是免疫细胞功能上相互联络的重要因素之一,IL-10具有多功能性,能阻止抗原递呈细胞功能或下调共刺激分子表达,以及作用于T淋巴细胞,诱导其无能,使机体细胞免疫减弱。转化生长因子TGF-β1可作为免疫应答调节器,能够增强或抑制效应T细胞增生,调节T细胞反应,并能促进外周CD4+CD25-T细胞转化为调节性细胞,来维持免疫平衡[10]。本研究中发现高剂量连翘酯苷A能使Treg分泌的细胞因子IL-10、TGF-β1明显减少,因此连翘酯苷A减少Treg分泌抑制性细胞因子,可能是通过以上两种机制来增强机体的免疫功能。
叉头状螺旋转录因子Foxp3是赋予Treg细胞免疫抑制功能的主要分子,介导Treg的发育与表达,是其最特异的标记分子[11]。Foxp3基因异常会导致Treg细胞数量及功能的变化,并影响其调控机制,最终导致免疫功能紊乱,因此Foxp3对机体免疫自稳起着决定性作用。在正常人和小鼠的外周血及脾脏组织的CD4+T细胞中约有5%~10%的细胞持续表达CD25+分子,并在CD4+CD25+分子中高表达转录因子 Foxp3[12-13]。本研究结果显示,经过LPS刺激的模型组小鼠Foxp3的表达升高十分显著 (P<0.01),连翘酯苷A干预后能明显降低患病小鼠脾脏Foxp3的表达,提示连翘酯苷A可以通过抑制Foxp3的升高而减弱Treg的功能。
综上所述,内毒素可以引起全身性炎症反应,使机体免疫功能异常,表现为患病小鼠外周血Treg比例、Treg特异性标志分子Foxp3的表达、以及抑炎因子IL-10、TGF-β1的分泌均升高。而本研究发现连翘酯苷A作用后可有效缓解LPS所致的机体免疫功能紊乱,通过减少Treg数、IL-10和TGF-β1的分泌,以及降低Foxp3的表达水平,抑制了Treg的功能,增强机体免疫能力。本研究阐述了连翘酯苷A对全身内毒素血症小鼠的免疫调节作用,进一步发挥了中药抗感染的特色与优势,以期为内毒素血症的治疗提供帮助。
[1]陈玉时,朱金华,曾 伟.细菌内毒素及其拮抗药物的研究概况[J].亚太传统医药,2011,7(9):162-164.
[2]Simpson A,Martinez F D.The role of lipopolysaccharide in the development of atopy in humans[J].Clin Exp Allergy,2010,40(2):209-223.
[3]Agata K,Lidia C,Stanisław P,et al.The significance of Treg cells in defective tumor immunity[J].Arch Immunol Ther Exp,2008,56(3):181-191.
[4]刘文博,李德朋,张桂林,等.连翘酯苷药理活性研究进展[J].中国畜牧兽医,2011,38(7):236-238.
[5]韩双红,王玉芬,张居馨.连翘败毒片的抗内毒素及免疫调节作用的研究[J].天津中医药,2004,21(5):417-419.
[6]傅 强,崔华雷,崔乃杰.连翘提取物抑制内毒素诱导的炎症反应的实验研究[J].天津医药,2003,31(3):161-163.
[7]Caramalho I,Lopes C T,Ostler D,et al.Regulatory T cells selectively express toll-like receptors and are activated by lipopolysaccharide[J].J Exp Med,2003,197(4):403-411.
[8]Lu L,Zhang F,Wang X H,et al.Isolation and function analysis of rat CD4+CD25+regulatory T cell[J].Chin J Cell Mol Immunol,2006,22(4):417-419.
[9]Khazaie K,Von B H.The impact of CD4+CD25+Treg on tumor specific CD8+T cell cylotoxicity and cancer[J].Semin Cancer Bio,2006,16(2):124-136.
[10]Koichi K ,Anil P,Bernhard J H,et al.Transforming growth factor beta 1(TGF-β1)and rapamycin synergize to effectively suppress human T cell responses via upregulation of FoxP3+Tregs[J].Transpl Immunol,2010,23(1/2):28-33.
[11]Lal G,Zhang N,Vander T W,et al.Epigenetic regulation of Foxp3 expression in regulatory T cells by DNA methylation[J].J Immunol,2009,182(1):259-273.
[12]Pillemer B B,Xu H,Oriss T B,et al.Deficient SOCS3 expression in CD4+CD25+Foxp3 regulatory T cells and SOCS3-mediated suppression of Treg function[J].Eur J Immunol,2007,37(8)2082-2089.
[13]Larkin J,Rankin A L,Picca C C,et al.CD4+CD25+regulatory T cell repertoive formation shaped by differential presentation of peptides from a self-antigen[J].J Immunol,2008,180(4):2149-2157.

