不同栓塞剂治疗肝巨大海绵状血管瘤的疗效
于长路, 纪盛章, 贾科峰, 王 森, 孙 诚
肝海绵状血管瘤 (cavernous hemangioma of the liver,CHL)是最常见的肝脏良性肿瘤,好发于30~50岁,女性多见。小的血管瘤多无临床症状,巨大血管瘤可以引起腹痛、饱腹感、慢性恶心、呕吐、食欲不振、消化不良等常见症状,少见的还包括胆汁淤积(或黄疸)、腹水、胆道出血和Kasabach-Merritt综合征等严重表现。随着血管瘤的逐渐增大还存在破裂的危险。国内学者普遍认为直径>10 cm为巨大血管瘤。本组患者CHL的直径均>10 cm。
目前肝动脉栓塞术已是公认的治疗CHL的首选方法,常用的栓塞剂为平阳霉素碘油混合剂(PLE), 疗效可靠[1-2]。 目前国内将海藻酸钠微球(KMG)应用于CHL的栓塞鲜有报道,现将我院自2008年3月—2010年5月对治疗CHL所用不同栓塞剂报道如下。
1 材料与方法
1.1 一般资料
我院2008年3月—2010年5月经临床、影像证实的CHL30例,男13例,女17例,血管瘤直径为10.4~21.8 cm,肝功能分级均为Child-Pugh A级,无肝炎、肝硬化等其他肝脏疾病。纳入标准:所有患者均未接受过其他针对血管瘤的治疗,随机分为A、B两组,每组15例。A组使用栓塞剂为PLE联合KMG,血管瘤平均直径为16.3 cm,单发者11例,单发位于右叶者为8例。B组栓塞剂为PLE,血管瘤平均直径为15.8 cm,单发者9例,单发位于右叶者为7例。30例患者中,21例无任何临床症状,在体检时发现,9例患者有不同程度的上腹部不适,腹胀、腹痛等症状。所有患者均对本次手术知情同意,并签署知情同意书。
1.2 方法
1.2.1 治疗方法 局麻下采用改良Seldinger技术经皮股动脉穿刺的方法将4FRH导管至腹腔动脉和/或肠系膜上动脉主干,造影了解CHL的数目、大小、血供等情况,根据造影表现,将微导管超选择到肿瘤的供血动脉内。A组则在透视监控下缓慢注入PLE及配制好的KMG(0.9%氯化钠溶液 ∶碘海醇 =1∶1~1.5,至KMG完全悬浮为准,KMG直径为150~300 μm 和(或)150~450 μm,0.1~0.2 g)。B组在透视监控下缓慢注入PLE,两组栓塞以病变周围小的门静脉分支显影或供血动脉出现反流作为栓塞量化的标准。如患者疼痛两组均在术中注入2%利多卡因1~2 ml,术后酌情给予抗感染、护肝和对症治疗。
1.2.2 疗效评价
1.2.2.1 治疗效果评价:显效,指各种症状体征消失,经CT等影像学检查示瘤体缩小50%以上;有效,指各种症状体征消失,经CT等影像学检查示瘤体有所缩小,但缩小体积小于50%;无效,指各种症状体征均未消失,经CT等影像学检查示瘤体无变化或进一步增大[3]。
1.2.2.2 患者满意率:采用自制问卷进行调查,调查项目分为非常满意、较为满意及不满意三项,共发放问卷30份,有效回收率为100%。
1.3 统计学处理
应用SPSS15.0软件包进行处理,计量资料用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 栓塞剂用量
PLE剂量为8~24 ml,A组PLE剂量 (10.9±5.2)ml,B 组 PLE 剂量为(11.4 ± 4.9)ml,两者差异无统计学意义(P>0.05)。
2.2 瘤体缩小率
术后 1、3、6、12个月分别复查 CT,其中 A 组所有患者均为一次栓塞,B组有5例行2、3次栓塞。对照CT图像计算瘤体缩小率,计算方法为:(术前瘤体直径 -术后瘤体直径)/术前瘤体直径 ×100%[4]。
术后第1、3、6个月,A组瘤体缩小率在50%以上者为分别为 9、11、14 例,B 组分别为 0、3、5 例(P<0.05)。第12个月瘤体缩小率达50%及以上者A组为14例,B组为12例,两组间显著无统计学意义(P>0.05)。(瘤体缩小率分5级描述,其中Ⅰ级瘤体缩小率>70%,Ⅱ级为50%~70%,Ⅲ级为25%~50%,Ⅳ级为5%~25%,Ⅴ级为 <5%或无变化),见表1。

表1 A、B两组巨大血管瘤术后瘤体缩小情况 (例)
2.3 并发症
2.3.1 疼痛 在所有术后并发症中疼痛尤为明显,主要集中在术后1周内,经对症处理,1周后绝大部分患者疼痛消失。术后对患者的观察发现A组普遍疼痛较B组明显,从数据得出A组1周内疼痛达2~3级者为60例,B组为9例,差异有统计学意义(P<0.05)。疼痛程度分级采用临床常用的口头叙述法。0级:无痛;1级轻度,虽有疼痛但可以忍受,能正常生活,睡眠不受干扰;2级中度,疼痛明显,不能忍受,要求服用止痛剂,睡眠受到干扰;3级重度,疼痛剧烈,不能忍受,需要止痛剂,睡眠受到严重干扰,可伴有植物神经功能紊乱或被动体位,见表2。
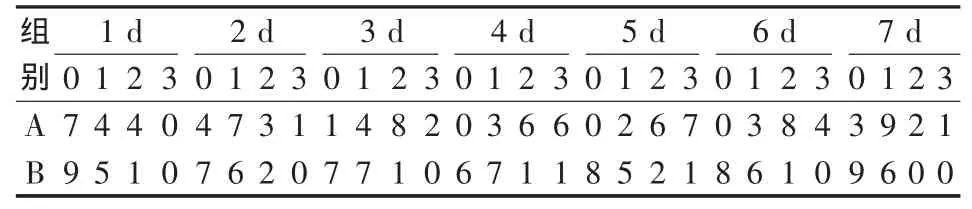
表2 两组患者术后1周每天疼痛情况 (例)
2.3.2 其他并发症 大部分患者有不同程度的发热,对症处理后症状缓解。术后3 d部分患者发生丙氨酸转氨酶及天冬氨酸转氨酶轻度升高等肝功能轻度异常,经对症处理1周后恢复正常。
3 讨论
CHL的发病率高,病因不明,瘤体为大小不一的血窦组成,由结缔组织分割或包绕,内壁由单层幼稚血管内细胞组成,血管瘤瘤壁缺乏肌层和弹力层缺乏神经纤维的支配。介入治疗注入的栓塞剂进入并停留在这些血窦中,使血管瘤血窦内皮细胞破坏、血栓形成、血窦永久性闭塞,瘤体缩小或消失,但不会破裂出血达到了治疗作用。
平阳霉素具有祛血管作用,是一种温和的血管硬化剂,通过碘油的导向性、载体性,使平阳霉素在栓塞靶区高度浓聚并持续缓慢释放可造成血窦内皮变性坏死及血栓形成闭塞血窦从而达到治疗目的。肝动脉栓塞术(TAE)即通过肝动脉注入PLE,治疗肝血管瘤的安全性及疗效已得到广泛的认可[5-8]。文献报道,肝血管瘤的血供均来自肝动脉分支,而门静脉不参与供血,以此为TAE的理论依据[9-10]。对这个观点笔者有不同的看法,我们曾报道过2例完全由门静脉供血型的血管瘤[11],认为部分血管瘤的还是存在门静脉供血的。经门静脉插管注入PLE疗效确切。
KMG是多糖钠盐,栓塞后发生化学反应或免疫作用,栓塞3~6个月后,微球逐渐以分子脱链的形式降解消失,最终降解为多糖随尿排出[12]。我们就不同栓塞治疗方案在肝血管瘤介入治疗中的疗效进行统计及比较,发现平阳霉素碘化油乳剂加KMG的治疗方案较单纯运用平阳霉素碘化油乳剂的方案效果好。主要表现在PLE联合KMG组的患者术后瘤体缩小时间明显比单纯PLE组缩短,术后3个月复查CT瘤体缩小达50%以上者PLE联合KMG组为11例占(73%),而PLE组为3例占20%。两组患者术后大部分有不同程度的疼痛,但PLE联合KMG组患者疼痛程度较PLE组明显,分析原因可能和瘤体较大,注入药物多有关。通过术后问卷调查随访,PLE联合KMG组患者的满意度较PLE组高,究其原因主要是见效快,此外,PLE组有5例做2~3次介入,而PLE联合KMG组都均做了1次,明显减少医疗费用。但本次研究样本量小,术后疼痛究竟是因为KMG的原因还是注入PLE量过多的原因,及如何决绝疼痛等问题,还有待于扩大样本量继续探讨。
[1] Li CR, Wang T, Chang JP, et al.Pingyangmycin-lipiodol emulsion embolization in treating cavernous hemangioma of liver[J].Chin JMed Imaging Technol, 2004, 20: 274-276.
[2] Schnelldorfer T,Ware AL,Smoot R,et al.Management of giant hemangioma of the liver: resection versus observation [J].J Am Coll Surg, 2010, 211: 724-730.
[3] 李志强,赵 峰,刘景峰.不同栓塞方法在肝血管瘤介入治疗中疗效观察[J].南方医科大学学报, 2010, 30: 1736-1737.
[4] 曾庆乐,陈 勇,赵剑波,等.肝海绵状血管瘤的动脉造影分型及介入治疗 [J].中国医学影像学杂志,2009,17:379-380.
[5] 蒋旭远,徐 克.平阳霉素碘油乳剂动脉栓塞治疗肝血管瘤的中远期疗效评价[J].介入放射学杂志,2012,21:31-34.
[6] 朱 轲,曹建民.选择性肝动脉造影联合栓塞治疗肝血管瘤[J].介入放射学杂志, 2010, 19: 985-987.
[7] 孔 鹏,鹿化伟,王家平,等.平阳霉素碘油乳剂超选择硬化性栓塞治疗肝血管瘤 [J].介入放射学杂志,2011,20:123-126.
[8] 肖晋昌,祖茂衡,徐 浩,等.平阳霉素瘤体内注射治疗肝血管瘤60例临床分析 [J].介入放射学杂志,2013,22:334-336.
[9] Herman P, Costa ML, Machado MA, et al.Management of hepatic hemangiomas: a 14-year experience [J].J Gastrointest Surg, 2005, 9: 853-859.
[10] Algars AS.Type and location of tumor-infiltrating macrophages and lymphatic vessels predict survival of colorectal Cancer patients[J].Int J Cancer, 2012, 131: 864-873.
[11] 于长路,贾科峰,王 森.肝脏门静脉供血型血管瘤介入治疗(附两例报道)[J].中华放射学杂志, 2012, 46: 571-572.
[12] 独建库,李冠海,刘献茹,等.海澡酸钠微球栓塞治疗肝血管瘤[J].当代医学, 2010, 16: 296-297.

