反义cyclinD1基因转染后人角膜基质细胞增生改变的实验研究
黄海东,康景佳,尹 禄,管 迪,张 欣,李泓甫
(武警辽宁省总队医院眼科,辽宁 沈阳 110034)
角膜基质细胞(corneal stromal fibroblasts)作为角膜基质的重要细胞成分之一,是角膜维持透明性的关键因素,在角膜基质代谢中起重要作用。角膜发生溃疡时,角膜基质细胞活化,变形,进而纤维化,成为角膜成纤维细胞的主要来源,参与组成角膜防御系统[1,2]。cyclinD1是细胞增生内源性调控系统的主要组成部分,在G1期启动,调控G1~S期过程,是细胞增生调控的主要增生信号[3,4]。本研究观察反义cyclinD1基因转染对人角膜基质细胞增生的影响效果,旨在为眼科疾病的基因治疗提供依据。
1 实验与方法
1.1 实验所用的人角膜组织均在沈阳军区总医院眼库获得。将人角膜组织裁剪成块后进行原代细胞培养以获得人角膜基质细胞。通过胰蛋白酶消化法按照1∶2传代获得处于生长期的第2代人角膜基质细胞用于实验。
1.2 方法
1.2.1 主要试剂及仪器 美国Gibco公司生产的阳离子脂质体lipofectamine;北京大学第一医院中心实验室存有的反义cyclinD1基因;美国Maxim公司研发的鼠抗人/兔cyclinD1单克隆抗体工作液以及兔抗鼠SP免疫组织化学试剂盒;美国Sigma公司生产的MTT(四甲基偶氮唑盐);北京昌化精细化工厂制造的DMSO(二甲基亚砜);美国NAPCO公司生产的CO2恒温培养箱;日本Olympus公司制造的生物显微镜;香港悦泰洋行销售的酶联免疫检测仪。
1.2.2 实验方法 细胞计板制备角膜基质单细胞悬液共2×105/mL,取2ml在3个内置盖玻片的6孔板内进行接种,3个板分别对应3组。以无血清DMEM液对1μl的反义cyclinD1质粒或1μl的 PBS至100μl,稀释 4μl的 Lipofectamine 或 4μl的 PBS 至100μl,轻混稀释液,室温下进行孵育(30min),加入无血清培养液0.8ml,缓慢加入转染准备细胞中(细胞80%融合,无血清DMEM冲洗),放置在CO2恒温培养箱(37度)24小时,除掉转染液,加入DMEM培养液(含20% 的FBS)进行培养,每日换培养液。实验重复3次。终止转染后第2、6、10d,在3个板中取细胞爬片,冷丙酮固定后PBS冲洗,加入鼠抗人/兔cyclinD1单克隆抗体(比例为1∶100),4℃下放置1夜,加入经过生物素标记处理的兔抗鼠二抗(1∶200),返蓝,脱水,透明,封片及摄片处理后,生物显微镜下进行观察cyclinD1蛋白表达。
1.3 评价指标 免疫细胞化学法记录转染后cyclinD1蛋白表达情况。0.5%锥虫蓝染色法分析细胞活性。生物显微镜下细胞核显示为棕褐色着染阳性。用Combridge Quantimete 970型图像分析仪以及Quips软件编制测量cyclinD1阳性信号程序。生物显微镜摄取细胞图像,中央处理器进行细胞样本扫描、转换及测量细胞阳性信号吸光度值(A值)。MTT法检测测定570nm下每孔吸光度值(A570值)。
1.4 统计学处理 采用SPSS 15.0统计学软件处理,计数资料用表示,各组样本均数采用方差齐性检验,不同时点的A值及A570值用单因素方差分析,组间比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 免疫组织化学法检测转染后cyclinD1蛋白表达情况 对照1组和对照2组提示多数细胞核cyclinD1染色呈阳性,实验组仅有少量细胞核cyclinD1染色呈阳性,见图1、2。转染后,对照1组与对照2组A值略有下降,但两组间无显著差异(P>0.05)。实验组A值下降明显,与对照1、2组比较,差异有显著性,见表1。

图1 对照1组转染后,大量细胞核cyclinD1量细胞核cyclinD1染色呈阳性Figure 1 Large amount of positive dyeing of cyclinD1in nucleus in control group 1

图2 反义cyclinD1转染组转染后,少 染色呈阳性Figure 2 Few positive dyeing of cyclinD1in nucleus after antisense cyclinD1transfection
表1 不同时间点各组转染后cyclinD1表达情况()Table 1 The comparison on cyclinD1expression after gene transfection for different time
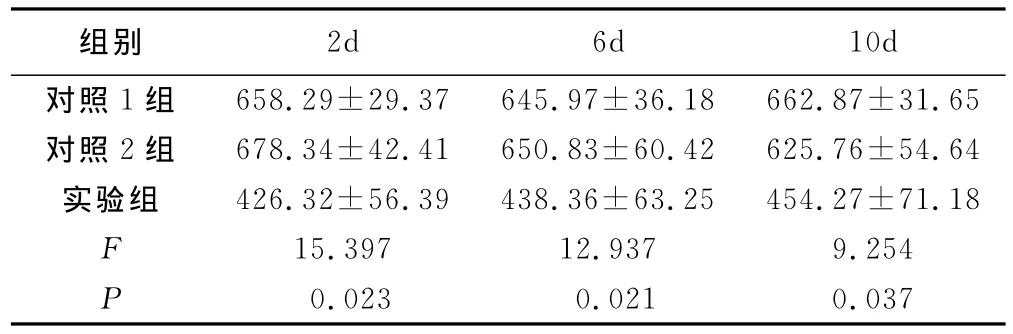
表1 不同时间点各组转染后cyclinD1表达情况()Table 1 The comparison on cyclinD1expression after gene transfection for different time
组别2d 6d 10d对照1组658.29±29.37645.97±36.18662.87±31.65对照2组 678.34±42.41650.83±60.42625.76±54.64实验组 426.32±56.39438.36±63.25454.27±71.18 F 15.397 12.937 9.254 P 0.023 0.021 0.037
2.2 反义cyclinD1转染后人角膜基质细胞增生的改变 反义cyclinD1转染后,A570值显著低于未进行反义cyclinD1转染的对照1组和对照2组,差异有显著性(P<0.05),提示反义cyclinD1具有抑制人角膜基质细胞增生的作用。对照1组与对照2组间A570值无显著性差异(P>0.05),提示lipofectamine对人角膜基质细胞增生无显著作用,见表2。
表2 不同时间点各组转染后A570值比较()Table 2 The comparison on A570values after gene transfection for different time

表2 不同时间点各组转染后A570值比较()Table 2 The comparison on A570values after gene transfection for different time
组别2d 6d 10d对照1组0.583±0.0360.451±0.0390.429±0.031对照2组 0.549±0.0510.421±0.0870.403±0.028实验组 0.392±0.0470.294±0.0340.291±0.031 F 16.387 13.856 10.349 P 0.021 0.027 0.038
3 讨论
本实验通过体外培养原代细胞获取人角膜基质细胞,通过免疫组织化学法以及MTT法检测,生物显微镜摄取cyclinD1着染图像,计算机图像处理系统分析,观察反义cyclinD1转染后,人角膜基质细胞增生情况的变化。结果显示,转染后2、6、10d,反义cyclinD1转染组A值以及A570值降低明显,与其他两组比较,差异有显著性(P<0.05)。但观察时间延长,相关数值有所回升,提示阳离子脂质体能够介导人角膜基质细胞进行反义cyclinD1转染,外源基因表达具有时间限制,不能与宿主细胞基因组进行整合,能够满足手术或创伤后进行抑制基质细胞增生的需求。MTT法检测提示阳反义cyclinD1基因转染能够对人角膜基质细胞增生进行抑制,而阳离子脂质体对细胞增生不具有影响作用。Motkura等在1991年首次在甲状旁腺腺瘤中克隆和鉴定出cyclinD1基因[5]。cyclinD1基因位于11q13染色体上,基因编码区含有高含量GC,末端含有1个Poly-A区(由69个腺苷酸残基组成),全长120kb,有5个外显子和4个内含子组成,编码蛋白共有295个氨基酸残基,第56~141位氨基酸序列称Cyclinbox,为保守序列[6]。cyclin D1是G1期细胞的细胞周期素,能够调控G1/S转换,目前相关研究已经证实cyclinD1协同Rb基因,控制CyclinD1-CDK4复合物形成,共同对G1期进程进行调控[7]。CyclinD1是已知的重要细胞周期调节因子,与肿瘤的发生发展具有密切关联[8~10],而随着研究的不断深入以及基因治疗在眼科治疗的新思路,反义基因转染技术进行抑制细胞增生的研究逐渐成为临床研究的热点[11,12]。本实验研究证实了反义cyclinD1基因转染能够抑制细胞增生,但是关于人角膜基质细胞反义cyclinD1基因转染后,RNA水平上的cyclinD1变化仍需进一步探讨和揭示。
4 结论
反义cyclinD1基因转染,一定时间内降低cyclinD1表达,抑制人角膜基质细胞增生,是角膜过度愈合反应的基因治疗的基础。
[1]Jung KH,Kim JK,Noh JH,et al.Targeted disruption of nemolike kinase inhibits tumor cell growth by simultaneous suppression of cyclinD1and CDK2in human hepatocellular carcinoma[J].J Cell Biochem,2010,110(3):687-696.
[2]Abdelkader A,El-Sayed ME,Kaufman HE.Confocal microscopy of corneal wound healing after deep lamellar keratoplasty in rabbits[J].Arch Ophthalmol,2010,128(1):75-80.
[3]Lange C,HuttnerWB,Calegari F.Cdk4/cyclinD1over expression in neural stem cells shortens G1,delays neurogenesis,and promotes the generation and expansion of basal progenitor[J].Cell Stem Cell,2009,5(3):320-331.
[4]Hartwell LH,Weinert TA.Checkpoints:controls that ensure the order of cell cycle events[J].Science,2009,246(4930):629-634.
[5]李永昊,肖玉周,汪万英,等.CyclinD1、CDK4、P16在骨肉瘤中的表达及临床意义[J].中华全科医学,2012,10(2):191-192.
[6]Dilek F H,Topak N,Tokyol C,et al.β-Catenin and its relation to VEGF and cyclinD1expression in pT3rectosigmoid cancers[J].Turk J Gastroenterol,2010,21(4):365-371.
[7]梁彩霞,吴 华.Hath1、P27和CyclinD1基因在恶性肿瘤中的表达及相关性研究[J].中国医学创新,2013,10(14):150-152.
[8]杨萍丽,彭心宇,刘戈然,等.cyclinD1、p27和ki-67在鼻咽鳞癌组织中的表达及意义[J].现代肿瘤医学,2012,20(6):1158-1160.
[9]李启炯,宋军民,陆 敏,等.CyclinD1在肝细胞癌中的表达及与肝细胞癌患者预后的关系[J].中华临床医师杂志(电子版),2012,6(2):356-360.
[10]高 涵,于建宪.胃癌组织中CyclinD1与P27蛋白表达及其意义[J].齐鲁医学杂志,2012,23(3):231-232.
[11]高丽昌,李婷婷,李富勇,等.ERK1/2信号通路在角质细胞生长因子-2诱导角膜基质细胞增值中的作用[J].中国药理学通报,2011,27(10):1405-1408.
[12]荣 蓓,晏晓明.反义cyclinD1基因转染对人角膜基质细胞增生的影响[J].眼科研究,2010,28(11):1025-1027.

