谈高中化学选修模块中核外电子排布的教学
摘要:列举了国内外文献中关于核外电子排布的若干观点,指出由于宏观、微观的物质研究方式上的差异,容易导致核外电子排布认知学习的两个误区。比较了3种版本选修教材对核外电子排布规律内容的呈现方式,建议以课程标准为依据,在教学过程中提倡用量子观点整体看待核外电子排布,更加客观、科学地描述,还原给学生一个真实的、本质的理论知识。
关键词:核外电子排布;原子结构;教学研讨
文章编号:1005–6629(2014)7–0050–04 中图分类号:G633.8 文献标识码:B
近期读了Eric Scerri发表在EIC(Education in Chemistry,英国《化学教学》)的一篇文章“The trouble with the aufbau principle”,文章主要阐述了以下观点[1]:(1)几代化学教师用“aufbau principle”(构造原理,aufbau源自德语,意为建造、构建等)误导了学生对核外电子排布的理解;(2)结合钪(Sc)的核外电子排布指出机械使用构造原理的不足;(3)迄今为止,很少的教学资源(教材)能准确地阐释多电子原子的核外电子排布。难道这么明显的问题直到今天才被发现?查阅文献资料发现,类似问题在国内很多杂志和教材早有阐述。如1956年徐光宪先生从光谱数据归纳出原子、离子的电子能级分组法[2];1988年王英杰综合了多种观点提出“绝不能把4s和3d轨道能级高低看成是第四周期元素原子电子填充次序的主要依据[3]”;北大华彤文教授等主编的《普通化学原理》中提出“电子轨道能量高低应根据能量公式综合考虑各个因素的总效果……[4]”。
经历了3轮高中化学“物质结构与性质”选修模块的教学,读了上述文献后感触颇多:自己平时也是依据能级能量高低顺序(构造原理:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d……)进行核外电子排布的教学的,问题出在哪?
1 两个关键问题
1.1 电子是逐个排入各能级的吗
包括笔者在内的很多中学老师都是这样教学生核外电子排布方式的:某元素,如氮元素原子核外共有7个电子,2个电子先排入K层,剩下5个电子排入L层,若L层排满排入M层……,这样进行原子核外电子排布在18号元素之前是没有问题的。有了能级的概念后,开始这样解释钾元素(Z=19)基态原子的核外电子排布,前18个电子依次排入1s、2s、2p、3s、3p能级,最后1个电子排入能量较低的4s能级(或4s轨道),即[Ar]4s1,依据是构造原理中电子先填充4s能级,后填充3d能级。到此,我们是否思考过这样的问题:多电子原子核外的电子是逐个排入的吗?不同能级(或原子轨道)的相对能量是固定不变的吗?
仔细想来,(1)多电子原子的核外电子排布不是逐个依次进入各能级的,原子核外电子是一个整体,只不过光谱实验的事实告诉我们哪样的核外电子排布最稳定(能量最低)。(2)对于钾、钙,用Slater规则计算E4s
1.2 先有构造原理,还是先有核外电子排布的事实著名化学家鲍林根据大量光谱实验数据以及理论计算的结果,绘制了原子轨道近似能级图(图2),同时他还强调,N层的4s轨道比M层的3d轨道稳定一些,各轨道的相对稳定性可用图2来近似地表示[8]。所以有一个问题必须明确:不是因为有了构造原理(或其他核外电子排布规律)才有了核外电子排布式,是科学家根据光谱实验数据发现了诸多元素的基态原子的核外电子排布方式,然后再用相关理论去解释,而这些理论本身就在逐步完善之中。
原著图题译文[9]:原子轨道能量的近似序列,每个圆圈代表1个原子轨道,它可以容纳1个电子或者2个自旋方向相反的电子,最下面的圆圈表示能量最低的原子轨道(1s)。
2 选修模块中核外电子排布规律的教学建议
2.1 严格、认真地把握课程标准中的教学要求
《普通高中化学课程标准(实验)》在内容标准主题1“原子结构与元素的性质”中提出“了解原子结构的构造原理,知道原子核外电子的能级分布,能用电子排布式表示常见元素(1~36号)原子核外电子排布[10]。”上述内容简洁明了,贴合学生的认知水平和认识层次,我们在教学中不能随意地进行增减,如“构造原理”是了解层次,不需研究其成因,显然“屏蔽效应”和“钻穿效应”是不宜在此补充的(竞赛辅导除外);电子排布式的掌握也有2个重要限定:①范围:1~36号,不需随意延伸;②对象:原子(简单离子不需出现)。
有时教学中的一些问题就是教师不经意的拓展、延伸导致的。还是以钪(Sc)为例:21号元素Sc的基态原子核外电子排布式为[Ar]3d14s2,本来是无可争议的,但如果有下列教学过程,情况就比较复杂了:
[师]试写出Sc+离子的核外电子排布式。
[生A] [Ar]3d04s2
[生B] [Ar]3d14s1
[师]为什么2位同学的答案存在差异,阐述各自的理由?
[生A] Sc+离子是在基态Sc原子的基础上失去1个电子得到的,那么能量最高的(最不稳定)的电子最易失去,根据构造原理示意图,3d能级的能量略高于4s能级,故有电子排布式:[Ar]3d04s2。
[生B] Sc+离子是在基态Sc原子的基础上失去1个电子得到的,4s能级属于N能层,是最外层,原子易失去最外层电子,故有电子排布式:[Ar]3d14s1。
事实上,2种回答的理由均将轨道能量固定化了,即用宏观思维处理微观现象,都是不可取的,Sc+离子的核外电子排布([Ar]3d14s1)是光谱实验的结果;但错不在学生,是我们的提问超出了课程标准的要求!
不仅有教师这样问、这样教,还有试题(高三模拟题)这样考,不少教师就是因为有了类似考题的出现(见下例)才进行了教学内容的拓展。试想,学生在掌握Ti的电子排布式([Ar]3d24s2)的基础上如何判断Ti2+基态的电子排布,是[Ar]3d04s2还是[Ar]3d24s0抑或是[Ar]3d14s1,不仅学生已有知识无从判断4s和3d轨道能量的相对大小,即便知道,原子与离子的计算方式也是不尽相同的,否则徐光宪先生就不会在“一个新的电子能级分组法”一文中将原子与离子区分对待了。
例 2013年某市高三一模试题(节选):氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。[其余小题略去]
2.2 理性、灵活地处理教材中的教学资源
从表1对3种版本教材对原子核外电子排布的教学内容编排梳理可以看出:三者内容选择、呈现顺序等既有共同点,又各具特色,我们在教学过程中需理性选择、灵活把握。
2.2.1 灵活处理构造原理的铺垫知识
3种版本教材在介绍核外电子排布规律之前均有相关知识的铺垫(表1),均在必修模块电子层(能层)的基础上用不同方法引入了能级(或原子轨道)的概念,为构造原理的介绍打好了基础。其中,人教版教材简单引入能级概念后直接给出构造原理,在后续内容中才逐渐展开能量最低原理、泡利原理及洪特规则的介绍,是“倒叙式”的编写方式;鲁科版则较为系统地在上一节内容中讲述了“量子力学对原子核外电子运动状态的描述(包括4个量子数)”,是典型的高校教材的编写模式;苏教版编写风格介于上述二者之间,可谓各有特色。
笔者建议教学过程中需根据教材特点化繁为简,突出主干知识,即始终围绕课程标准“能用电子排布式表示常见元素(1~36号)原子核外电子排布”的教学要求,不宜过度深化或简化,不要过早地要求学生从量子力学的角度分析电子的运动规律(适当了解是可以的),但也不能让学生机械地背诵构造原理,将微观知识宏观化。
2.2.2 仔细比较构造原理示意图
尽管名称不同,3种版本选修教材中均出现了“构造原理示意图”,且示意图中均用圆圈表示能级(或原子轨道),用箭头指向表示填充顺序,可仔细分析又略有不同:人教版和鲁科版均用彩色圆圈进行了颜色区分,其中人教版用同种颜色表示了主量子数(n)相同的原子轨道[14](图3),鲁科版用同种颜色表示了角量子数(l)相同的原子轨道(图略),苏教版则未做明显区别。更为重要的是,若将这3幅图与图2比较则会发现,鲍林的原子轨道能级近似图更加科学,其中不同能级之间的能量差不是“等距”的,尤其3d、4s等能级之间的能量差异很小,也没有所谓的“填充引导箭头”,图题也较为详细,突出了“approximate(近似)”等关键的限定词。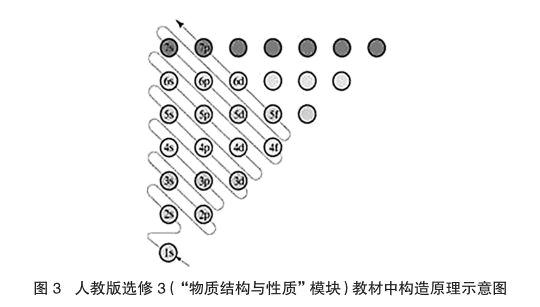
对于教师而言,应该知晓的是,图3中圆圈之间的距离不能代表真实轨道能量之间的差异(三种版本教材中的插图圆圈间都是等距的),不同能级之间的能量差异不易在一幅图上完整体现。由于高中学生缺乏对屏蔽效应、钻穿效应以及由此引起的能级交错的认识,我们在教学中不宜“深化拓展”对图3的认识。该构造原理示意图的价值就在于帮助学生对核外电子排布有一个初步的了解,对于学有余力的学生(如竞赛辅导课等)可以引导他们对图2、图3进行比较,并辅以能级交错进行补充说明。
2.2.3 理性看待教材中的补充说明文字
表1中列出的3种版本教材中的“补充说明文字”无论在正文中还是在特色栏目中,均对核外电子排布的教学起到了画龙点睛的作用。如果教材中没有“大多数”、“绝大多数”及“不可分辨”等看似模糊的修饰词语,核外电子排布的相关结论将缺乏科学性,而且主次、因果也会颠倒:核外电子排布规律只是从光谱实验和量子力学计算等归纳出的经验规律,是用来解释的一种理论,而不是电子排布的原因。要让学生知道“原子的核外电子排布要以实验测定的结果为准”[15]。教师在教学过程中需要对这些看似不起眼的“大多数”、“绝大多数”及“不可分辨”等修饰词语予以强调,以教给学生更加真实的化学,激发他们对微观世界的认知热情。
3 几点反思
3.1 用量子视角看待电子排布问题
原子核外电子排布是微观世界的问题,对待微观世界的问题不能随意搬用宏观问题的处理方法,例如电子层(electronic shell)和原子轨道(atomic orbitals)都是科学家为研究、解释问题方便进行的模型假设,而字面意思却让我们联想到现实生活中的层状结构(如洋葱模型)和轨道模型(如摩天轮、铁轨等),把一个个电子逐个去填充就是自然而然的事情了。可事实不是这样的,电子不会逐个填充到电子层上(倒是可以逐个失去电子),正如鲁科版教材所说“人们并不能指定哪个电子排布在哪个原子轨道上”[16]。很多物质结构中问题的出现皆出自微观问题宏观化的简单处理方式。
3.2 用否定之否定的辩证态度期待超越量子力学模型的理论的出现
目前为止,量子力学模型(Quantum Mechanical Model)是解释原子结构的最前沿的理论,可是谁都不能说我们已经对原子结构有了清楚透彻的认识,薛定谔方程可以解出单电子原子的电子概率分布和轨道能量[17],而多电子原子的薛定谔方程却只能用中心立场模型近似求解,故该模型也未成熟。经历了古希腊哲学家德谟克利特的古代原子观、道尔顿的近代原子学说、汤姆生的枣糕模型、卢瑟福的α粒子散射实验、玻尔理论、薛定谔方程……每一次原子结构新模型的提出都是对已有模型的否定,而所谓的“新”也是暂时的,随着科学的进步和技术的发展,难保“新”模型不会成为以后被否定的对象,在否定与肯定的交替中原子结构理论才会日臻完善[18],我们期待新的原子结构的理论出现……
参考文献:
[1] Eric Scerri. The trouble with the aufbau principle[J].Education in Chemistry. 2013.11(http://www.rsc.org/eic/2013/11/aufbauelectron-configuration).
[2]徐光宪.一个新的电子能级分组法[J].化学通报,1956,(1):80.
[3]王英杰. 4s和3d轨道的能级高低与电子的填充规律[J].东北师大学报自然科学版,1988,(1):121.
[4][17]华彤文等.普通化学原理[M].北京:北京大学出版社,2009:254.
[5][6]徐佳,徐光宪,王祥云.中性原子的轨道能量[J].化学通报,1986,(3):47.
[7][8] Linus Pauling. The nature of the chemical bond and the structure of molecules and crystals (3rd Edition) [M]. Cornell University Press. 1960:49.
[9]卢嘉锡等译.化学键的本质[M].上海:上海科学技术出版社,1984:42.
[10]中华人民共和国教育部制定.普通高中化学课程标准(实验)[S].北京:人民教育出版社,2003:20.
[11][14]吴国庆等.普通高中课程标准实验教科书·物质结构与性质(选修3)[M].北京:人民教育出版社,2009:5~6.
[12][15]王祖浩等.普通高中课程标准实验教科书·物质结构与性质(选修)[M].南京:江苏教育出版社,2004:13,15.
[13][16]陈光巨,王磊,王明召.普通高中课程标准实验教科书·物质结构与性质(选修)[M].济南:山东科学技术出版社,2007:11,13.
[18]顾晔.辩证思维方法在高中化学物质结构教学中的应用[J].化学教学,2013,(2):73.

