电化学氧化法处理垃圾渗滤液中氨氮实验研究
Elena Soloveva,李 伟,丁 晶,赵庆良
(哈尔滨工业大学市政环境工程学院城市水资源与水环境国家重点实验室,哈尔滨150090)
垃圾填埋场产生的垃圾渗滤液成分复杂,常含有高质量浓度的有机物、重金属、氨氮、氯离子和其他可溶性化合物,其中各种污染物的组成和质量浓度和垃圾填埋场的种类和年龄有关系,如不经处理,渗入地下后将严重污染地下水环境[1].为控制垃圾渗滤液给环境带来的危害,近年来其处理工艺一直是人们研究的热点.生物法处理垃圾渗滤液应用较为广泛[1],但当垃圾渗滤液的可生化性较差时,生物法效果不佳,目前研究较多的处理工艺主要包括混凝、活性炭吸附、高级氧化和膜处理工艺[2].采用 Fenton、光 - Fenton、臭氧、臭氧耦合过氧化氢或耦合紫外等方式,高级氧化技术作为生物难降解垃圾渗滤液的后续处理工艺取得了很好的处理效果,但是这些工艺对氨氮的降解作用不显著[3],因此急需开发一种对垃圾渗滤液中氨氮有良好降解效果的处理工艺.
电化学氧化技术由于其高效率、易操作、装置简单等优点,越来越受到研究者的关注.强氧化剂可直接在反应装置内产生,次生污染小,目前该方法已应用到多种污水中,如制革废水[4]、纺织废水[5]、养猪废水[6]和其他工业废水[7]等.阳极的选择对反应起到重要的作用,所以选择高效、尺寸稳定、耐腐蚀的电极是关键.在这些研究中采用了不同种类的阳极,如 Ti/Pt-Ir,Ti/RhOx– TiO2,Ti/PdO-CO3O4,TiO2/TiRuO2等,在这些电极的表面可以发生直接氧化和间接氧化,分别产生H2O2、·OH和活性氯等强氧化物质.
本研究对不同阳极材料、氯离子质量浓度和电流密度对模拟垃圾渗滤液中氨氮的去除进行研究,寻找到最佳的实验条件,并在此条件的基础上对实际的垃圾渗滤液进行处理,希望能给垃圾渗滤液的处理提出另一种解决方案,并为后续的扩大性实验提供实验数据支撑.
1 实验部分
1.1 实验装置
电化学氧化实验选用三种阳极(TiO2/SnO2,TiO2/RuO2-IrO2,TiO2/RuO2-IrO2-SnO2),以钛网为阴极,采用单阳极双阴极的系统进行,试验装置主要由电化学反应器、磁力搅拌器、稳压电源组成(如图1).反应器由有机玻璃制成,有效容积为500 mL,阳极和阴极面积相同,尺寸为60×120×2 mm,反应器采用有机玻璃穿孔板作为承托层放置极板,底部采用磁力搅拌转子使溶液混合均匀.稳压电源可为反应器提供0~30 V之间的稳定电压或0~3 A的稳定电流,本实验采用稳流模式进行,电压和电流在稳压电源上直接显示.
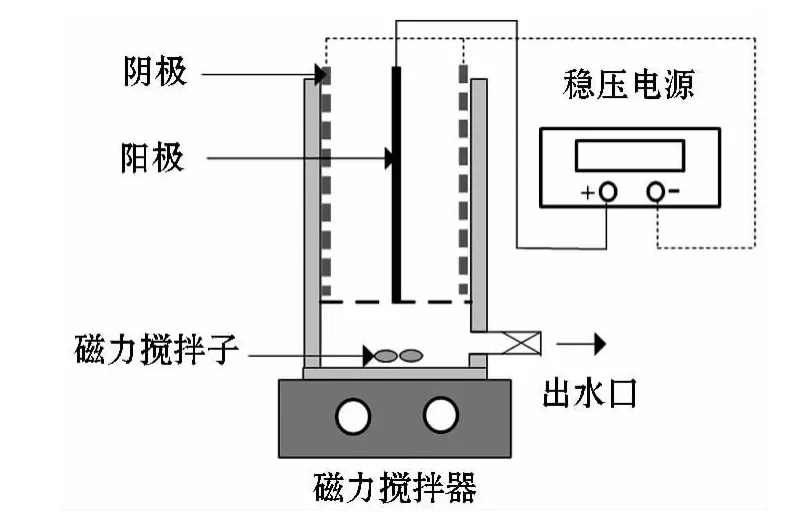
图1 反应示意图
1.2 实验及分析方法
实验中模拟配水采用硫酸铵和氯化钠进行配置,所用药品均为分析纯.不同的氯离子质量浓度通过氯化钠的添加进行调节.实验中的实际垃圾渗滤液取自哈尔滨市某垃圾填埋场,废水中氨氮在1 000 mg/L左右.本实验采用批次实验方法,注入废水后打开磁力搅拌器,调节电流至预设值,开始电化学氧化,间隔一段时间后从出水口取样进行分析测试.氨氮采用纳氏试剂分光光度法,氯离子采用离子色谱法,游离余氯测定采用国标中的DPD法,色度的测定采用450 nm波长下紫外分光光度法[8].
2 结果与讨论
2.1 电化学氧化操作条件的优化
2.1.1 不同阳极材料的影响
氨氮在电化学的过程中主要有两种氧化方式:直接氧化和间接氧化[9].直接氧化主要是通过电极析氧作用产生的·OH氧化氨氮,但在有氯离子存在的情况下,当电极的析氯电位较低时,间接氧化作用较明显,即通过电极的析氯作用产生的HOCl作为氧化剂,具体的反应在“2.2”中有描述.不同的阳极材料由于其特性不同,产生的析氧和析氯电位不同,因此对电化学氧化的影响较大[10].本研究选用 TiO2/SnO2,TiO2/RuO2- IrO2,TiO2/RuO2-IrO2-SnO2三种阳极分别对高质量浓度氨氮模拟废水进行电化学氧化研究,其他条件为氯离子质量浓度10 g/L,初始氨氮质量浓度1 g/L左右,电流密度20 mA/cm2,得出不同阳极条件下氨氮的降解情况(图2).
图2表明TiO2/SnO2电极降解高质量浓度氨氮废水效果速率最快,去除率可在180 min内达到95%,TiO2/RuO2-IrO2-SnO2电极的去除效果其次,在240 min时氨氮的降解率可达93%,TiO2/RuO2-IrO2在240 min时氨氮的去除率可达81%,三种电极对氨氮的氧化速率分别为5.61、4.37和3.18 mg/(L·min),氨氮的质量浓度和电解时间呈较好的线性关系,相关性系数分别为0.98,0.99和0.99,反应呈现准零级反应动力学,这和陈金銮[9]的研究结果一致.实验结果表明,在这三种不同材质的阳极下,电化学氧化法对氨氮有良好的降解效果,相对来说,TiO2/SnO2电极降解高质量浓度氨氮优势更为明显,氧化速率更快.
2.1.2 不同氯离子质量浓度的影响
图3为不同氯离子质量浓度下氨氮电化学氧化去除的情况,可以看出,在较小的电流密度情况下(5 mA/cm2),氨氮质量浓度的变化与时间呈准零级反应动力学,去除率随氯离子质量浓度的增大而增大,电解240 min后,分别从11%,12%升高到27%,但当氯离子从10 g/L升高到20 g/L时,氨氮的降解效率升高不明显,考虑到氯离子的添加将加大处理的药剂成本,且出水中的盐度过高,将对后续的处理或受纳水体造成负担,所以氯离子质量浓度为10 g/L时为最佳的添加质量浓度.反应结束后,氯离子质量浓度变化较小,下降幅度均小于6%,说明氯离子在体系中得到了较好的循环利用.

图3 电解过程中不同氯离子质量浓度对氨氮降解的影响
2.1.3 不同电流密度的影响
为研究电流密度对氨氮去除的影响,在TiO2/SnO2电极下,选择氯离子质量浓度10 g/L,初始氨氮质量浓度1 g/L左右,电流密度分别调节至5、10、15、20 mA/cm2的条件下进行电化学氧化实验.结果如图4所示.从图4中可以看出,不同的电流密度下氨氮的降解也符合准零级反应动力学,电流密度越大,氨氮的降解效果越好,这和曾次元的研究结果一致[11-12],原因是电流密度越大,更多的电子将产生更多的强氧化剂,进而加快氨氮的降解.当电解时间延长至240 min后,电流密度在5、10、15、20 mA/cm2的条件下的氨氮去除率分别为27%、39%、69%和98%.
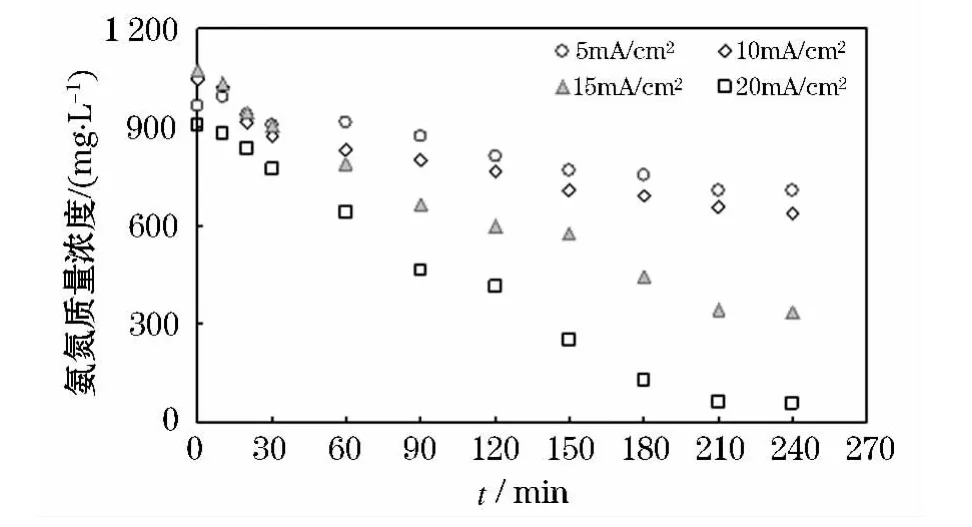
图4 电解过程中不同电流密度对氨氮降解的影响
从图4可计算出不同电流密度下的氨氮的电化学氧化速率,在图5中,将氧化速率和电流密度作图,可发现氨氮的电化学氧化速率和电流密度成良好的线性关系,且有如下关系:
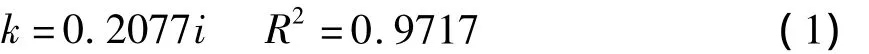
其中:k为氨氮的电化学氧化速率;i为电流密度.
从图5可看出,对于高质量浓度氨氮废水,最优的操作条件是采用TiO2/SnO2电极,选择氯离子质量浓度10 g/L,电流密度为20 mA/cm2,在该条件下,只要电化学氧化的时间足够长,氨氮可得到完全的去除.电化学方法的操作简易,可控性强,降解效率高,相对于其他工艺在高氨氮废水的处理上有无可比拟的优势.
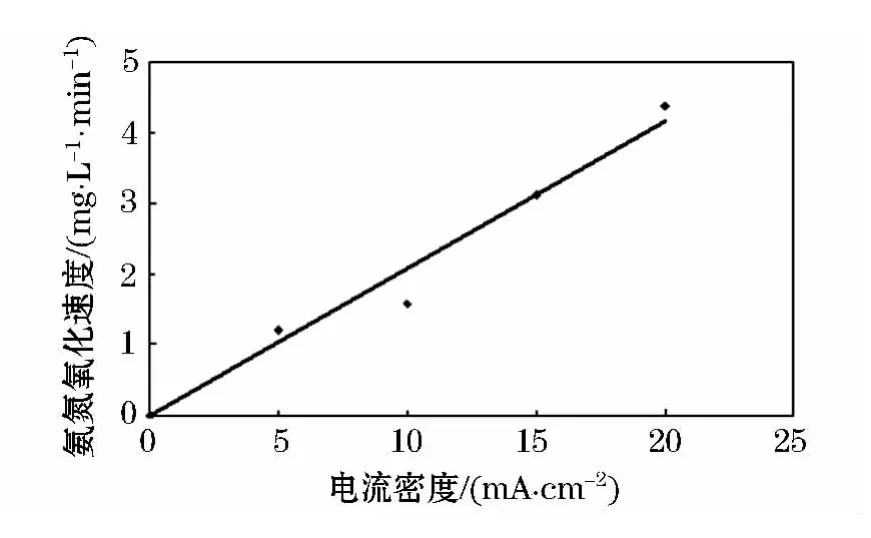
图5 不同电流密度对氨氮降解速率的影响
2.2 实际垃圾渗滤液的处理情况
采用电化学氧化法在最优的条件下处理实际垃圾渗滤液,氨氮降解的结果如图6,从图6中可看出,电解240 min后,废水中氨氮从944 mg/L降至最低检出限以下,说明氨氮可得到全部去除,色度的脱除率可达到82%,可以很明显观察到垃圾渗滤液的颜色由深黑转为淡黄色.氨氮在降解的同时,反应器中还检测到余氯的产生,当氨氮质量浓度被降低到较低水平时(见图中电解时间150 min后),系统中游离余氯的质量浓度呈线性升高,持续电解供给电子将产生余氯,当体系中氨氮质量浓度较低时,无法消耗的余氯便造成了余氯的积累,同时阻止了氯离子在体系中的循环,如反应(2)~(5)所描述:
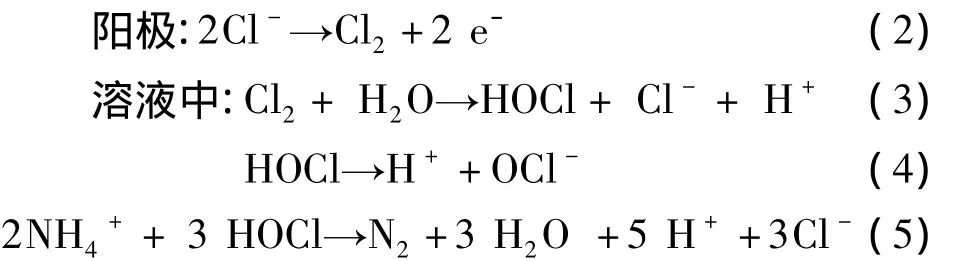
因此,该方法在实际的垃圾渗滤液上除氨氮也有良好的效果,同时还可以去除垃圾渗滤液的色度,但在实际的运行调试过程中,要及时监测氨氮的质量浓度,避免长时间的电解造成能耗的浪费.
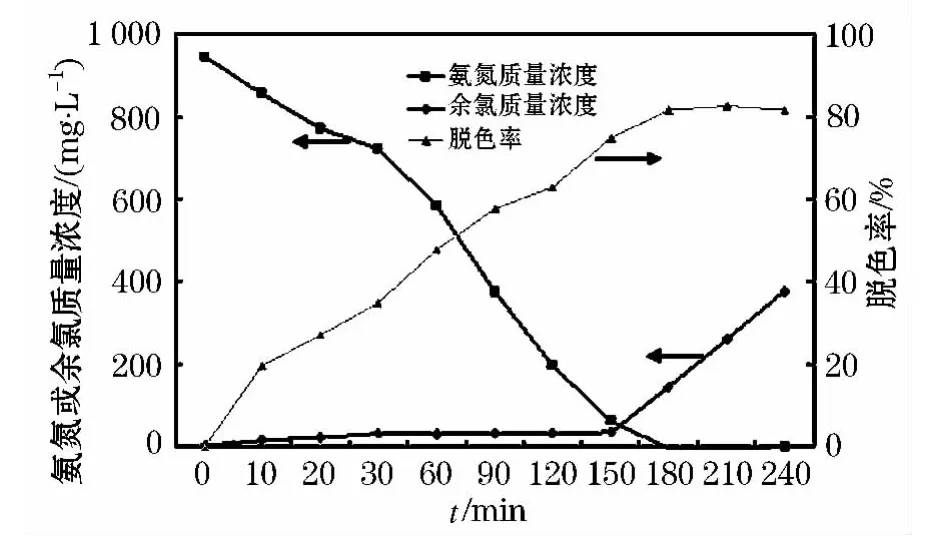
图6 垃圾渗滤液中氨氮、余氯和色度随电解时间的变化情况
3 结语
通过模拟废水的条件优化和实际废水的验证实验结果表明,电化学氧化法对高质量浓度氨氮有较好的脱除效果.具体结论如下:电化学反应器中氨氮的去除呈零级反应动力学,氨氮质量浓度和电解时间呈线性下降关系.不同的阳极对氨氮的去除有一定的影响,相比之下,TiO2/SnO2电极有较好的氧化效果.氯离子质量浓度对氨氮的去除影响也较大,氨氮的氧化速率随氯离子质量浓度的升高而升高,但由于氯离子的添加将造成盐度升高,所以最优氯离子条件选在10 g/L.电流密度越大,氨氮的降解效果也将更好,氨氮的电化学氧化速率和电流密度成良好的线性关系.在最优条件下处理实际垃圾渗滤液,结果发现,电解240 min后,氨氮可完全去除,色度的去除率达82%.
[1]ILIES P,MAVINIC D S.The effect of decreased ambient temperature on the biological nitrification and denitrification of a high ammonia landfill[J].Wat.Res,2001,35(8):2065 -2072.
[2]CABEZA A,URTIAGA A,RIVEROM J,etal.Ammonium removal from landfill leachate by anodic oxidation[J].Journal of Hazardous Materials,2007,144(3):715 -719.
[3]WANG F,SMITH D W,EL-DIN M G.Application of advanced oxidation methods for landfill leachate treatment—a review[J].Journal of Environmental Engineering and Science,2003,2(6):413-427.
[4]RAO N N,SOMASEKHAR K M,KAUL S N,etal.Electrochemical oxidation of tannery wastewater[J].Journal of Chemical Technology and Biotechnology,2001,76(11):1124 -1131.
[5]KORBAHTI B K,TANYOLAC A.Continuous electrochemical treatment of simulated industrial textile wastewater from industrial components in a tubular reactor[J].Journal of Hazardous Materials,2009,170(2 -3)771 -778.
[6]OU Y C,ShANG X,WANG X Z,etal.Study of ammonia nitrogen removal in swine wastewater by electrochemical oxidation process[J].Technology of Water Treatment,2010,36(6):111-115.
[7]RAJKUMAR D,PALANIVELU K.Electrochemical treatment of industrial wastewater[J].Journal of Hazardous Materials,2004,113(1-3)123-129.
[8]TURRO E,GIANNIS A ,COSSU R,GIDARAKOS E,etal.Electrochemical oxidation of stabilized landfill leachate on DSA electrodes[J].Journal of Hazardous Materials,2011,190(1 -3):460-465.
[9]陈金銮.氨氮的电化学氧化技术及其应用研究[D].北京:清华大学,2008.
[10]CHIANG L C,CHANG J E,WEN T C.Indirect oxidation effect in electrochemical oxidation treatment of landfill leachate[J].Water Research,1995,29(2):671 -678.
[11]ZENG CY,LI L,ZHAO X Y,etal.The factors affecting the removal of ammonia nitrogen by electrochemical oxidation[J].Journal of Fudan University(Natural Science),2006,45(3):348-352.
[12]赵庆良,卜 琳.生化-物化法处理渗滤液溶解性有机物光谱特征[J].哈尔滨商业大学学报:自然科学版,2011,27(3):292 -295,303.

