直接器官发生途径的榉树微繁体系建立
刘雪梅,罗雪梅,王 征,金晓玲
(中南林业科技大学风景园林学院,中国长沙 410004)
榉树(Zelkova schneideriana)不仅是珍贵的阔叶用材树种[1-2],也是重要的园林树种[3].由于过度采伐,我国的野生榉树资源已经相当匮乏[4].组培快速繁殖技术能较好地保持母树的优良性状,繁殖不受外界环境限制,因此该技术已经在许多植物优良品种的工厂化生产中得到应用[5-6].榉树组织培养技术的研究目前还处于初期阶段[7],主要利用茎尖或愈伤组织诱导的方法进行增殖.但是利用茎尖培养的方法,具有繁殖系数低的缺点[8],而利用愈伤组织诱导的途径则后代容易产生变异[9].本文拟建立通过榉树外植体直接器官发生途径诱导不定芽或侧芽的形成,再经继代和增殖培养获得大量的不定芽,最后诱导生根成苗的榉树微繁技术体系.以期能在保持母树优良特性的前提下,提高不定芽的繁殖系数,为榉树工厂化育苗提供一定的技术支持.
1 材料和方法
1.1 试验材料
供试材料栽植于中南林业科技大学校园内,外植体为当年生带芽茎段,采集于选育出的榉树黄色品系的优树枝条,见图1A.
1.2 试验方法
1.2.1 初代培养 基本培养基采用MS,附加不同浓度的BA,共设6个处理,每个处理4个重复,每个重复8个插穗,共32个插穗.25 d后统计腋芽萌发率、有效芽诱导率及芽平均生长高度.
1.2.2 继代培养 当初代诱导的不定芽长到1.5 cm左右时,将萌发的幼芽从基部切下,并接种到增殖培养基中培养,基本培养基采用MS,附加了不同浓度的BA和NAA,共设9个处理(L9(34)),每个处理8个幼苗,重复4次,25 d后统计芽的增殖率、芽苗总数及芽苗的平均高度,计算增殖系数.
1.2.3 壮苗培养 在壮苗培养试验中,以高1.0 cm左右的不定芽为试验材料.基本培养基采用MS,附加了不同浓度的BA和GA3,共设5个处理.每种处理8个幼苗,重复4次,25 d后观察芽的生长状况.
1.2.4 生根培养 将经过壮苗培养的再生苗接种到生根培养基上,以1/2MS为基本培养基,附加了不同浓度的NAA和活性碳诱导生根,共设5个处理.每个处理8个幼苗,重复4次,25 d后统计平均生根率、平均生根条数、平均根长及平均茎高.
1.2.5 培养条件 培养基均附加琼脂6 g/L,蔗糖30 g·L-1,pH为6.0.以上实验的培养条件均为培养温度25±2 ℃,光照强度1 500 lx,光照时数14 h·d-1.
2 结果与分析
2.1 细胞分裂素BA对榉树初代培养不定芽诱导的影响
细胞分裂素对榉树带芽茎段诱导的影响结果见表1和图1B.由表1可以看出,BA浓度对榉树带芽茎段的萌发率、有效芽诱导率以及芽的平均高度等都有显著影响,总体表现为随着BA浓度的增加,萌发率逐渐提高,当达到一定值后,随着BA浓度的增加,芽的萌发率逐渐下降.当BA浓度为2.25 μmol/L时,芽的萌发率为80%,当BA浓度为4.50 μmol/L时,萌发率达到最大值83.33%,但两者没有显著差异,有效芽诱导率达到76.67%,芽的平均高度也较高,2.6~3.0 cm,见图1C;随着BA浓度的增加,萌发率、有效芽诱导率以及芽的平均高度等都逐渐下降,当BA浓度为35.8 μmol/L时,不定芽的诱导率只有30%,芽的高度不足0.5 cm,见图1D.因此,榉树带芽茎段的萌发需要较低浓度的BA,合适的初代培养基为MS+BA 2.25~4.5 μmol/L.

表1 榉树茎段初代培养实验结果Tab.1 The results of Z.schneideriana stem initial culture
2.2 不同激素浓度对不定芽继代和增殖的影响
BA和NAA的不同浓度和组合对榉树不定芽增殖的影响不同,实验结果见表2.由表2可知,9种处理对不定芽增殖培养有显著影响.其中E4不仅增殖系数最高,其有效苗数也最多,E4处理芽生长情况也是最好的,其培养基配方是MS+BA 2.25 μmol/L,增殖系数为5.1.对不定芽增殖系数进行多因素方差分析,其结果见表3.
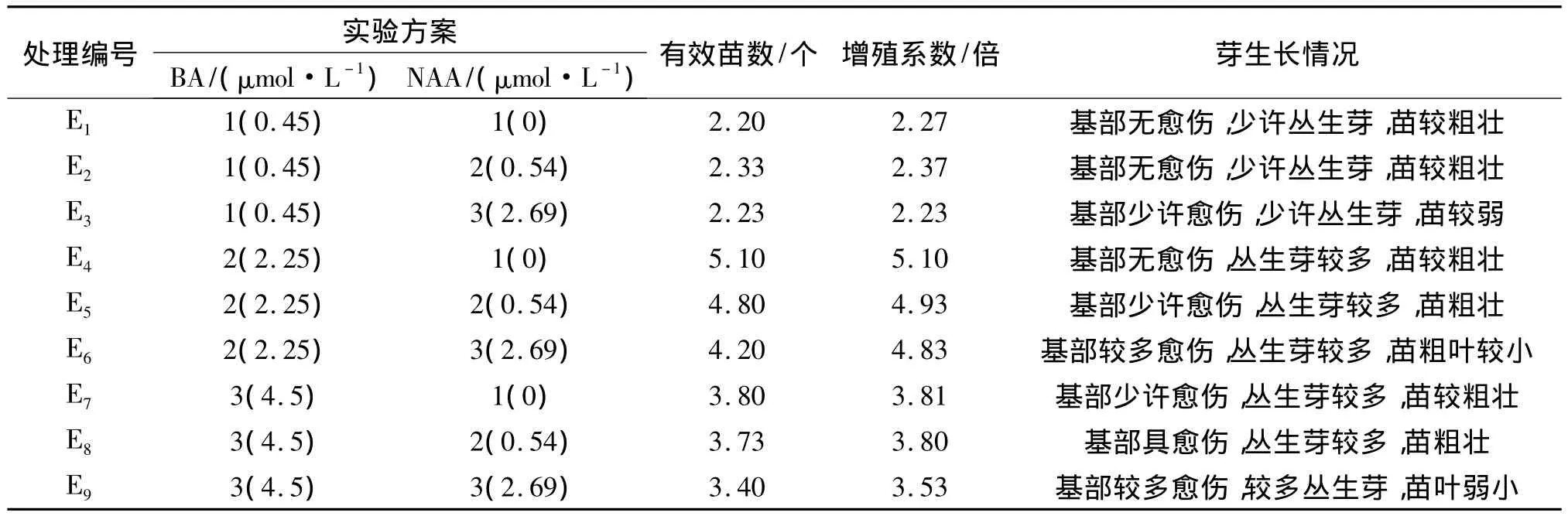
表2 榉树不定芽的继代增殖培养试验结果Tab.2 The shoots multiplication results of Z.schneideriana adventitious bud
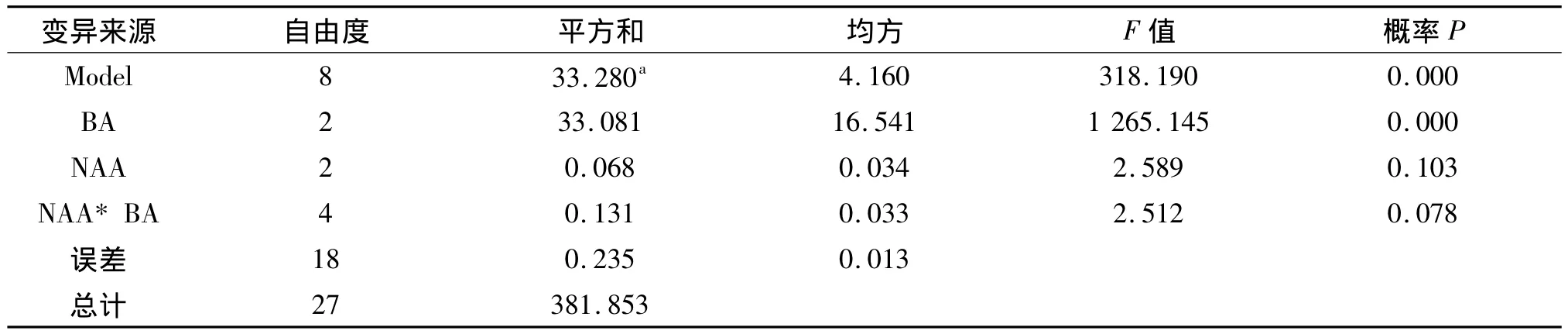
表3 增殖倍数方差分析结果Tab.3 The variance analysis results of the multiplication rate
由表3可以看出,处理的总效应达到了极显著水平:F=318.190,P<0.01,但BA和NAA之间的交互作用的效应却不显著.进一步对BA和NAA两种因素进行了多重比较,结果见表4和表5.

表4 BA 3水平的Duncan检验Tab.4 Duncan's three level test for BA
由表4可知,试验中BA所选取的3个水平之间均存在极显著的差异,BA为不定芽增殖的主要影响因素.从平均值来看,BA水平在2.25 μmol/L时,其平均值最高,为4.922.由表5可知,试验中NAA所选取的3个水平之间差异不显著.从统计结果来看,在不定芽增殖阶段不添加生长素NAA最好.

表5 NAA 3水平的Duncan检验Tab.5 Duncan's three level test for NAA
综上所述,BA是影响不定芽增殖培养的主要因子,NAA及其与BA的交互作用对增殖的结果效果不显著.因此,榉树不定芽继代增殖培养最优培养基配方为MS+BA2.25 μmol/L,即E4组合,见图1E,F.
2.3 不同激素浓度及组合对不定芽壮苗培养的影响
为了使组培苗健壮,在基本培养基中添加了不同浓度配比的BA和GA3,结果见表6.由表6可知,单独使用BA,榉树不定芽能生长;单独使用GA3不能促进不定芽生长;BA和GA3的配合使用能促进不定芽生长和壮苗,但试验中发现,低浓度的GA3(1.45 μmol/L)可以达到壮苗的目的,过高浓度的GA3反而会抑制不定芽的生长(2.9 μmol/L).因此,榉树不定芽壮苗适宜的培养基为 MS+BA 2.25 μmol/L+GA31.45 μmol/L,见图1G.

图1 榉树直接器官发生途径植株再生过程A.带芽壮苗培养茎段外植体;B.初代培养;C.MS+BA 2.25 μmol/L;D.MS+BA 35.8 μmol/L;E.继代培养;F.增殖培养;G.壮苗培养;H.生根培养;I.1/2MS+NAA 2.69 μmol/L+活性炭0.1 g·L-1Fig.1 The process of plantlet rgeneration through direct organogenesisA.Stems with a bud as explants;B.Initiation culture;C.Adventitious buds on MS+BA 2.25 μmol/L;D.Adventitious buds on MS+BA 35.8 μmol/L;E.Subculture;F.Propagation;G.Culture for sound seedling;H.Rooting culture;I.Rooting on 1/2MS+NAA 2.69 μmol/L+activated carbon 0.1 g·L -1
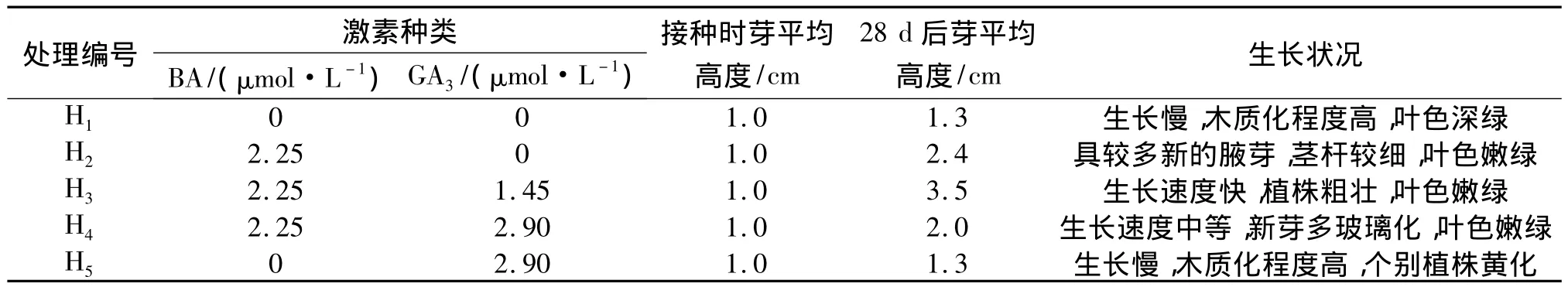
表6 榉树不定芽的壮苗培养试验结果Tab.6 The results of shoots on strong seedlings culture
2.4 不同浓度的NAA和活性炭对不定芽生根培养的影响
不同浓度的NAA和活性炭对榉树不定芽生根培养的影响见表7.由表7可知,在试验所选取的浓度中,生根培养基中添加较高浓度的NAA和较低浓度的活性炭有利于榉树不定根的诱导和生长.适宜的榉树不定芽生根培养基配方为 I4,即 1/2MS+NAA 2.69 μmol/L+0.1 g·L-1活性炭,生根率 77.8%,生根数达 4.5条,见图1H,I.
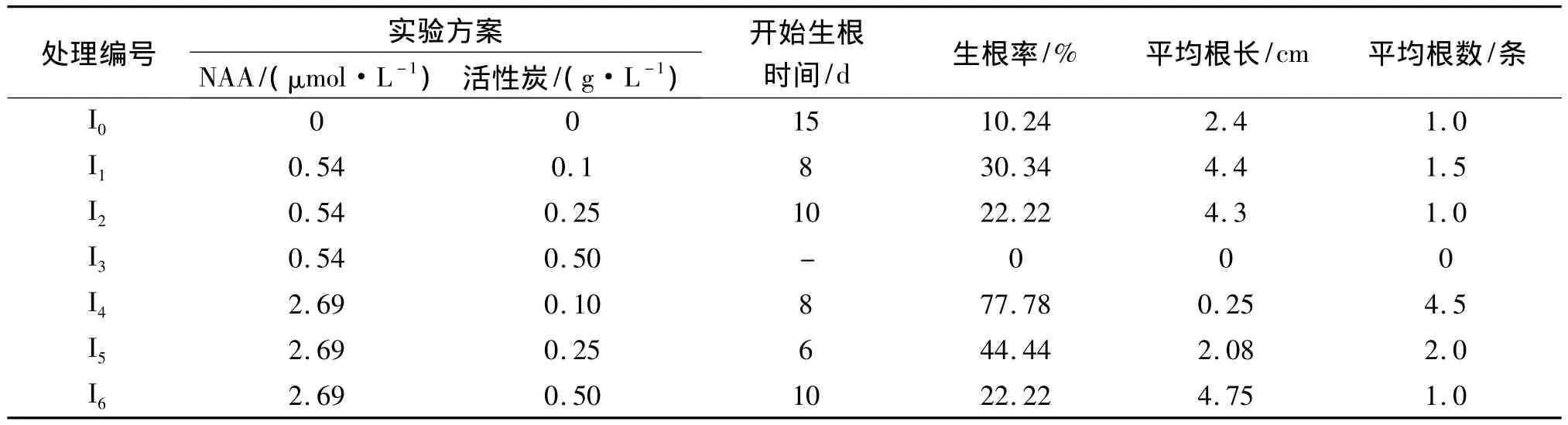
表7 榉树生根培养试验结果Tab.7 The experimental data of Z.schneideriana rooting
3 结论与讨论
木本植物器官发生过程中,植物生长调节剂对不定芽的诱导和生长发育起着重要的作用,在直接诱导不定芽的形成时,细胞分裂素应高于生长素的用量或只用细胞分裂素.已有研究表明[7-9],直接诱导榉树不定芽形成时,只用细胞分裂素或细胞分裂素高于生长素的用量诱导效果好.因此,在初代培养的实验设计中只考虑细胞分裂素对榉树带芽茎段诱导的影响.这与周燕青等[10]对条叶榕的组织培养研究结果相似.
以当年生带芽茎段为外植体,建立起了榉树外植体通过器官发生途径直接诱导形成不定芽或侧芽,再通过诱导生根而成苗的榉树微繁技术体系:最适诱导培养基为MS+BA 2.25 μmol/L或2.50 μmol/L;最适增殖培养基为 MS+BA 2.25 μmol/L;最适壮苗培养基为 MS+BA 2.25 μmol/L+GA3 1.45 μmol/L;最适生根培养基为1/2MS+NAA 2.69 μmol/L+活性炭0.1 g·L-1.榉树不定芽诱导生根的试验设计中只选择了NAA一种生长素,常用的IBA或NAA与IBA混合使用效果是否更好还有待进一步研究.
离体器官发生方式大致分为直接器官发生和间接器官发生2种方式.间接器官发生途径再生不定芽的细胞突变率较高,不利于保持原植株的母本优良性状,而直接器官发生途径则能很好的保持母本的优良特性,而且直接诱导的不定芽与通过愈伤组织诱导产生的不定芽相比,前者不仅繁殖周期短,而且不定芽生长速度快[11].这为进一步研究榉树工厂化育苗提供了一定的参考.
由于榉树是高大的落叶乔木,其组织培养快速繁殖技术要真正应用于工厂化生产还有许多问题需要解决,如外植体的采样时间和采样母树的树龄是否对不定芽的诱导产生影响等等.
[1]毕 波,刘云彩,陈 强,等.榉树对大气污染物的净化能力研究[J].西部林业科学,2011,40(4):77-79.
[2]JIN X L,HU X J,SUN Y P,et al.Callus induction and plant regeneration from immature embryos of Zelkova sinica Schneid.[J].Hort Sci,2012,47(6):790-792.
[3]金晓玲.榉树的生物学特性和微繁技术研究[D].长沙:中南林业科技大学,2003.
[4]汪灵丹,张日清.榉树的研究进展[J].广西林业科学,2005,34(4):188-191.
[5]DIEGO N D,MONTALBÁN I A,MONCALEÁN P.In vitro regeneration of adult Pinus sylvestris L.trees[J].South Afr J Botany,2010,76(1):158-162.
[6]KATSUAKI I,NAOKI T,MANABU K,et al.Tissue culture of two medicinal trees native to Japan[J].BMC Proceedings,2011,5(7):1-11.
[7]汪灵丹,张日清,金晓玲.大叶榉顶芽诱导与增殖培养[J].中南林业科技大学学报,2010,30(6):75-79.
[8]JIN X L,ZHANG D L,HE P,et al.Invitro plant regeneration of Zelkova schneideriana,an endangered woody species in China,from leaf explants[J].J Hort Sci Biotech,2009,84(4):415-420.
[9]金晓玲,何 平.大叶榉愈伤组织诱导与继代培养的影响因素[J].中南林学院学报,2003,23(1):32-36.
[10]周燕青,丁 兰,徐步青,等.不同植物生长调节物质对条叶榕组织培养的影响[J].浙江农林大学学报,2013,30(3):453-458.
[11]王 征,金晓玲,刘雪梅,等.杜仲成熟胚器官发生途径的研究[J].中南林业科技大学学报,2013,33(6):79-83.

