固定化微生物制备技术及生物脱氮研究*
戴 昕, 安立超
(1.南京科盛环保科技有限公司, 南京 211500;2.南京理工大学环境与生物工程学院, 南京 210094)
生物脱氮是目前针对中低浓度氨氮废水处理应用最广泛的工艺,但传统生物脱氮工艺存在着单位容积微生物(尤其是硝化细菌)生物量较少、硝化细菌世代周期较长且易流失、系统容积及占地均较大、抗冲击能力弱、剩余污泥量大等问题[1-2],固定化微生物技术可为解决上述问题提供一种新的思路[3-10]。它是利用物理或化学手段将微生物限制或定位于限定的空间区域,使之成为水不溶性、但仍能保留生物活性且在适宜的条件下还可以增殖的技术,具有产泥量少、抗冲击负荷能力强、微生物不易流失、泥水易分离、不发生污泥膨胀等优点[11-12]。近年来,固定化技术应用于氨氮废水处理方面的相关研究表明,基于固定化技术的生物脱氮工艺可以有效地维持系统内硝化细菌数量,提高系统的氨氮去除能力以及抗冲击能力,甚至在低温条件下也能取得较好的氨氮去除效果[13-18]。固定化技术高效、经济、稳定的特点较好地弥补了传统生化脱氮工艺的不足,具有良好的研究和应用价值。本研究采用模拟合成氨废水,对聚乙烯醇铝盐包埋法固定化微生物制备技术进行改良,利用载体经适当干燥后机械强度得到提高的特性,寻求一种传质性能及处理效果更好、更为经济的固定化微生物制备方法。
1 材料与方法
1.1 实验材料
1.1.1 菌种来源
实验用菌种取自南京某化肥厂SBR污水处理设施,并经过驯化、富集培养得到。
1.1.2 实验废水
实验废水采用模拟合成氨废水,水质成分包括:1.1 g/L NH4Cl,0.5 g/L 葡萄糖,2.5 g/L NaHCO3,0.5 g/L K2HPO4,并加入适量的 Fe、Mg、Ca 等微量元素。
1.1.3 实验材料
聚乙烯醇(PVA)1 750±50,国药集团化学试剂有限公司;海藻酸钠(SA)(化学纯),上海化学试剂采购供应站分装厂;二氧化硅,宜兴市第二化学试剂厂;实验所用其它试剂均为国产分析纯。
1.2 实验方法
1.2.1 固定化微生物小球制备方法
将一定质量的PVA在100℃左右的温度下完全溶解于清水中,向其中加入一定质量的SA以及SiO2并混合均匀,待混合胶体冷却至30℃左右时与实验菌种按照一定的包菌量(离心污泥与聚乙烯醇溶液的质量比)混合均匀后,将其滴加至含有一定浓度硫酸铝的饱和硼酸溶液中,并在4℃条件下交联固定24 h。交联固定过程中PVA与硼酸发生如下反应:

SA与铝盐的反应是通过Al3+取代SA中的Na+来形成凝胶网络,其中Al3+是通过离子键与海藻酸盐高分子聚合物中的R-COO-相结合。
交联固定完成后取出固定化微生物小球体并洗涤2~3次,再将其放入烘箱去除一部分水分后备用。
1.2.2 固定化微生物相对活性
相对活性计算公式如下:
R=rˊ(NH+4-N)/r°(NH+4-N)×100%
式中:rˊ(NH+4-N)—— 固定化后氨氧化速率,mg/(L·h)
r°(NH+4-N)——固定化前氨氧化速率,mg/(L·h)
1.2.3 分析方法
氨氮浓度测定采用纳氏试剂分光光度法[19];NO2-N浓度测定采用N-(1-萘基)-乙二胺光度法[19];NO3-N浓度测定采用紫外分光光度法(B)[19]。
2 实验结果及分析
2.1 正交试验
包埋剂中PVA、SA的浓度、固定液中硫酸铝浓度及包菌量对载体的强度及传质性能均有较大影响。同时考虑到干燥后的固定化小球具有体积缩小、传质性能降低、强度增大等特征,实验在正交试验的设计过程中采用低浓度包埋胶体和固定液。实验采用4因子3水平正交试验表,如表1所示。
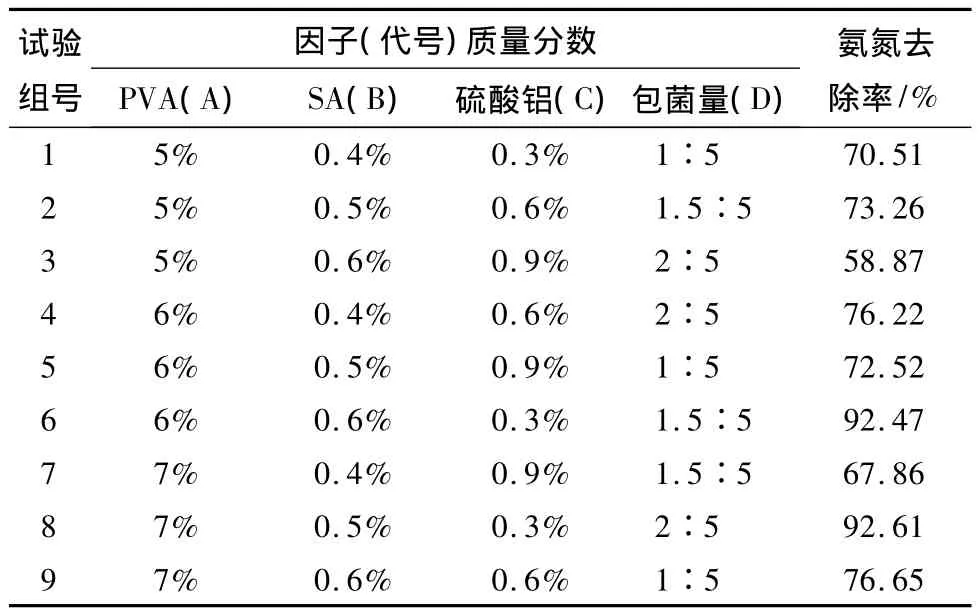
表1 正交试验表
对表1数据进行分析可得到正交试验结果,如表2所示。
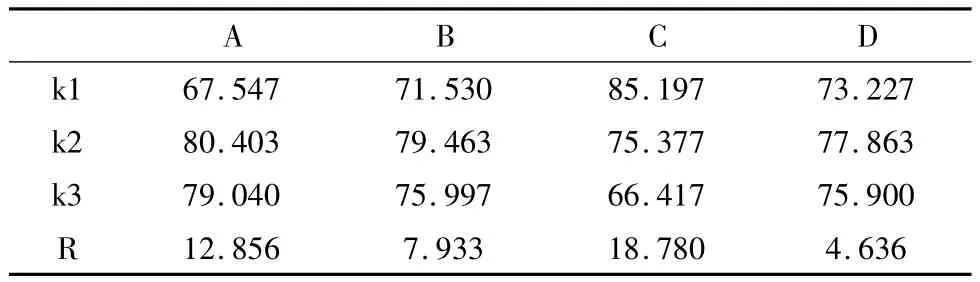
表2 正交试验结果
通过表2比较多因素的级差R,确定其主次关系为:硫酸铝浓度>PVA浓度>SA浓度>包菌量(离心污泥与聚乙烯醇溶液的质量比)。最佳的固定化配比是A2B2C1D2,即在PVA质量分数为6%,SA质量分数为0.5%,硫酸铝质量分数为0.3%,包菌量为1.5∶5,固定化微生物凝胶球具有较好的氨氮去除性能。除了处理效果,载体寿命和制备难易度也一个重要因素。PVA质量分数为5.0%时,凝胶球强度很小,PVA质量分数为6.0%时,凝胶球强度好,当PVA质量分数为7.0%时,凝胶球强度最好,但溶液的粘稠度增大,制备难度增加。
2.2 胶体浓度对小球成球性及强度的影响
为了对载体包埋胶体浓度进一步优化,实验在PVA质量分数在4.5% ~5.5%,SA质量分数在0.4%~5.5%的条件下,对载体的成球性及强度进行考察,结果如表3所示。
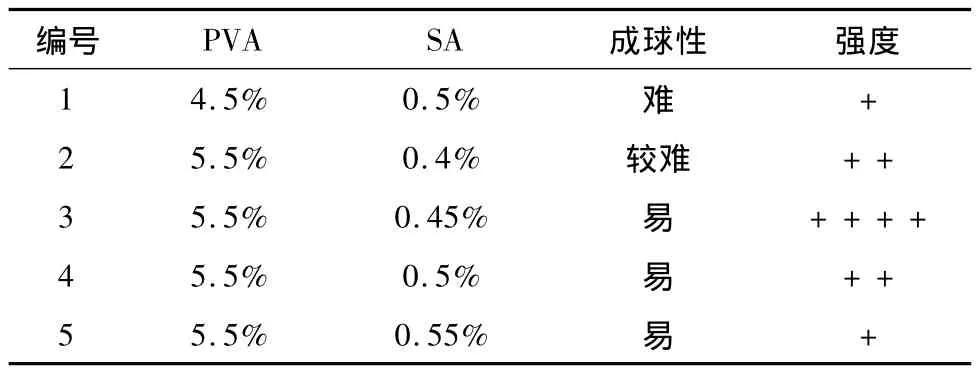
表3 胶体浓度对小球成球性及强度的影响
由表3可知,当PVA质量分数为5.5%,SA质量分数为0.45%时,载体成球性及强度均较好。相比于PVA质量分数为6%,SA质量分数为0.5%的载体,该浓度条件下载体的制备成本更省。
2.3 包菌量对固定化微生物处理效果的影响

图1 不同包菌量条件下的氨氮去除效果比较
包菌量是固定化微生物的一个重要参数。包菌量过低将导致载体内微生物偏少而影响处理效果;而包菌量过高会降低载体强度。实验将活性污泥在3 000 r/min的离心机中离心15 min后加入到包埋剂中,并对不同包菌量条件下固定化微生物小球体的强度及对废水中氨氮的去除效率进行比较。试验结果如图1所示。由图1可以看出:随着包菌量的增加,固定化微生物对氨氮的去除效率随之提高。当包菌量达到1∶2.5(40 g/100 mL包埋剂)时,12 h停留时间的氨氮去除率达到91.6%。之后随着包菌量的进一步提高,固定化微生物对氨氮去除效率的提高并不明显,且小球抗拉性降低。当包菌量等于或大于1∶2(50g/100mL包埋剂)时,经过短时间曝气后小球便开始出现破损现象。
2.4 硫酸铝浓度对固定化微生物处理效果的影响
固定液中硫酸铝浓度影响着固定化微生物小球体的成球性、传质性能及微生物活性。实验在饱和硼酸固定液中加入不同质量的硫酸铝,考察不同硫酸铝浓度时固定化微生物载体对废水中氨氮的去除情况。试验结果如图2所示。

图2 不同硫酸铝质量分数条件下的出水水质
由图2可以看出,当硫酸铝质量分数为0.3%时,氨氮去除率为42.4%,但载体在制备过程会发生粘连现象;随着固定液中硫酸铝浓度的不断提高,固定化微生物小球对氨氮的去除效率不断降低。当硫酸铝质量分数为0.6%时,氨氮去除率为38%,同时固定化微生物载体成球性得到改善。
2.5 不同程度的干燥条件对固定化微生物处理效果的影响
实验对固定化微生物小球采用鼓风干燥处理是为了提高其机械强度。干燥程度越高,载体强度越好。但干燥过程也会造成部分微生物因失水而丧失活性。实验将四份相同配比的固定化载体放入30℃鼓风干燥箱内进行不同程度的干燥处理,并考察不同程度的干燥条件对固定化微生物处理效果的影响。试验结果如图3所示。

图3 不同干燥条件对固定化微生物的影响
通过图3看出:干燥1 h时,氨氮去除率为68%,此时固定化微生物小球体强度较差,曝气2h后小球发生粘连现象;随着干燥时间的增加,载体对氨氮的去除率先缓慢降低,直至干燥时间达到3.5h时,氨氮去除率降至58%,在此条件下,小球曝气3个月也未发生粘连和破损现象;当干燥时间达到5h以上时,微生物活性受到较大程度的影响,氨氮去除率迅速降至39%以下。
2.6 固定化微生物相对活性的评估
实验将固定化前后的微生物进行比较,考察两者在12 h停留时间内对氨氮废水的处理过程,如图4所示。

图4 固定化前后微生物废水处理效果的比较
通过图4可以看出:活性污泥对氨氮废水的处理效果要好于固定化微生物。这是因为:在固定化载体的制备过程中微生物难免会有损伤,同时包埋载体也会影响到氧气的传质,限制微生物对氧气的利用。由图4计算可得:8 h停留时间内活性污泥的氨氧化速率为31.2 mg/(L·h),固定化微生物的氨氧化速率为24.3 mg/(L·h),固定化微生物相对活性为77.7%。
3 结论
(1)通过正交试验发现,固定化微生物处理效果的影响因素主次关系为:包菌量>PVA浓度>SA浓度>硫酸铝浓度。
(2)实验确定改良型聚乙烯醇铝盐法固定化微生物方法为:在5.5%PVA、0.45%SA的包埋剂中,以40 g/100 mL包埋剂的包菌量加入离心污泥并搅匀后,将其滴加到饱和硼酸与0.6%的硫酸铝固定液中,在4℃环境中交联固定24 h并洗净,最后将其放入30℃鼓风干燥箱中干燥3.5 h。
(3)聚乙烯醇铝盐干燥法固定化微生物技术采用了低浓度包埋剂,可提高载体传质性能及处理效率,最终固定化微生物的氨氧化速率为24.3 mg/(L·h),固定化微生物相对活性达到77.7%。
[1]高廷耀,顾国维,周琪.水污染控制工程下册(第3版)[M].北京:高等教育出版社,2007:147-165.
[2]沈耀良,王宝贞.废水生物处理新技术[M].北京:中国环境科学出版社,1999:193-226.
[3]赵昕,汪严明,叶正芳,等.固定化曝气生物滤池处理采油废水[J].环境科学,2006,27(6):1155-1161.
[4]曹国民,张彤,龚剑丽,等.固定化细胞单级生物脱氮研究[J].中国环境科学,2000 ,20(3):237-240.
[5]包木太,田艳敏,陈庆国.海藻酸钠包埋固定化微生物处理含油废水研究[J].环境科学与技术,2012,35(2):167-172.
[6]李艳红,李英利,解庆林,等.固定化混合菌处理高盐含油废水[J].环境工程,2012,30(1):18-21.
[7]李尧,张振家,方海军.包埋固定化微生物工艺技术处理高氨氮化工废水[J].净水技术,2012,31(3):32-35.
[8]Idris A,Misrana N,Hassana N,et al.Modified PVA-alginate encapsulated photocatalystferrophoto gels for Cr(VI)reduction[J].Journal of HazardousMaterials,2012,227-228(30):309-316.
[9]Takei T,Ikeda K,Ijima K,et al.Fabrication of poly(vinyl alcohol)hydrogel beads crosslinked using sodiumsulfate for microorganism immobilization[J].Process Biochemistry,2011,46:566-571.
[10]Magrí A,Vanotti M B,Szögi A A.Anammox sludge immobilized in polyvinyl alcohol(PVA)cryogel carriers[J].Bioresource Technology,2012,114:231-240.
[11]王建龙.生物固定化技术与水污染控制[M].北京:科学出版社,2002:1-11.
[12]叶建锋.废水生物脱氮处理新技术[M].北京:化学工业出版社,2006:186-204.
[13]聂春芬,王应军,马星宇,等.固定化活性污泥实现短程硝化反硝化处理畜禽废水[J].环境工程学报,2013(05):1807-1812.
[14]李尧.包埋固定化微生物技术在工业废水高效硝化处理中的应用研究[D].上海:上海交通大学,2012.
[15]董亚梅.聚氨酯包埋硝化菌颗粒的制备及其应用研究[D].上海:上海交通大学,2012.
[16]王兴南.固定化微生物处理高氨氮废水的研究[D].兰州:兰州交通大学,2013.
[17]岳艳利.大孔聚氨酯载体固定化微生物及其污水处理研究[D].兰州:兰州大学,2013.
[18]赵雪莲,刘金泉,李宗慧,等.固定化硝化菌包埋载体去除氨氮的效果研究[J].工业水处理,2012(S1):53-55.
[19]国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.

