基于支持向量机的遗忘型轻度认知障碍个体识别研究
张忠敏,崔再续,郭艳芹,李坤成,贾建平,韩 璎
0 引 言
阿尔茨海默病(Alzheimer's disease,AD)是发生于中、老年人群,以进行性认知功能衰退和精神行为异常为特征的神经系统退行性病变,是痴呆的最常见原因[1]。轻度认知障碍(mild cognitive impairment,MCI)则是一个通过临床、认知筛查以及诊断标准所界定的综合征,且被公认为是老年痴呆早期干预治疗最佳研究群体[2]。目前,MCI分为遗忘型轻度认知障碍(amnestic mild cognitive impairment,aMCI)和非遗忘型轻度认知障碍(non-amnestic mild cognitive impairment,naMCI)[3]。研究表明,aMCI患者与AD患者有着非常相似的病理学改变,每年有10%~15%的aMCI发展为AD,远远大于 naMCI[4]。
对于aMCI的影像学研究,过去常局限于组群间水平的研究,并不能用于个体识别与诊断。近年来多元模式分析(multivariate pattern analysis,MVPA)方法的出现被认为是可以对多种神经精神疾病进行自动化诊断的很有前途的工具[5]。此外,比起传统的单变量的分析方法,MVPA方法可以更好地捕捉大脑轻微空间模式上的差异[6]。支持向量机(support vector machine,SVM)是一种最广泛使用的MVPA方法,并已经应用在多种神经精神疾病的判别分析研究中[7-8]。SVM模式识别算法在处理小样本学习问题、高维度数据问题上具有独特的优越性[9]。本研究首先使用统计参数图(statistical parametric mapping,SPM8)软件的VBM8工具包为每个受试者计算灰质体积图谱,然后采用SVM分类器对aMCI和正常对照进行MVPA研究,旨在构建分类准确率高的分类器,实现对aMCI患者和正常对照的高精度区分,从而为aMCI患者的早期干预提供可能。
1 资料与方法
1.1 研究对象 搜集北京首都医科大学宣武医院记忆门诊2009年9月至2014年1月就诊的aMCI患者51例。其中男25例、女26例;年龄49~85岁,平均(67.41±9.80)岁;受教育年限为 0~21年,平均(11.16±4.68)年。aMCI患者入组标准:①主诉记忆力减退并有知情者证实;②有记忆损害的客观证据(记忆测验成绩低于相同年龄和教育程度均值的1.5倍标准差);③一般认知功能正常或接近正常,生活自理能力正常或轻度受损;④临床痴呆评定量表(clinical dementia rating scales,CDR)评分为0.5 分;⑤不符合痴呆诊断标准[精神疾病诊断与统计手册,第4版,修订版(Diagnostic and Statistical Manual of Mental Disorders,4rd edition,revised,DSM-IV)]。排除标准:脑卒中、脑肿瘤、脑炎、癫痫、帕金森病、严重抑郁、精神疾病、甲状腺功能低下等神经系统或其他系统疾病导致的认知功能减退患者[10-11]。
对照组为68例,研究对象来自社区招募与记忆门诊体验正常人群。既往无记忆障碍及其他相关疾病病史。其中男29例、女39例;年龄43~79岁,平均(65.00±7.59)岁;受教育年限为0~22年,平均(9.94±5.01)年。2组受试者均为右利手,2组其性别、年龄、受教育年限匹配良好,差异无统计学意义(P >0.05)。见表1。

表1 aMCI患者和对照组的人口学及行为信息Table 1 Demographics and behavioral profiles of aMCI patients and controls
1.2 影像学数据采集 采用Siemens Trio Tim 3.0T MR成像系统进行图像采集。使用三维磁化准备快速梯度回波成像(magnetization prepared rapid gradient echo imaging,MPRAGE)序列行矢状位连续176层覆盖全脑扫描。扫描参数:重复时间=1900 ms,回波时间 =2.2 ms,翻转角 =9°,层厚 =1 mm,无间隔,视野=256×224 mm2,采集矩阵=256×224。
1.3 数据处理 使用 SPM8(http://www.fil.ion.ucl.ac.uk/spm/)软件的vbm8工具为每个受试者计算灰质体积图谱。具体的有以下步骤:①标准化并且分割T1结构像,得到灰质、白质、脑脊液3部分;②使用DARTEL(Diffeomorphic Anatomical Registrations Through Exponentiated Lie Algebra)[12]将灰质部分配准到标准模板上;③使用仿射变换和非线性变换调制标准化后的灰质部分,得到全脑灰质体积图谱。
1.4 判别分析 本研究中,首先使用特征选择方法去除冗余信息,然后训练SVM分类器,使用留一交叉验证(leave-one-out cross validation,LOOCV)估计分类器的性能,最后识别出最有判别能力的灰质模式。见图1。
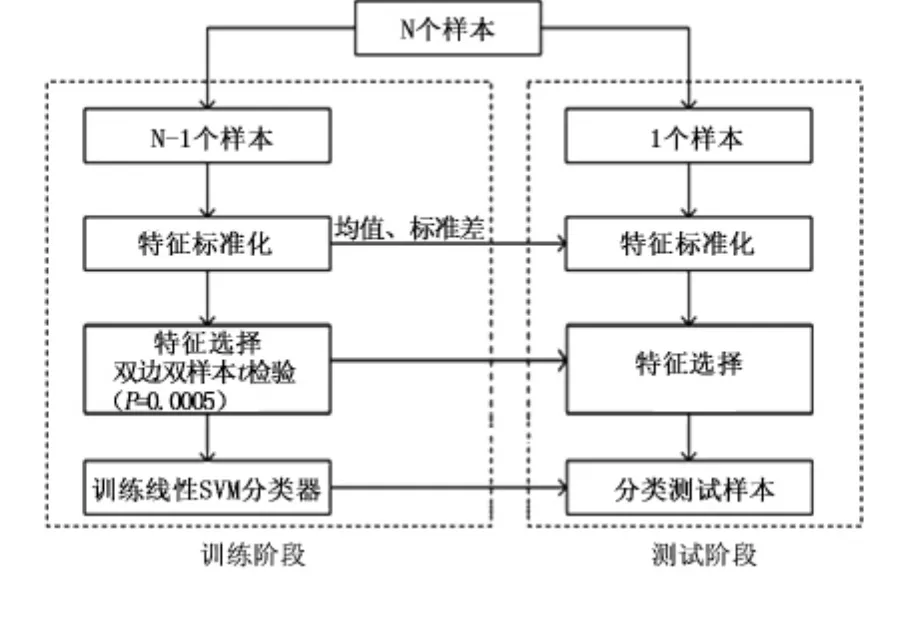
图1 分类流程图Figure 1 A flowchart of the proposed classification framework
1.4.1 特征选择 通过预处理得到了全脑灰质体积图谱。使用全脑的灰质体积图谱作为分类的特征,以每个体素作为一个特征,则每个受试者有396521个特征。特征维度过高,且存在一些冗余对分类无用的信息。有研究表明,去除冗余特征,降低特征维度,不仅可以加速计算,还可以改善分类器的性能[13]。本研究中,使用双样本双边t检验(P=0.000 5,未矫正)进行特征选择[14]。特征选择仅在训练样本上进行,从而可以避免分类器过拟合。见图1。
1.4.2 SVM分类器 本研究使用SVM分类器对aMCI和对照组进行MVPA研究。在使用SVM分类时,每个受试者被看作高维空间中的一个点,图2显示一个二维的情况,红色的点和蓝色的点分别代表2类样本。SVM的目的就是找到一个最优的超平面,将2类样本分开。如果SVM找到的最优超平面能高精度地将2类样本分开,就认为SVM抓住了这2类样本差异的模式。SVM在保证分类器推广能力的同时最小化训练样本上的分类误差,以此可以找到最优的分类超平面。距离分类面最近的样本被称作“支持向量”。研究表明支持向量距离分类面的距离越远,则分类器的推广能力越好[9]。本研究使用线性SVM,优势在于可以避免过拟合,并且特征权重易于解释。线性SVM构造的分类超平面为y=wx+b,它由权重向量w和偏移量b决定。权重向量垂直于分类超平面,它的维度和特征维度一致,每个特征一个权重,权重的绝对值大小可以度量特征对分类的贡献大小[15]。权衡分类器的推广能力和训练样本上分类误差的参数C设为默认值1。本研究使用Matlab版本的LIBSVM工具包进行线性SVM分类[16](http://www.csie.ntu.edu.tw/~cjlin/libsvm/)。
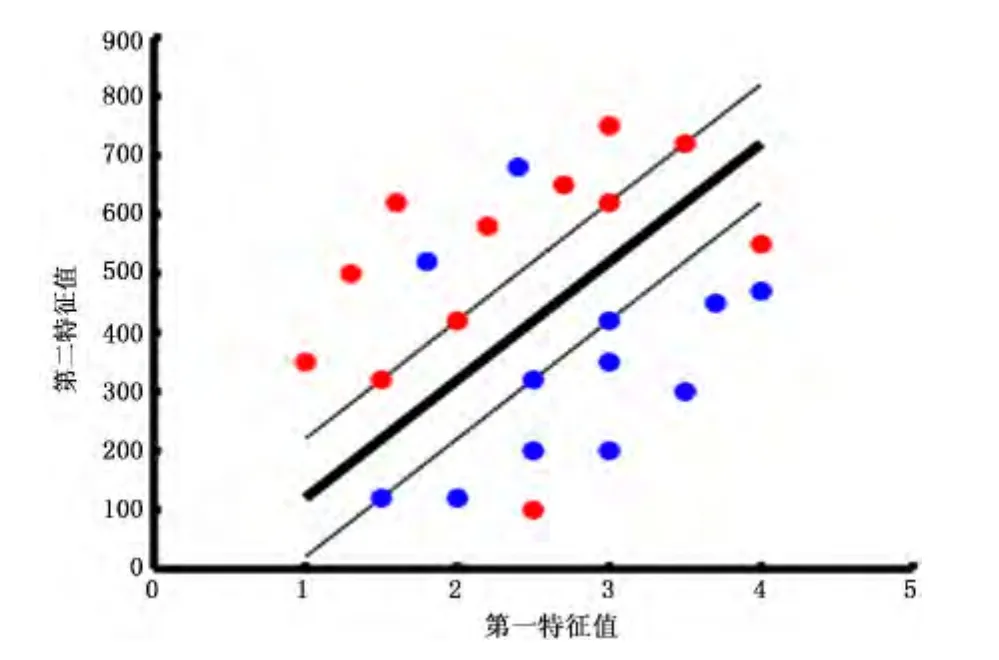
图2 支持向量机分类器的线性SVM示意图Figure 2 Schematic diagram of support vector machines
1.4.3 分类器评价 本研究使用LOOCV估计分类器的性能。在样本量较小的时候,LOOCV可以提供较为准确的分类器推广能力的估计。例如N个受试者中将其中的N-1个受试者用作训练样本,训练SVM分类器,将剩余的一个受试者用作测试样本,测试得到的分类器的预测能力。重复这个过程,直到N个受试者均完成一次样本测试。此法优势在于,样本得到了充分的利用,保证了测试样本没有出现在训练集中。
本研究使用准确率、敏感性,特异性、正预测值和负预测值评价分类器的推广能力。真阳性(TP),真阴性(TN),假阳性(FP),假阴性(FN)分别是所有受试者中正确预测为aMCI的个数、正确预测为对照的个数、错误预测为aMCI的个数和错误预测为对照的个数。
准确率=(TP+TN)/(TP+FN+TN+FP)
敏感性=TP/(TP+FN)
特异性=TN/(TN+FP)
正预测值=TP/(TP+FP)
负预测值=TN/(TN+FN)
此外,本研究还使用ROC曲线评价分类器的性能[17]。通过对分类器算出的决策值(y=wx+b)使用各种阈值区分为2组,遍历所有可能的划分情况,绘制出ROC曲线。每种分组情况对应曲线上的1个点,横轴是该分组下的1-特异性,纵轴是该分组下的敏感性。ROC曲线下的面积(area under an ROC curve,AUC)可以量化评价预测模型的诊断能力。
1.4.4 最有判别能力的灰质模式 在LOOCV的框架下,本研究从N个样本中取出其中N-1个做特征选择并训练分类器,在剩余的1个样本上测试,如此迭代N次,则共做了N次特征选择(双样本t检验,P=0.0005,未校正),每次用其中的N-1个样本。则N次特征选择所用的样本有微小的差异,故N次特征选择保留下的特征不同。以在LOOCV的N次特征选择中均达到0.0005显著的特征视为分类重要。
对于线性SVM,垂直于超平面的权重向量表征了用于构建分类器的特征的重要性。特征权重的绝对值越大,则该特征对分类就越重要,因此在上面得到的对分类重要的特征中去除权重绝对值较小的30%的特征[18]。为去除噪音的影响,本研究设置聚簇大小的阈值是200个体素。
2 结 果
2.1 分类器性能 本研究提出的分类框架对aMCI的预测准确率为83.19%,敏感性为76.47%,特异性为88.24%,正预测值为82.98%,负预测值为83.33%。图3a呈现了所有样本的决策值。在决策值=0的分界面以上的点被分到对照组,以下的点被分到aMCI组。将每个受试者的分数均用作一次阈值,可以绘制出图3b的ROC曲线,AUC为0.8368。
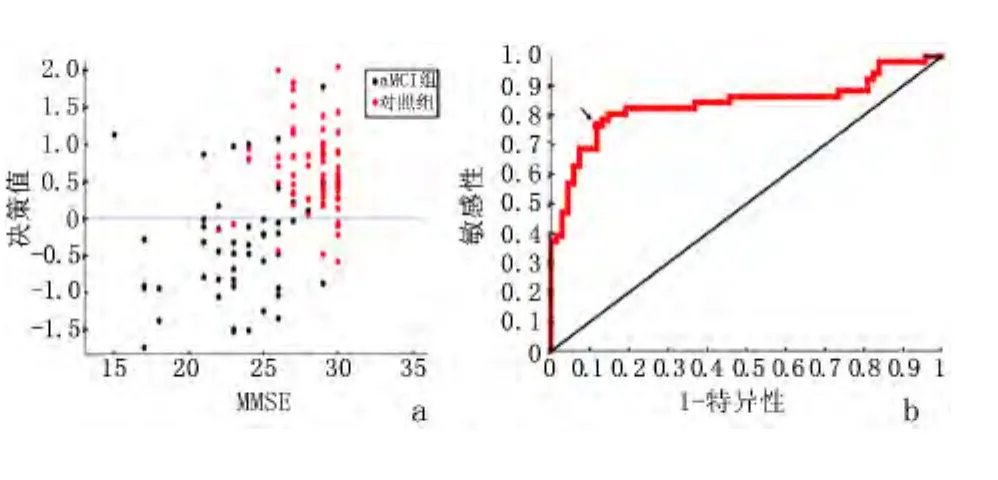
图3 分类器预测能力分析Figure 3 Predictive power of the proposed classifier
2.2 最有判别能力的灰质模式 分类最有判别能力的区域。包括双侧海马旁回、双侧海马、双侧杏仁核、双侧丘脑、右侧扣带回、右侧楔前叶、左侧尾状核、左侧颞上回、左侧颞中回、左侧岛叶以及左侧眶额皮层。见表2、图4。
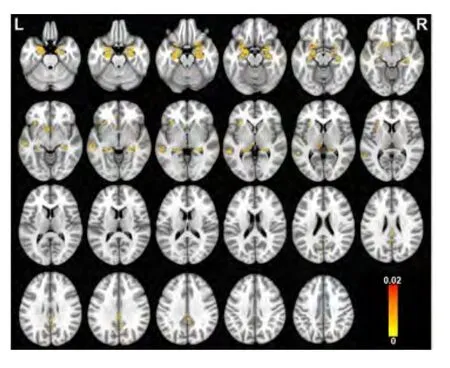
图4 对分类aMCI和对照者最有判别能力区域的磁共振影像Figure 4 The most discriminative regions for classifying aMCI and controls

表2 对分类aMCI和对照者最有判别能力的区域Table 2 The most discriminative regions for classifying aMCI and controls
3 讨 论
目前,aMCI的诊断主要依赖于行为学指标评价,但其存在一定局限性。首先,aMCI的行为表现的评价为半定量,带有一定的主观性;其次,认知储备可能在一定程度上隐藏aMCI的行为症状[19]。因此,客观生物学标记物对aMCI的诊断具有重要意义。本研究表明基于磁共振影像的脑灰质体积有潜力作为aMCI识别的标记物。
针对aMCI的MVPA研究在国际上已有一些工作,并且获得了较高的aMCI预测准确率[20-22]。但是,这些研究的群体主要针对国内aMCI患者的不多。此外,已有的MPVA研究中,aMCI患者的样本量普遍较小。Ortiz等[23]指出构建准确率高的aMCI识别器主要受2个因素的影响:一是特征维度过高,恰当的特征选择方法可以提高预测的准确率;二是用来训练分类器的样本数量较少。本研究样本量较大且从全脑的灰质体积图谱中筛选出组间差异最大的体素,故构建的分类器具有较高的诊断准确性。
本研究使用线性SVM进行aMCI的MVPA分析。与另外一些常用的分类算法相比,在小样本、高维度的情况下,往往可能获得更佳的结果[9]。此外,与非线性SVM相比,线性SVM不易出现过拟合,且特征的权重易于解释。国外也有相关研究报道利用不同方法训练SVM分类器,通过交叉验证法进行评价,其准确率、敏感性、特异性均较高,结果与本研究相似[24-25]。
相关研究报道在aMCI患者和AD患者中大脑海马、海马旁回、扣带回、颞叶、额叶等区域体积均较正常人减少[26-29],虽然以上研究方法均采用基于体素的分析方法,但最终结果与本研究发现的脑区大致相同,且这些脑区与AD患者脑病理改变区域大致相同,故高度提示aMCI是AD的前期。
本研究还发现最有判别能力的区域包括丘脑。丘脑参与认知功能,原因在于丘脑前核与背内侧核的局部解剖区有一个联系杏仁核到额叶皮层区,并通过其他神经核到丘脑的神经环路,这个环路可以调节和影响认知功能[30]。因此,该环路任何部位的损害均可产生认知障碍。丘脑参与AD和aMCI的病理学改变在磁共振成像研究中已经越来越多地被描述,并且其功能障碍可能导致认知能力下降,特别是记忆方面[31]。并有假设丘脑萎缩可能对aMCI转换为AD有预测价值[32]。静息态功能磁共振观察AD和aMCI患者丘脑功能连接特点等研究亦均发现丘脑功能连接模式存在异常,增强的功能连接可能是大脑对降低的功能连接的一种代偿反应,这种变化与认知功能相关[33-35]。
本研究也存有一些不足之处。如仅利用磁共振结构像单一模态来构建分类器,其识别准确率可能比融合多模态磁共振影像数据(如结构磁共振、功能磁共振、弥散磁共振等)的分类器要低[36-38]。因此,下一步的研究工作可以尝试利用多模态神经影像数据来构建分类器,从而改善其辅助诊断的准确性。
[1]韩 璎,王正阁.轻度认知障碍和阿尔茨海默氏病的磁共振成像研究进展[J].医学研究生学报,2011,24(9):975-978.
[2]尹昌浩,郭艳芹,韩 璎.轻度认知障碍的研究进展[J].医学研究生学报,2012,25(9):977-980.
[3]Petersen RC.Mild cognitive impairment as a diagnostic entity[J].Journal of Internal Medicine,2004,256(3):183-194.
[4]Petersen RC,Morris JC.Mild cognitive impairment as a clinical entity and treatment target[J].Arch Neurol,2005,62(7):1160-1163,1167.
[5]Klöppel S,Abdulkadir A,Jack Jr CR,et al.Diagnostic neuroimaging across diseases[J].NeuroImage,2012,61(2):457-463.
[6]Haynes JD,Rees G.Decoding mental states from brain activity in humans[J].Nature Reviews Neuroscience,2006,7(7):523-534.
[7]Li F,Huang X,Tang W,et al.Multivariate pattern analysis of DTI reveals differential white matter in individuals with obsessivecompulsive disorder[J].Human brain mapping,2013,35(6):2643-2651.
[8]Liu F,Wee CY,Chen H,et al.Inter-modality relationship constrained multi-modality multi-task feature selection for Alzheimer's Disease and mild cognitive impairment identification[J].Neuroimage,2014,84:466-475.
[9]Vapnik V.The Nature of statistical learning theory[Z].2000.
[10]Han Y,Wang J,Zhao Z,et al.Frequency-dependent changes in the amplitude of low-frequency fluctuations in amnestic mild cognitive impairment:A resting-state fMRI study[J].NeuroImage,2011,55(1):287-295.
[11]Wang J,Zuo X,Dai Z,et al.Disrupted functional brain connectome in individuals at risk for Alzheimer's disease[J].Biol Psychiatry,2013,73(5):472-481.
[12]Ashburner J.A fast diffeomorphic image registration algorithm[J].Neuroimage,2007,38(1):95-113.
[13]Mwangi B,Tian TS,Soares JC.A review of feature reduction techniques in neuroimaging[J].Neuroinformatics,2014,12(2):229-244.
[14]Dai Z,Yan C,Wang Z,et al.Discriminative analysis of early Alzheimer's disease using multi-modal imaging and multi-level characterization with multi-classifier(M3)[J].Neuroimage,2012,59(3):2187-2195.
[15]Mourão-Miranda J,Bokde AL,Born C,et al.Classifying brain states and determining the discriminating activation patterns:Sup-port Vector Machine on functional MRI data[J].Neuroimage,2005,28(4):980-995.
[16]Chang CC,Lin CJ.LIBSVM:A library for support vector machines[J].ACM Transactions on Intelligent Systems and Technology,2011,2(3,SI):27-55.
[17]Fawcett T.An introduction to ROC analysis[J].Pattern Recognit Lett,2006,27(8):861-874.
[18]Ecker C,Marquand A,Mourão-Miranda J,et al.Describing the brain in autism in five dimensions--magnetic resonance imagingassisted diagnosis of autism spectrum disorder using a multiparameter classification approach[J].J Neurosci,2010,30(32):10612-10623.
[19]Querbes O,Aubry F,Pariente J,et al.Early diagnosis of Alzheimer's disease using cortical thickness:impact of cognitive reserve[J].Brain,2009,132(8):2036-2047.
[20]Desikan RS,Cabral HJ,Hess CP,et al.Automated MRI measures identify individuals with mild cognitive impairment and Alzheimer's disease[J].Brain,2009,132(8):2048-2057.
[21]Wee CY,Yap PT,Li W,et al.Enriched white matter connectivity networks for accurate identification of MCI patients[J].Neuro-Image,2010,54(3):1812-1822.
[22]Wee CY,Yap PT,Shen D.Prediction of Alzheimer's disease and mild cognitive impairment using cortical morphological patterns[J].Human brain mapping,2012,34(12):3411-3425.
[23]Ortiz A,Górriz JM,Ramírez J,et al.LVQ-SVM based CAD tool applied to structural MRI for the diagnosis of the Alzheimer's disease[J].Pattern Recognit Lett,2013,34(14):1725-1733.
[24]Plant C,Teipel SJ,Oswald A,et al.Automated detection of brain atrophy patterns based on MRI for the prediction of Alzheimer's disease[J].Neuroimage,2010,50(1):162-174.
[25]Gerardin E,Chételat G,Chupin M,et al.Multidimensional classification of hippocampal shape features discriminates Alzheimer's disease and mild cognitive impairment from normal aging[J].Neuroimage,2009,47(4):1476-1486.
[26]Risacher SL,Saykin AJ,West JD,et al.Baseline MRI predictors of conversion from MCI to probable AD in the ADNI cohort[J].Curr Alzheimer Res,2009,6(4):347-361.
[27]缪光胜,李亚迪,董海波.遗忘型轻度认知障碍基于体素的形态学MRI研究[J].中国临床医学影像杂志,2011,22(11):800-802.
[28]Han Y,Lui S,Kuang W,et al.Anatomical and functional deficits in patients with amnestic mild cognitive impairment[J].PLoS One,2012,7(2):1-7.
[29]赵志莲,韩 璎,卢 洁,等.遗忘型轻度认知损害的全脑灰质基于体素的MRI形态分析[J].医学影像学杂志,2011,21(4):481-484.
[30]Lopez J,Wolff M,Lecourtier L,et al.The intralaminar thalamic nuclei contribute to remote spatial memory[J].J Neurosci,2009,29(10):3302-3306.
[31]de Oliveira MS,Balthazar M,D'abreu A,et al.Mr imaging texture analysis of the corpus callosum and thalamus in amnestic mild cognitive impairment and mild alzheimer disease[J].AJNR Am J Neuroradiol,2011,32(1):60-66.
[32]Teipel SJ,Born C,Ewers M,et al.Multivariate deformationbased analysis of brain atrophy to predict Alzheimer's disease in mild cognitive impairment[J].Neuroimage,2007,38(1):13-24.
[33]Wang Z,Jia X,Liang P,et al.Changes in thalamus connectivity in mild cognitive impairment:evidence from resting state fMRI[J].Eur J Radiol,2012,81(2):277-285.
[34]张增强,周 波,安宁豫,等.静息态功能磁共振成像观察阿尔茨海默病患者大脑自发活动特点[J].中华神经科杂志,2012,45(5):297-301.
[35]周 波,张增强,安宁豫,等.静息态功能磁共振观察阿尔茨海默病患者丘脑功能连接特点[J].中华神经科杂志,2013,46(1):10-16.
[36]Fan Y,Resnick SM,Wu X,et al.Structural and functional biomarkers of prodromal Alzheimer's disease:a high-dimensional pattern classification study[J].Neuroimage,2008,41(2):277-285.
[37]Zhang D,Wang Y,Zhou L,et al.Multimodal classification of Alzheimer's disease and mild cognitive impairment[J].Neuroimage,2011,55(3):856-867.
[38]Cui Y,Liu B,Luo S,et al.Identification of conversion from mild cognitive impairment to Alzheimer's disease using multivariate predictors[J].PLoS One,2011,6(7):1-10.

