中枢神经大麻素受体分布的细胞类型研究
吴永涛,冷少华,刘宏亮,姚忠祥 (第三军医大学:.西南医院康复科;.基础部生理学教研室,重庆 400038)
大麻素类物质主要有从天然植物中提取的大麻、人工合成的大麻和内源性大麻。目前公认的大麻素受体有CB1、CB2两种,均为G蛋白偶联受体[1]。随着大麻素的作用被逐渐发现和认可,其受体的分布情况也得到更多的研究[2],但其在不同部位阳性细胞的具体类型、数量、及两种受体的共表达情况没有做具体的研究,特别对CB2受体的研究较少。既往研究表明,CB1受体主要分布于神经系统,近期研究发现,CB2受体在神经组织中也有较广泛的分布,大脑、小脑、脑干等多部位均有分布,且多种类型的细胞均表达该两种受体[3],但具体细胞类型研究不够充分。CB2受体在神经组织中的这种表达与前人大量研究的CB1受体有着密切联系,提示CB2受体同样参与神经系统的重要功能[4]。大麻素受体的分布研究主要通过放射自显影、原位杂交、PET[5-6]、免疫组织化学[7]等方法,每一种方法均有其自身的优点和缺陷。本文主要运用荧光双标的方法研究大麻素受体阳性细胞的类型,为解决上述问题提供一定的依据。
1 材料与方法
1.1 动物及标本
成年Spraque-Dawley大鼠(雌雄不限)10只,体质量220~250 g。1%戊巴比妥腹腔注射麻醉,生理盐水灌注15 min后,4%多聚甲醛固定20 min,1 mL/g。低温下取出脑组织,后固定12 h。30%蔗糖溶液脱水过夜。OCT包埋,恒冷冰冻切片机切片(10 μm)。
1.2 抗体及试剂
CB1、CB2抗体(sigma)、少突胶质细胞抗体CC-1、神经元抗体 anti-βⅢ tubulin,GFAP 抗体,荧光二抗:Cy3、FITC,DAPI(sigma),多聚甲醛(重庆化学试剂厂)、甘油(北京红星化工厂)、戊巴比妥钠(上海试剂一厂)。
1.3 免疫荧光组织化学
分别以抗CB1、CB2抗体为一抗,选择特异性的荧光二抗,行免疫荧光化学染色,然后再次选取抗神经元或胶质细胞抗体为一抗,特异性荧光二抗,重复前述步骤,进行免疫荧光双标染色。具体双标情况如下(CB2受体双标组合原理同上)。
1.3.1 实验分组 一抗:抗CB1/CB2抗体,兔来源。二抗:cy3,山羊抗兔,红色荧光。一抗:Anti-βⅢ Tubulin/cc-1/GFAP,小鼠来源。二抗:FITC,兔抗小鼠,绿色荧光。
1.3.2 荧光双标操作 贴片经0.01M PBS漂洗5 min×3次;滴加正常封闭用血清(1%BSA/0.4%TritonX-100)室温下孵育30 min;用滤纸吸去多余血清,滴加一抗,37℃ 2 h,后入4℃冰箱过夜;0.01M PBS漂洗5 min×3次;滴加二抗,37℃孵育2 h;0.01M PBS漂洗5 min×3次;滴加一抗,37℃ 2 h,后入4℃冰箱过夜;0.01M PBS漂洗5 min×3次;滴加二抗,37℃孵育2 h;0.01M PBS漂洗5 min×3次;吸掉多余 PBS液,滴加0.1‰DAPI染核;中性树胶封片;olympus显微镜观察,数码相机照相。
2 结果
大麻素受体在脑组织中分布的神经细胞类型主要有神经元、少突胶质细胞及星型胶质细胞,不同的脑区及细胞类型表达二种受体存在差异。神经元中的表达情况(图1):大麻素CB1、CB2受体在大脑皮层、海马、基底神经节区、嗅球、脑桥的神经细胞以及小脑的浦肯野细胞层均有表达。在大脑皮层,表现为中等量的表达,着色部位多位于核周和胞体,突起上也有着色。在海马,2种大麻素受体都有很强的表达,核周和胞体及突起上可见阳性着色,CA1和CA3表达最强,二者无明显差别。在基底神经节区,二者的表达量及染色部位类似于其在大脑皮层的分布情况,CB2的表达量略高。在嗅球,有较强表达,僧帽细胞层、小球层及嗅球内层白质均可见阳性神经细胞,二者表达量及染色部位差别不明显,多为胞体着色。在脑桥,表达很高,着色部位多位于核周和整个胞体,表达量上二者差别不明显。在小脑浦肯野细胞层,有很高的表达,表达量无明显差异,阳性部位多位于核周和突起上,少数细胞整个胞体着色。在胼胝体区也有二者的表达,特别是CB2受体的表达较明显,多位于核周和突起上。
少突胶质及星型胶质细胞的表达情况(图2):脑白质区是胶质细胞分布最集中的区域,同时也是我们研究胶质细胞分布的重点区域,根据免疫荧光染色结果,发现少突胶质细胞与星型胶质细胞中明确存在该2种受体的表达。比较2种胶质细胞,少突胶质细胞中阳性细胞比例明显高于星型胶质细胞,且阳性染色部位存在较大差异。

图1 免疫荧光双标法检测2种大麻素受体CB1、CB2的分布
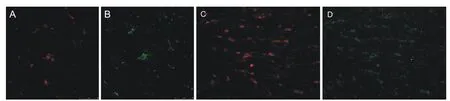
图2 免疫荧光双标法检测两种大麻素受体CB1、CB2的分布
3 讨论
大麻素受体CB1和CB2在成年大鼠脑组织中的分布很广泛,并且二者的分布有很大的相似性。如大脑皮层、海马、基底神经节区以及小脑等部位共同表达这2种受体。在脑组织中,CB1受体主要分布于神经元来发挥其作用,而CB2受体在体内对神经元的功能研究尚不明确[8]。因此我们通过2种抗体荧光双标法,观察和验证在不同脑区的神经元上的表达情况。我们发现大鼠脑中的多数部位,如嗅脑、大脑、小脑及脑干中均有神经元表达此2种受体,二者在神经元中的分布情况大致相同。已知分布于神经元突触前膜的CB1受体可以调节递质的释放[9],提示CB2受体很有可能也参与了该过程。CB2受体可能同样参与了神经递质的释放及信号传递[10]。同时发现CB2受体在脑桥和延髓的阳性细胞突起上的分布最为明显,表明CB2受体在该区域的递质释放方面也可能发挥重要的作用。这种分布对于神经细胞突起的生长是否密切联系尚待证实。而二者分布上的相似性更进一步说明2种大麻素受体存在相互协同或抑制作用。如小脑的浦肯野细胞及海马的锥体细胞是2种大麻素受体双标比较明显的神经细胞类型,这更有可能提示2种大麻素受体在运动及记忆认知方面共同有着重要的作用[11]。
大麻素受体CB1具有促进少突胶质前体细胞存活及分化的功能,CB2受体可促进神经干细胞的增殖及大麻素受体具有促进神经细胞突起的生长等作用[12]。尤其在少突胶质细胞,大麻素激活其受体不仅能抑制炎症反应从而起到保护作用,同时在促进少突胶质前体细胞存活、增殖甚至分化等方面发挥了很重要的作用[13]。大麻素受体在星形胶质细胞上的表达同样也提示,在炎性脱髓鞘性疾病中,大麻素激活其受体作用于星形胶质细胞,起到抗炎和神经保护的作用。
2种大麻素受体在成年大鼠脑内有广泛的表达,在不同脑区的神经细胞均有表达,且表达于多种神经胶质细胞中,说明二者存在于神经系统的多种类型的细胞中,提示位于细胞不同位置的大麻素受体发挥的作用可能不同。研究它们分布细胞类型上的差别及分布部位上区别,为更好地研究2种大麻素受体在神经细胞及胶质细胞发挥的作用奠定了良好的基础。
[1]Howlett AC,Barth F,Bonner TI,et al.International Union of Pharmacology.XXVII.Classification of cannabinoid receptors[J].Pharmacol Rev,2002,54(2):161 -202.
[2]Mackie K,Stella N.Cannabinoid receptors and endocannabinoids:evidence for new players[J].AAPS J,2006,8(2):298 - 306.
[3]Stella N.Cannabinoid and cannabinoid-like receptors in microglia,astrocytes,and astrocytomas[J].Glia,2010,58(9):1017 -1030.
[4]Palazuelos J,Ortega Z,Diaz-Alonso J,et al.CB2 cannabinoid receptors promote neural progenitor cell proliferation via mTORC1 signaling[J].J Biol Chem,2012,287(2):1198 -1209.
[5]Vandeputte C,Casteels C,Struys T,et al.Small-animal PET imaging of the type 1 and type 2 cannabinoid receptors in a photothrombotic stroke model[J].Eur J Nucl Med Mol Imaging,2012,39(11):1796 -1806.
[6]Casteels C,Koole M,Celen S,et al.Preclinical evaluation and quantification of[18F]MK-9470 as a radioligand for PET imaging of the type 1 cannabinoid receptor in rat brain[J].Eur J Nucl Med Mol Imaging,2012,39(9):1467 -1477.
[7]Mackie K.Cannabinoid receptors:where they are and what they do[J].J Neuroendocrinol,2008,20(1):10 -14.
[8]Katona I,Freund TF.Multiple functions of endocannabinoid signaling in the brain[J].Annu Rev Neurosci,2012,35(1):529 -558.
[9]Howlett AC.Efficacy in CB1 receptor-mediated signal transduction[J].Br J Pharmacol,2004,142(8):1209 -1218.
[10]Zalesky A,Solowij N,Yücel M,et al.Effect of long-term cannabis use on axonal fibre connectivity[J],Brain,2012,135(7):2245 -2255.
[11]Jhaveri MD,Elmes SJ,Richardson D,et al.Evidence for a novel functional role of cannabinoid CB(2)receptors in the thalamus of neuropathic rats[J].Eur J Neurosci,2008,27(7):1722 -1730.
[12]Moldrich G,Wenger T.Localization of the CB1 cannabinoid receptor in the rat brain.An immunohistochemical study[J].Peptides,2000,21(11):1735-1742.
[13]Lou ZY,Zhao CB,Xiao BG.Immunoregulation of experimental autoimmune encephalomyelitis by the selective CB1 receptor antagonist[J].J Neurosci Res,2012,90(1):84 -95.

