20株鲍曼不动杆菌碳青霉烯酶耐药基因分析及同源性研究
杨银忠,赵 鹃,丁少川,程文霞,孙熙奉
(1.四川省人民医院城东病区检验科,成都610101;2.成都中医药大学医疗技术学院,成都610075)
鲍曼不动杆菌(acinetobacter baumanmii,AB)广泛存在健康人体的皮肤、口腔、呼吸道、胃肠道和泌尿道,也广泛分布在自然界和医院环境,该菌毒力低,为条件致病菌。但近年来,随着抗菌药物的广泛使用,多重耐药(multidrug-resistant,MDR)AB的出现,特别是AB的碳青霉烯酶出现,使得预防和临床治疗带来极大挑战,检测其耐药基因型别及同源性显得尤其重要。本文分析了四川省人民医院临床分离的耐碳青霉烯类抗菌药物AB的分子耐药机制,及来自ICU的AB菌株的同源性情况,现报道如下。
1 材料与方法
1.1 材料 收集四川省人民医院2011年2~6月从患者呼吸道分离的AB 20株,其中9株来自呼吸科、血液科、心内科、神内科及消化科,4株来自肝胆外科、创伤外科及普外科,7株来自ICU。标本类型包括痰液及咽拭子等;培养及分离严格按《全国临床检验操作规程》(第3版)进行。
1.2 仪器与试剂 API及配套试剂、ATB药敏试剂、REPPCR DNA指纹图谱试剂、PCR指纹试剂(DiversiLab不动杆菌试剂盒)及 Microfluidics芯片和反应试剂均购自法国Biomerieux公司;PTC-200PCR扩增仪、Gel Doc XR+凝胶成像分析系统购自美国Bio-Rad公司;Agilent2100分析仪购自美国Agilent Technologies公司;PCR反应体系和DNA marker DM2000(北京康为试剂生物科技公司)。
1.3 AB鉴定及药物敏感实验
1.3.1 AB生物学鉴定 用API20E和API20NE两种试剂严格按照试剂说明书操作,以及补充试验42℃生长试验进行细菌鉴定,质控菌株为大肠埃希菌ATCC(25922)和铜绿假单胞菌 ATCC(27853)。
1.3.2 AB基因学鉴定 由于OXA-51天然存在于AB中,利用OXA-51成功鉴定出AB,并指出这是鉴定AB最简单、可靠的方法[1];设计 OXA-51基因引物,上游 5′-TAA TGC TTT GAT CGG CCT TG-3′,下游:5′-TGG ATT GCA CTT CAT CTT GG-3′,经过提取、扩增、变性、退火及延伸后,将扩增产物进行琼脂糖凝胶电泳,并由凝胶成像分析系统进行成像。
1.3.3 AB药物敏感实验 采用MIC法,严格按照试剂盒说明书进行操作,药敏结果判断和解释参照美国临床实验室标准化协会(CLSI)2009年抗菌药物敏感试验标准执行,质控菌株同生物学鉴定,最后用WHONET5.6软件进行数据分析。
1.4 PCR检测碳青霉烯酶耐药基因 碳青霉烯酶耐药基因引物序列设计参照文献[1]。用煮沸法提取模板DNA;靶基因PCR扩增体通过提取、扩增、变性、退火及延伸等共30个循环,再将扩增产物进行10g/L琼脂糖凝胶电泳,最后凝胶成像分析系统成像;选取阳性基因扩增产物纯化并测序(由Invitrogen公司完成)。
1.5 同源性分析
1.5.1 REP-PCR技术 采用DNA芯片加入配制的凝胶混合物和重复序列聚合酶链反应(REP-PCR)产物后,加载于Agilent2100生物分析仪上进行自动化的凝胶分析和数据处理分析。
1.5.2 Agilent2100的DiversiLab分析 具体操作参见“Agilent DNA Guide”;最后Agilent 2100生物分析仪自带软件可自动生成树状图和虚拟凝胶图等。
1.5.3 检测原理 REP-PCR引物与许多分布在整个基因组上的、特异性的重复序列配对,从而产生各种片段大小的扩增产物,扩增片段通过微流芯片试剂盒对片断进行电泳分离及检测,DiversiLab系统收集并分析数据,同时产生相应的峰值图,不同峰值代表不同大小DNA片段,从而对细菌的DNA进行同源性分析。
1.5.4 结果分析 应根据细菌DNA指纹图谱条带、峰的位置、数目和丰度等因素判断菌株的同源性;菌株间的相似性大于95%,划分为同一克隆组;菌株间的相似性大于97%,划分为同一亚克隆组;菌株间的相似性小于95%,则划分为不同克隆。
2 结 果
2.1 AB鉴定结果
2.1.1 AB生物学鉴定 采用API20E及20NE两种不同的试剂条进行鉴定,其鉴定代码分别为020404203和0041073,42℃生长试验:生长,结果为:鲍曼不动杆菌。
2.1.2 AB基因学鉴定 20株AB均检出携带OXA-51基因(图1),其产物长度约为353bp;经PCR产物测序比对分析显示与目标基因AB(HQ222987.1)完全相符,其结果为:鲍曼不动杆菌。

图1 OXA-51耐药基因PCR电泳图
2.2 AB药物敏感实验结果 20株AB均表现为对亚胺培南及美洛培南耐药且为MDR;其中对阿米卡星、奈替米星、妥布霉素、复方新诺明耐药率为88.9%~94.4%,其余耐药率为100.0%,用WHONET5.6软件进行数据分析,见表1。
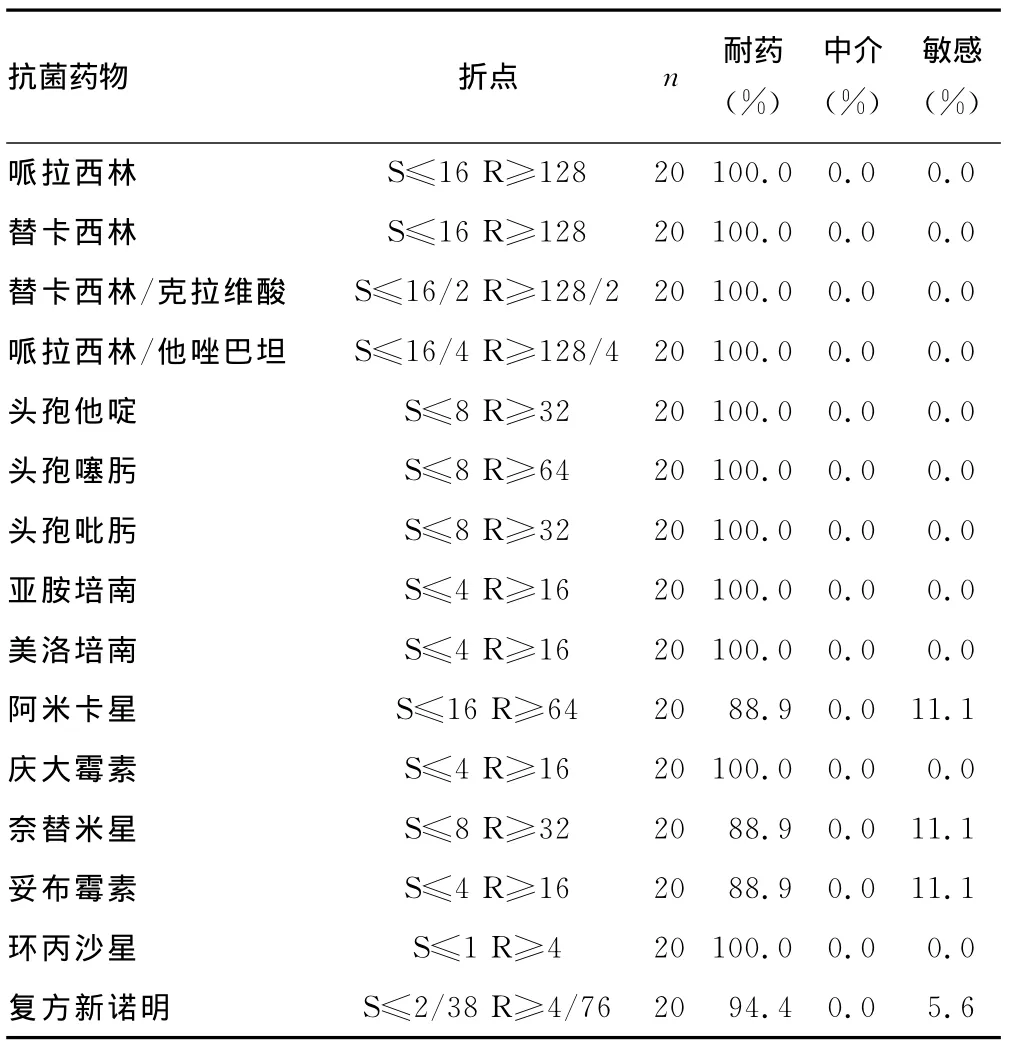
表1 AB药物敏感实验统计结果
2.3 PCR检测结果
2.3.1 PCR检测碳青霉烯酶耐药基因结果 见表2。

表2 菌株耐药基因检测结果

续表2 菌株耐药基因检测结果
2.3.2 20株AB的OXA-23耐药基因PCR电泳图 见图2。

图2 OXA-23耐药基因PCR电泳图
2.4 同源性分析 采用DiversiLab系统将7株AB分为2个亲缘性不同的克隆组:克隆组1包括6株AB,同时分为亲缘性相近的2个亚克隆组,每个亚克隆组内菌株为同源株;克隆组2有1株AB;不同克隆组的AB耐药表型不同,同一克隆组的不同亚克隆AB其耐药性也存在差异,见图3~5。

图3 菌株REP-PCR电泳检测结果

图4 菌株克隆组及亚克隆组结果

图5 菌株DiversiLab同源性分析结果
3 讨 论
碳青霉烯类抗菌药物对AB有较好的抗菌活性,是治疗MDR AB感染的重要抗菌药物之一,因为在所有β-内酰胺类药物中,碳青霉烯类药物抗菌谱最广,抗菌活性最强,其对革兰阴性菌产生的超广谱β-内酰胺酶、AmpC酶具有较高稳定性。但近年来,然而随着碳青霉烯类药物的广泛使用,AB对碳青霉烯类的敏感性也在逐年下降,其耐药菌引起的医院感染暴发流行已成为日益严重的医疗事件和公共卫生问题。本研究表明,20株AB均耐碳青霉烯类抗菌药物且均为多重耐药株,表明该地区多重耐药现象严重,与国内文献报道基本一致[1-3]。因此,应首先加强抗菌药物的管理及使用,其次要做好耐药菌的主动筛查以及定值、感染患者的及时隔离,以防止医院感染的发生。
AB对碳青霉烯类抗菌药物耐药机制非常复杂,可能与外膜孔蛋白的丢失,外排泵的激活,青霉素结合蛋白的改变等有关,而最重要的是碳青霉烯酶的产生[4-7]。该酶是指能水解碳青霉烯类抗菌药物的β-内酰胺酶,依据Ambler分子可将其分为3类:A、B、D类酶,在多重耐药的AB中主要发现的是B、D类酶。B类是金属酶,包括IMP、VIM和SIM等,水解底物范围广,包括除氨曲南以外的所有β-内酰胺类抗菌药物,但本研究未检测到该酶。D类酶是苯唑西林酶,对碳青霉烯类抗菌药物的水解活性较低,对其耐药性的介导常合并外膜通透性的降低和(或)外排泵的过度表达,但最近发现OXA-23基因上游存在ISAbal,由于插入序列ISAbal与OXA类碳青霉烯酶编码基因的同源重组以及表达调控有关,ISAbal可以明显增强OXA-23的表达,从而导致对碳青霉烯类抗菌药物高度耐药[5-12]。D类酶又可分4组,第1组即 OXA-23类,包括 OXA-23、27、49,同源性为99%;第2组为 OXA-24,包括 OXA-25、26、40,同源性为98%;第3组为 OXA-51类,包括 OXA-51、66、69是天然产生的,第4组为OXA-58,与其他3组的同源性为50%;OXA-51型碳青霉烯酶于2004年Brown等[13]首次在AB中发现,随后研究表明blaOXA-51-likee基因为AB固有的基因型,在敏感与耐药株中均存在。最早报道OXA-23基因的是ARI-1,1985年在英国发现,后来在其他国家均有报道[13],其PI 6.7由质粒介导,1999年经测序后命名为OXA-23。本研究显示,20株检均测到OXA-51碳青霉烯酶基因,16株检测到OXA-23碳青霉烯酶基因,表明OXA-23基因是本院AB的主要耐药基因。
国内外报道了产OXA-23型碳青霉烯酶AB导致院内感染暴发的事件[8-11,14],说明目前世界上的 AB引起的医院感染均以OXA-23型碳青霉烯酶为主,与本院的研究结果一致。
ICU是AB分离率最高的科室之一,一是由于激素、免疫抑制剂以及预防性大量抗菌药物使用;二是各种侵袭性操作,在一定程度上造成了AB定植、扩散,也诱导了耐药菌的产生,给临床的治疗带来了困难[15]。目前临床缺乏有效治疗AB的药物,医务工作者及感控人员应采取积极有效措施,预防和控制AB感染。
[1]钟敏,黄文芳,刘华,等.多重耐药鲍曼不动杆菌碳青霉烯酶耐药基因和同源性分析[J].临床检验杂志,2012,5(5):367-370.
[2]王凌伟,吴伟元,陈升汶.耐碳青烯类鲍曼不动杆菌同源性研究[J].遵义医学院学报,2004,4(2):125-127.
[3]刘丁,陈伟,陈伟,等.鲍曼不动杆菌医院感染的危险因素及基因分型研究[J].中华流行病学杂志,2003,2:140-142.
[4]熊樱,苏小燕,李小凤,等.耐亚胺培南鲍曼不动杆菌同源性及耐药机制研究[J].临床检验杂志,2012,30(6):463-465.
[5]金红,曹银光,金苑,等.鲍曼不动杆菌耐药性及β-内酰胺酶基因型动态变化研究[J].国际检验医学杂志,2011,32(9):1016-1018.
[6]裘莉佩,潘登,徐炜烽.鲍曼不动杆菌碳青霉烯酶基因型及分子流行病学研究[J].中华流行病学杂志,2007,48(4):381.
[7]Zhou H,Yang Q,Yu YS,et al.Clonal spread of imipenem-resistant Acinetobacter baumannii among different cities of China[J].J Clin Mierobiol,2007,45(12):4054.
[8]杜蓉,冯萍,陈慧莉,等.鲍曼不动杆菌临床分离株耐药性与OXA-碳青霉烯酶基因研究[J].四川大学学报:医学版,2009,40(2):272.
[9]谭湘淑,刘原,韩新鹏,等.西安地区鲍曼不动杆菌耐亚胺培南的机制研究[J].南方医科大学学报,2009,29(7):1391.
[10]秦洁,宋艳荣,王玉平,等.鲍曼不动杆菌30株基因同源性分析[J].河北医药,2010,32(13):1803.
[11]王辉,孙宏莉,廖康,等.北京和广州地区四家医院不动杆菌碳青霉烯酶基因型研究[J].中华检验医学杂志,2005,28(6):636-641.
[12]王政,刘丁,陈萍,等.重症监护室产OXA-23碳青霉烯类酶的鲍曼不动杆菌的分子流行病学研究[J].南京医科大学学报:自然科学版,2011,31(9):1316-1324.
[13]Brown S,Amyes SG.The sequences of seven class D beta-lactamases isolated from carbapenem-resistant acinetobacter baumannii from four continents[J].Clin Microbiol Infect,2005,11(4):326-329.
[14]Merkier AK,Centron D.bla(OXA-51)-type beta-lactamase genes are ubiquitous and vary within a strain in Acinetobacter baumannii[J].Int J Antimicrob Agents,2006,28(2):110-113.
[15]宋晓萍,王静静,孙滨,等.亚胺培南耐药鲍曼不动杆菌碳青霉烯酶基因型研究[J].国际检验医学杂志,2012,33(10):1191-1192.

