栽培艾纳香单株左旋龙脑和总黄酮含量变异分析△
于福来,黄梅,庞玉新*,王丹,谢小丽,陈振夏
(1.中国热带农业科学院 热带作物品种资源研究所/农业部华南作物基因资源与 种质创制重点开放实验室,海南 儋州 571737; 2.海南省艾纳香工程技术研究中心 海南 儋州 571737)
栽培艾纳香单株左旋龙脑和总黄酮含量变异分析△
于福来1,2,黄梅1,2,庞玉新1,2*,王丹1,2,谢小丽1,2,陈振夏1,2
(1.中国热带农业科学院 热带作物品种资源研究所/农业部华南作物基因资源与 种质创制重点开放实验室,海南 儋州 571737; 2.海南省艾纳香工程技术研究中心 海南 儋州 571737)
目的:探讨艾纳香栽培群体内主要化学成分个体变异规律,为艾纳香优良品种的定向选育奠定基础。方法:选取同一栽培环境下相同株龄100个艾纳香单株,采用GC测定左旋龙脑含量,紫外可见分光光度法测定总黄酮含量。通过相关分析、标准差法分组比较等方法分析化学成分单株变异规律。结果:100个单株艾纳香左旋龙脑变异系数为37.39%,总黄酮变异系数为20.13%;分组后左旋龙脑和总黄酮含量分别在3个组别间差异达到极显著(P<0.001)水平;相关分析表明,两类成分间存在正相关关系(r=0.084,n=100),但不具有统计学意义(P>0.05)。结论:艾纳香栽培群体内单株化学成分含量变异较大,可为高含量育种提供材料。此外,艾纳香叶片中左旋龙脑和总黄酮积累不具有协同性,应分别对其进行选择。
艾纳香;左旋龙脑;总黄酮;单株变异;定向选育
艾纳香Blumeabalsamifera(L.)DC.为菊科多年生草本植物,在我国广泛分布于海南、贵州、广西、云南等省区[1]。艾纳香新鲜叶片经水蒸气蒸馏、升华等一系列处理可制得中药艾片(主要为左旋龙脑),具开窍醒神,清热止痛之功效[2]。此外,艾纳香中还含有黄酮等多种活性成分[3-4]。
艾纳香人工种植历史已有近百年,但长期以来,艾纳香药材以野生为主,优良品种缺乏的现状仍未改变,规范化生产技术研究与推广工作仍未落实到位,这直接导致艾纳香药材质量不稳定,难于有效控制。而通过人工定向选育良种是提高和稳定艾纳香药材质量的根本途径。艾纳香具有无性克隆繁殖特性[5],通过系统选育优良单株,建立优良材料无性系是实现艾纳香品种选育的重要途径。植物化学成分为数量性状,其合成积累受基因型和环境双重因素影响。以往研究对不同产地、不同季节以及不同部位艾纳香在挥发性成分和黄酮类成分含量比较方面报道较多[6-8],然而同一生长环境不同单株间化学成分含量变异的研究未见报道。
基于此,本研究从艾纳香化学成分定向选择角度出发,通过测定同一栽培环境下相同株龄100株艾纳香单株的左旋龙脑和总黄酮含量,进而阐释艾纳香栽培群体内化学成分在个体间变异规律,以期为高含量材料的选择提供依据,为优良艾纳香品种的定向选育奠定基础。
1 材料与仪器
1.1 试验材料
2013年12月于海南儋州艾纳香栽培基地随机标记100个同一年生单株(实生苗),每株选取功能叶片20片,阴干后粉碎作为测试样品。以上材料经中国热带农业科学院热带作物品种资源研究所庞玉新副研究员鉴定为艾纳香Blumeabalsamifera(L.)DC.。
1.2 试验仪器
安捷伦7890A气相色谱仪,氢火焰离子化检测器(FID),安捷伦G4513A 16位自动进样器,Sartarius CPA225D电子分析天平,KQ-500DB型超声仪,UNICO2012-PCS紫外分光光度计,左旋龙脑对照品(阿法埃莎化学有限公司,纯度>98%),芦丁标准品(中国食品药品检定研究院,批号为100080-200707,纯度为92.5%),水杨酸甲酯(天津光复精细化工研究所,纯度>99.5%),乙酸乙酯,亚硝酸钠NaNO2、硝酸铝Al(NO3)3·9H2O、氢氧化钠、乙醇等试剂均为国产分析纯。
2 方法
2.1 左旋龙脑含量测定
2.1.1 色谱条件 HP-5石英毛细管色谱柱(0.32 mm×30 m,0.25 μm);以80 ℃为起始温度,保持2 min,然后以5 ℃/min升温至100 ℃,再以20 ℃/min升温至200 ℃;进样口温度为220 ℃;FID检测器温度为240 ℃;进样量0.6 μL,分流比为9∶1。左旋龙脑对照品和艾纳香供试品色谱图见图1。
2.1.2 供试品的制备 精密称定艾纳香叶片粉末(过20目筛)约2 g,置于50 mL具塞三角瓶中,加入乙酸乙酯25 mL,称定重量,在40 kHz的超声条件下提取30 min,放冷,用乙酸乙酯补足减失的重量,摇匀,滤过,取1 mL续滤液至10 mL容量瓶中,加入1 mL内标液(见2.1.3项下),用乙酸乙酯定容,摇匀,经0.22 μm微孔滤膜过滤,取续滤液即得。
2.1.3 线性关系的考察 精密称定左旋龙脑对照品约100 mg,加乙酸乙酯定容至100 mL作为对照液。精密称定水杨酸甲酯约250 mg,加乙酸乙酯定容至250 mL作为内标液。量取对照液0.1、0.2、0.5、1.0、2.0 mL置于10 mL容量瓶中,同时加入内标溶液1.0 mL,以乙酸乙酯定容至刻度,即得混合对照品溶液。按照2.1.1项下的色谱条件测定。以对照品中左旋龙脑质量浓度(mg·mL-1)为横坐标(X),对照品左旋龙脑与内标物水杨酸甲酯的峰面积比为纵坐标(Y),绘制标准曲线,得到线性回归方程为:Y=14.823X+0.0129,r=0.999 9,结果表明,左旋龙脑在10.371~207.428 μg·mL-1与峰面积呈良好线性关系。

1.左旋龙脑 2.水杨酸甲酯图1 左旋龙脑对照品(A)和供试品(B)色谱图
2.1.4 精密度试验 取某一艾纳香药材,按2.1.2项下操作制备供试品溶液,在上述色谱条件下连续重复进样6次,记录色谱图。结果左旋龙脑与水杨酸甲酯的相对峰面积的RSD值为2.1%,表明精密度良好。
2.1.5 重复性试验 取同一艾纳香药材5份,按2.1.2项下操作制备供试品溶液,在上述色谱条件下进样分析,结果测得左旋龙脑含量的RSD为3%,表明重复性良好。
2.1.6 稳定性试验 取艾纳香药材1份,按2.1.2项下操作制备供试品溶液,于室温下放置,分别在0、2、4、8、12、24 h各进样一次,左旋龙脑与内标物的相对峰面积的RSD为0.49%,表明样品在24小时内稳定性良好。
2.1.7加样回收率试验 精密称定6份已知含量的艾纳香叶片粉末约1 g,每份样品精密加入左旋龙脑标准品约5 mg,按2.1.2项下方法制备,在上述色谱条件下进行分析,结果得回收率在80%~120%之间,RSD为2.44%,表明回收率较高。
2.1.8 样品含量测定 按照2.1.2项下操作制备样品溶液,在上述色谱条件下进样分析,根据线性方程计算不同单株艾纳香中左旋龙脑的含量。
2.2 总黄酮含量测定
2.2.1 显色剂的配制 称取25 g NaNO2,用蒸馏水定容至500 mL,配成5%的NaNO2溶液,备用;称取88 g Al(NO3)3·9H2O,用蒸馏水定容至500 mL,配成10%的Al(NO3)3溶液,备用;称取20 g的NaOH,用蒸馏水定容至500 mL,配成4%的NaOH溶液,备用。
2.2.2 对照品溶液的制备 精密称定于105 ℃干燥至恒重的芦丁对照品约12 mg,置于50 mL容量瓶中,加75%乙醇溶液,置水浴锅上微热溶解,放冷,加75%乙醇至刻度,摇匀,即得对照品溶液。
2.2.3 供试品溶液的制备 精密称定艾纳香药材粉末(过20目)约0.5 g,至具塞锥形瓶中,加75%乙醇溶液25 mL,称定重量,在40 kHz下超声提取40 min,放冷,称量,用75%的乙醇补足减失的重量,摇匀,过滤,即得供试品。
2.2.4 测定波长的选择 分别精密量取对照品溶液2.0 mL、供试品0.5 mL,将其分别置于25 mL容量瓶中,各加75%乙醇至10 mL,加5% NaNO2溶液1 mL,摇匀,放置5 min,加10% Al(NO3)3溶液1 mL,摇匀,放置5 min,加4% NaOH溶液10 mL,最后以75%乙醇定容至刻度,摇匀,放置15 min,以相应的试剂溶液为空白,在300~999 nm波长间进行全波长扫描,综合分析选择适宜测定波长为509 nm。吸收曲线如图2所示。

图2 全波长扫描图
2.2.5 线性关系的考察 精密量取对照品溶液1.00、2.00、4.00、6.00、8.00 mL分别置于25 mL容量瓶中,按2.2.4项下方法进行显色反应,以相应的试剂溶液为空白对照,在509 nm处测定吸光度A。以对照品浓度C为横坐标(X),吸光度A为纵坐标(Y),绘制标准曲线,得到线性回归方程为Y=12.847X+0.009 3,r=1.000,结果表明,总黄酮在9.176~73.408 μg·mL-1与吸光度呈良好线性关系。
2.2.6 精密度试验 取某一浓度的对照品溶液2 mL,置于25 mL的容量瓶中,按标准曲线绘制项下操作,测定吸收值,连续6次,RSD值为1.05%,表明精密度良好。
2.2.7 稳定性实验 取某一浓度供试液,置于25 mL容量瓶中,按2.2.5项下操作,每隔10 min测定其吸光度,共计60 min,分析得出溶液在显色后40 min内RSD值为1.89%,表明在40 min内比较稳定。
2.2.8 重复性实验 取同一批样品按2.2.3项下操作平行制备供试品溶液6份,按2.2.5项下操作,测定其吸光度,计算得平均浓度为13.91%,RSD值为3.8%。
2.2.9 加样回收试验 精密称取6份已知浓度的艾纳香药材粉末(过20目筛)50 mg,分别加入相当于供试品溶液总黄酮质量的芦丁对照品约7 mg,按2.2.3项下制备供试液,按2.2.5项下操作测定吸收值,结果得平均回收率为110%,RSD值为2.7%。
2.2.10 样品含量测定 按照2.2.3项下方法进行样品溶液制备,按2.2.5项下操作测定供试品吸光度值,计算各不同单株艾纳香中总黄酮的含量。
3 结果与分析
3.1 不同单株艾纳香叶片左旋龙脑和总黄酮含量基本统计量
依据100株艾纳香叶片左旋龙脑和总黄酮含量数据统计结果如下(表1和图3),两组数据符合正态分布。其中,左旋龙脑最大值达10.71 mg·g-1,最小值仅1.50 mg·g-1,变异系数为37.39%。而总黄酮最大值206.59 mg·g-1,最小值为65.63 mg·g-1,变异系数为20.13%。说明艾纳香栽培群体内单株间化学成分含量差异显著。

表1 不同单株艾纳香叶片左旋龙脑和总黄酮含量基本统计量 /mg·g-1
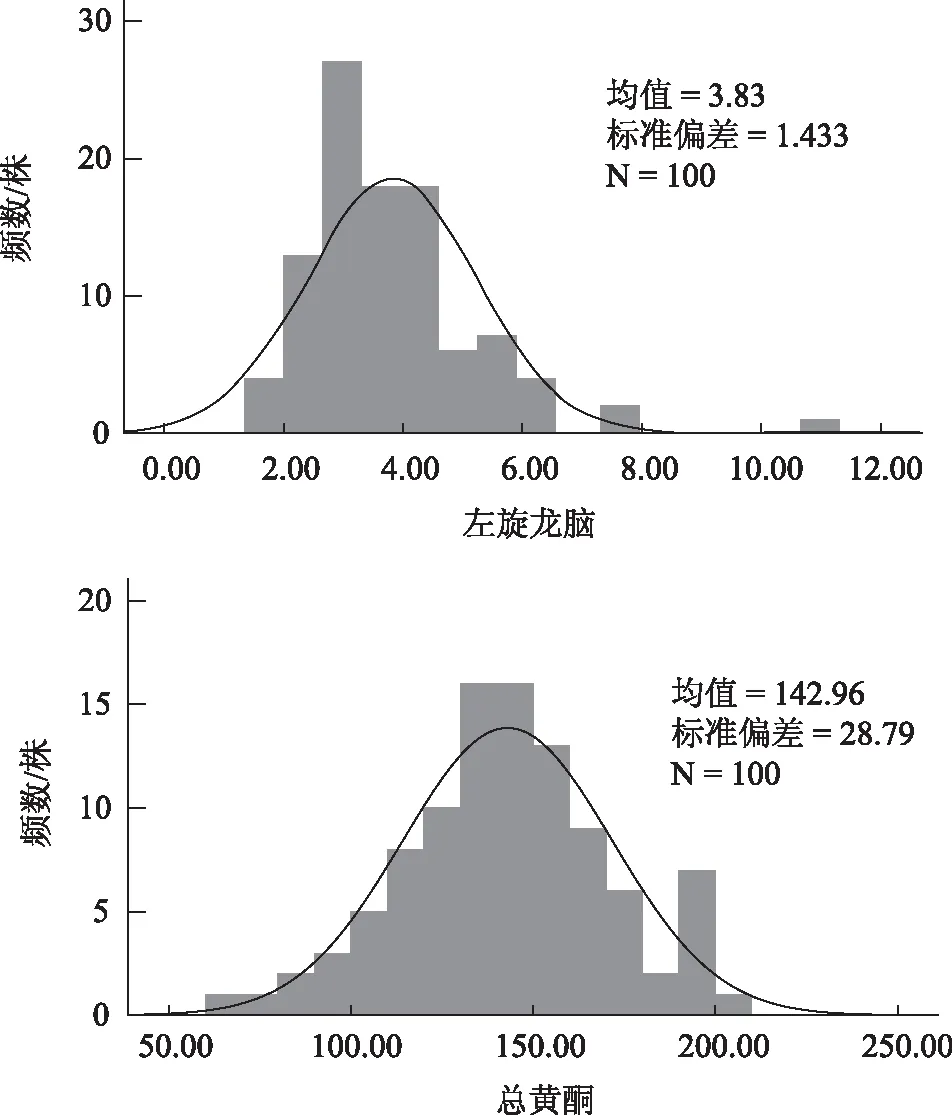
图3 艾纳香单株叶片左旋龙脑和总黄酮含量正态分布
3.2 不同组别艾纳香单株左旋龙脑和总黄酮含量差异分析
采用标准差法进行分组,均值加1倍标准差定为高、中组别临界值,均值减1倍标准差定为中、低组别临界值。据此将100个单株左旋龙脑和总黄酮含量数据划分为高、中、低三组,同时对不同组别采用Duncan’s 法进行多重比较,其结果列于表2。两类成分在三个组别间差异达到极显著(P<0.001)水平。其中,左旋龙脑高含量组占14%,总黄酮高含量组占15%。结果提示,从现有栽培群体内可实现优良单株选择。

表2 不同组别艾纳香单株左旋龙脑和总黄酮含量差异分析
注:不同组别间多重比较采用Duncan’s法(P<0.001)
3.3 艾纳香叶片左旋龙脑与总黄酮含量相关分析
为探讨左旋龙脑与总黄酮在艾纳香叶片中积累的协同性,进一步通过Pearson相关分析(图4)表明,两者之间存在正相关关系(r=0.084,n=100),但不具有统计学意义(P>0.05)。结果提示,同时选择左旋龙脑和总黄酮高含量单株存在较大难度。

图4 艾纳香叶片左旋龙脑与总黄酮含量Pearson相关分析
4 结论与讨论
4.1 艾纳香栽培群体内单株化学成分含量变异较大,可为高含量育种提供材料
艾纳香是具有克隆生长习性的多年生宿根性草本植物[5],因此通过系统选育高含量单株,建立优良材料无性系是实现艾纳香品种选育的重要途径。变异是选择的基础,对发生变异的生物体按照一定的方向和目标连续选择,就能使变异逐渐积累、巩固和加强[9]。艾纳香栽培群体内左旋龙脑和总黄酮含量在单株间表现出较大差异,变异系数分别为37.39%和20.13%。同时左旋龙脑含量最大值(10.71 mg·g-1)和最小值(1.50 mg·g-1)相差达7.14倍;总黄酮含量最大值(206.59 mg·g-1)和最小值(65.63 mg·g-1)亦相差3.15倍。因此,当以左旋龙脑或总黄酮为育种目标时,从现有栽培群体内筛选高含量单株具有较大的选择潜力。
4.2 艾纳香叶片中左旋龙脑和总黄酮积累不具有协同性,应分别对其进行选择
本研究通过对100个样本的左旋龙脑和总黄酮相关分析表明,两类成分不具有统计学意义的相关性(P>0.05)。提示两类成分在叶片中积累不具有协
同性。左旋龙脑为莰烷型双环单萜类化合物,是发生在质体内的脱氧木酮糖-5-磷酸途径[10]。黄酮类化合物的生物合成是通过苯丙烷代谢途径完成[11]。同时,植物次生代谢产物合成存在组织分布特异性和积累时期特异性。所以,以左旋龙脑或总黄酮为育种目标时,对优良材料进行选择时应将两类成分分开选择。
[1] 袁媛,庞玉新,王文全,等.中国艾纳香属植物资源与民族药学研究[J].热带农业科学,2011,31(4):22-27.
[2] 国家药典委员会.中国药典[S].一部.北京:中国医药科技出版社,2010.
[3] Ali DM,Wong KC,Lim PK.Flavonoids fromBlumeabalsamifera[J].Fitoterapia,2005,1:128-130.
[4] 邓芹英,丁丛梅,张维汉,等.艾纳香中黄酮化合物的研究[J].波谱学杂志,1996,13(5):76-78.
[5] 庞玉新,王文全,张影波,等.艾纳香野生种群克隆多样性及克隆结构研究[J].广西植物,2010,30(2):209-214.
[6] 夏稷子,赵智,安军,等.不同产地艾纳香药材的GC指纹图谱研究[J].中国药事,2011,25(12):1191-1194.
[7] 王远辉,王洪新,田洪芸,等.HS-SPME与GC-MS 联用分析不同季节艾纳香叶香气成分[J].食品科学,2012,13(14):166-170.
[8] 黄永林,赵志国,文永新.不同部位艾纳香中总黄酮的含量测定[J].广西植物,2006,26(4):453-455.
[9] 任跃英.药用植物遗传育种学[M].北京:中国中医药出版社,2010
[10] 徐应文,吕季娟,吴卫,等.植物单萜合酶研究进展[J].生态学报,2009,29(6):3188-3197.
[11] 方从兵,宛晓春,江昌俊.黄酮类化合物生物合成的研究进展[J].安徽农业大学学报,2005,32(4):498-504.
IndividualVariationofl-borneolandTotalflavonoidsContentinBlumeabalsamifera(Ai-na-xiang)CulturedPopulation
YUFulai1,2,HUANGMei1,2,PANGYuxin1,2*,WANGDan1,2,XIEXiaoli1,2,CHENZhenxia1,2
(1.TropicalcropsGeneticResourcesInstitute,ChineseAcademyofTropicalAgriculturalSciences/KeyLaboratoryofCropGeneResourcesandGermplasmEnhancementinSouthernChina,Danzhou571737,China; 2.HainanProvincialEngineeringResearchCenterforBlumeaBalsamifera,Danzhou571737,China)
Objective:This study aimed at analyzing the individual variation ofl-borneol and total flavonoids content inBlumeabalsamifera(Ai-na-xiang)cultured population,which provides a theoretical basis for theB.balsamiferadirectional selection breeding with high-content bioactive components.Methods:The content ofl-borneol and total flavonoids randomly chosen from 100 one-year-old plants growing in the same field was determined by GC and UV respectively.Simple correlation analysis and standard deviation grouping were used to analyze the individual variation ofl-borneol and total flavonoids content.Results:The coefficients of variation(CV)ofl-borneol and total flavonoids content were 37.39% and 20.13% respectively.There were highly significant differences(P<0.001)ofl-borneol and total flavonoids content among three groups after standard deviation method grouping.Simple correlation showed thatl-borneol had positive correlation(r=0.084,n=100)with total flavonoids but not significant(P>0.05).Conclusion:Great individual variation ofl-borneol and total flavonoids content inB.balsamiferacultured population is beneficial for bioactive components directional selection breeding.There were different selective effects onl-borneol and total flavonoids for the accumulation ofl-borneol is inconsistent with that of total flavonoids inB.balsamifera.
Blumeabalsamifera;l-borneol;Total flavones;Individual variation;Directional selection
10.13313/j.issn.1673-4890.2014.08.010
2014-03-23)
国家自然科学基金(81303171,81374065);中央级公益性科研院所基本科研业务费专项(1630032013006)
*
庞玉新,副研究员,研究方向:南药资源开发与利用;Tel:(0898)23300268,E-mail:pyxmarx@126.com

