一种压阻式微悬臂梁免疫传感器及其动力学分析
刘志伟, 童朝阳, 穆晞惠, 刘 冰, 郝兰群, 张金平
(防化研究院 国民核生化灾害防护国家重点实验室,北京 102205)
0 引 言
微悬臂梁以其体积小、灵敏度高、不需标记等优点受到越来越多的重视,成为近年研究热点。微悬臂梁读出方法通常包括光学和电学读出。关于光学读出法已有较多文献报道,但光学测量系统体积庞大、需要超真空、低温等环境,一般局限于实验室生化分析[1]。压阻式微悬臂梁是一种新型电学读出悬臂结构,可直接将发生在微悬臂梁表面的生化反应转换为电阻信号变化输出,由于压阻式微悬臂梁读出方式简单、易于集成、成本低、体积小,在现场检测中更具发展前景。但由于压阻式微悬梁加工难度较大,除国外仅有几篇应用报道外[2~5],国内报道还非常少。相思子毒素(abrin)是一种剧毒生物毒素,对其进行快速、灵敏检测极为必要。目前利用压阻式微悬臂梁传感器检测相思子毒素还未见相关的文献报道。本研究以Abrin为作为靶标,构建了一种灵敏度高、响应快速的压阻式微悬臂梁免疫传感器并建立了该传感器的动力学分析方法,为未来发展适合生物毒素现场快速检测的微小型传感器提供技术基础和参考依据。
1 实验部分
1.1 试剂与仪器
Abrin和生物素化的Abrin多抗(bio-pcAb)由本实验室制备;活化生物素(biotin-NHS ester)、3,3,—二巯基丙酸(DDPA)、1—乙基—3—(3—二甲氨丙基)—碳二亚胺盐酸盐(EDC)、N—羟基琥珀酰亚胺(NHS)、亲和素(avidin)、乙醇胺均购自Sigma公司;牛血清白蛋白(BSA,上海国药集团有限公司);PBS缓冲液(pH为7.4,0.01 mol/L)、双蒸水均自备;其它所用化学品和试剂均为分析纯;压阻式微悬臂检测平台由本室与北京大学微电子学研究院共同搭建(图1)(压阻微悬臂梁传感芯片:长200 μm,宽50 μm,厚小于1 μm)。

图1 搭建的压阻式微悬臂梁传感检测平台
1.2 基本原理
压阻式微悬臂梁传感检测是基于半导体材料的压阻效应,在硅微悬臂梁上的合适区域掺杂上半导体材料,由于微悬臂梁表面生化反应的发生而使微悬臂梁弯曲时,会引起掺杂区电阻的变化。因此,可以通过掺杂区电阻的变化来表征悬臂梁的偏转。目前,显示出较强压阻效应的材料是掺杂的单晶硅。悬臂梁上掺杂区的电阻变化可用惠斯通电桥来检测。图2为压阻式微悬臂梁免疫传感器检测原理示意图。

图2 压阻式微悬臂梁免疫传感器检测原理
1.3 实验方法
1.3.1 Abrin多抗的生物素化
参照文献[7]制备生物素标记Abrin多抗,用间接ELISA法测定标记前后的抗体效价。
1.3.2 压阻式微悬臂梁免疫传感器的构建
将芯片置于检测池中,加入DDPA(5 g/L),反应1h使芯片表面金膜包被上羧基;双蒸水清洗芯片和检测池后加入EDC(5 g/L)和NHS(5 g/L),反应0.5 h,完成对微悬臂梁表面的氨基活化修饰;清洗芯片后自然晾干,滴加20 μL100 mg/L的亲和素,反应0.5 h;清洗后滴加20 μL 1 mol/L的乙醇胺反应0.5 h以灭活金膜表面残余的羧基;清洗后将芯片电路与检测平台连接并置于含PBS缓冲溶液的检测池中,加入生物素化的Abrin多抗,实时监测抗体固定过程中输出电压的变化,待响应电压稳定后,清洗芯片及检测池。
1.3.3 Abrin检测
将构建好的传感芯片置于含0.01 mol/L PBS缓冲溶液的检测池中,待信号稳定后向检测池中加入不同浓度的Abrin(一个芯片测量一个浓度),记录传感器的响应电压变化。另以牛血清白蛋白(0.01 mol/L PBS配制)作为对照,考查传感器的特异性。
1.3.4 免疫传感器检测毒素动力学模型
抗原—抗体结合是一种典型的配体、受体结合。根据配体、受体结合的假一级动力学方程[6]与压阻式微悬臂梁电压输出与受力关系的特性,推导出压阻式微悬臂梁电压变化与时间之间的动力学模型。根据建立的动力学模型对Abrin的实际检测数据进行拟合,根据拟合方程求出传感器对不同浓度毒素反应达到平衡的响应电压变化ΔUe、响应时间t0,分析模拟值与实测值之间的关系。
1.3.5 Abrin模拟样品的测定
利用构建的传感器对Abrin终浓度为16 μg/L的水样、土样、牛奶等模拟样品进行检测,记录达到平衡的响应电压变化ΔUe,并与相同浓度Abrin标准样品的ΔUe对比,计算检测的相对回收率、相对标准偏差,以考查传感器的实际应用效果。
2 结果与讨论
2.1 生物素化Abrin多抗效价测定
生物素标记Abrin多抗效价约为1∶2.5×106,与标记前的Abrin多抗效价基本相当,表明生物素标记对Abrin多抗活性没有明显的影响。
2.2 微悬臂梁免疫传感器的构建
加入生物素化Abrin多抗至终浓度分别为195,300 mg/L后,输出电压发生明显变化,输出信号在约20 min时基本达到饱和,输出信号的变化量分别为5,30 μV,表明生物素化Abrin多抗已经修饰到微悬臂梁表面,并且输出信号随着Abrin多抗浓度的增加迅速增大(见图3)。当加入生物素化Abrin多抗的终浓度高于300 mg/L时,传感器输出电压信号无明显增加,因此,微悬臂梁传感芯片上Abrin多抗固定浓度确定为300 mg/L。

图3 固定生物素化Abrin多抗引起微悬臂梁传感芯片输出电压变化实时响应曲线
2.3 Abrin检测
2.3.1 检测限与特异性
用构建好的压阻式微悬壁梁免疫传感器对低浓度的Abrin进行了检测,结果见图4。当Abrin浓度为32,16 μg/L时,输出电压变化信号分别为21.0,10.6 μV,当Abrin的浓度进一步降至8 μg/L时,输出电压变化信号为2.5 μV,再进一步降低Abrin浓度,基本接近噪音信号(约0.8 μV),因此,确定传感器的检测限为8 μg/L(S/N=3 dB)。整个反应迅速达到平衡,在20 min内完成。对照试验表明:加入100 μg/L的牛血清白蛋白,输出电压信号基本无变化,表明传感器具有很好的特异性与抗干扰能力。
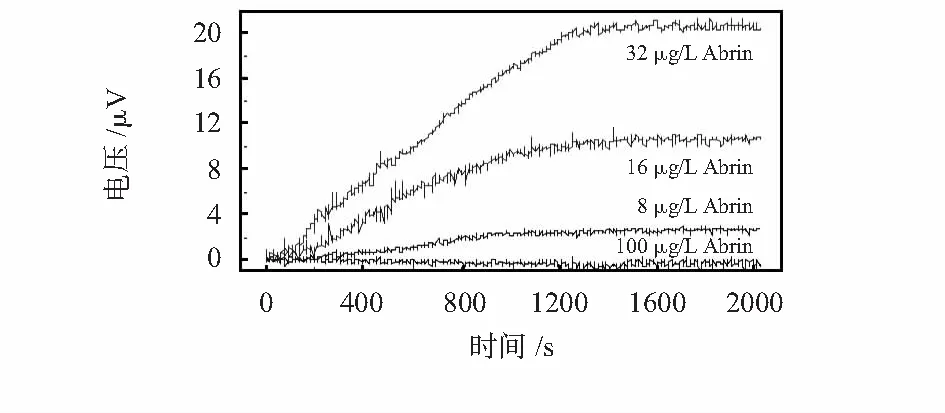
图4 压阻式微悬臂梁免疫传感器检测Abrin的实时响应曲线
2.3.2 重现性
对浓度为16 μg/L的Abrin重复5次测定,ΔUe值为(11.2±1.1)μV,相对标准偏差为9.82 %,传感器重现性较好。
2.4 免疫传感器检测毒素动力学模型建立与分析
Abrin(A)溶液加入到固定有Abrin多抗(B)的微悬臂梁传感芯片检测池中,发生如下反应,生成毒素与抗体的结合物(C)
A+BC.
(1)
在检测池中Abrin浓度很低的情况下,可以认为,免疫反应发生后,溶液中Abrin (A)浓度有显著下降,而固定化多抗(B)仅有极少数与Abrin结合,符合配体—受体结合的假一级动力学模型,可假定传感芯片上Abrin多抗浓度为一常数(BT=K),导出如下公式
(2)
式中Ce为反应达到平衡后传感芯片上形成的抗原—抗体复合物浓度,Ct为t时刻传感芯片上形成的抗原—抗体复合物浓度,kapp为表观速率常数,将上式变形得
(3)
设加样时刻压阻微悬壁梁传感器输出电压为U0,t时刻输出电压为Ut,此时传感芯片上形成的抗原—抗体复合物浓度为Ct,传感芯片表面所受的应力为Ft。由于传感芯片表面所受的应力Ft直接取决于芯片表面形成的抗原—抗体复合物浓度Ct,设Ft=K1Ct(K1为常数)。根据压阻悬臂梁输出电压的变化与悬壁梁上所受的应力F呈正比(比例系数为SF,对于某固定微悬臂梁,SF为一常数)[7]。从而有
ΔU=Ut-U0=SFFt=SFK1Ct,
(4)
即
(5)
将上式代入式(3)得
(6)
在公式两侧同时乘以SFK1得
(7)
设ΔU=Ut-U0,ΔUe=Ue-U0(ΔU为t时刻的输出电压与零时刻输出电压之差,ΔUe为反应达到平衡时刻的输出电压与零时刻的输出电压之差),从而有
(8)
加入Abrin以后,需要一个时间传感器才能响应。设响应时间为t0,则对式(8)进行修正,可变形为
(9)
即ΔU随时间t变化的理论模型。
根据上述建立的理论模型,对检测Abrin的实际结果数据进行了非线性回归分析,结果见图5和表1。

图5 压阻式微悬臂梁免疫传感器检测Abrin的实测数据动力学拟合曲线
从表1可以看出:建立的压阻式微悬臂梁免疫传感器ΔU随t变化的动力学模型(方程式(9))能很好地与不同浓度的Abrin的实测数据进行拟合,相关系数R值均在0.971 1以上(P<0.001),根据拟合方程求出的传感器对不同浓度Abrin反应达到平衡时的响应电压变化ΔUe、响应时间t0均与实测值非常接近,表明压阻式微悬臂梁免疫传感器检测Abrin遵循方程式(9)建立的动力学模式。

表1 压阻式微悬臂梁免疫传感器检测Abrin的实测数据动力学拟合分析
2.5 Abrin模拟样品的测定
采用该传感器对水样、土样、牛奶等模拟样品进行了测定(表2)。结果表明:对于模拟样品的检测,传感器具有较好的回收率和重现性。

表2 相思子毒素模拟样品的测定
3 结 论
本文利用生物素—亲和素放大系统构建了一种压阻式微悬壁梁免疫传感器,实现了对Abrin的快速灵敏检测,对Abrin的检测限达到8 μg/L,反应在20 min内基本达到平衡,传感器具有很好的特异性、重现性与抗干扰能力。建立了压阻式微悬臂梁免疫传感器检测毒素的反应动力学模型,根据模型方程求出Abrin检测的平衡响应电压变化ΔUe、响应时间t0等拟合值均与实测值非常接近,这为表征分析压阻式微悬臂梁免疫传感器检测靶分子的动力学过程提供了理论参考依据。该传感器直接将发生在微悬臂梁表面的生化反应转换为电阻信号变化进行输出,克服了传统光学读出微悬臂梁传感器体积庞大、需要超真空、低温等环境的缺陷,具有不需标记、灵敏度高、操作简单、检测快速等特点,在生化毒素实时检测和现场快速检测方面有较大优势,具有很好的发展前景。
参考文献:
[1] Shu W,Laue E D,Seshia A A.Investigation of biotin-streptavidin binding interactions using microcantilever sensors[J].Biosensors and Bioelectronics,2007,22:2003-2009.
[2] Wee K W,Kang G Y,Park J,et al.Novel electrical detection of label-free disease marker proteins using piezoresistive self-sensing micro-cantilevers[J].Biosensors and Bioelectronics,2005,20:1932-1938.
[3] Yang S M,Chang C,Yin T I,et al.DNA hybridization measurement by self-sensing piezoresistive microcantilevers in CMOS biosensor[J].Sensors and Actuators B,2008,130:674-681.
[4] Seo H,Jung S,Jeon S.Detection of formaldehyde vapor using mercaptophenol-coated piezoresistive cantilevers[J].Sensors and Actuators B,2007,126:522-526.
[5] Zhang Qi,Ruan Wenzhou,Wang Han,et al.A self-bended piezoresistive microcantilever flow sensor for low flow rate measurement[J].Sensors and Actuators A,2010,158:273-279.
[6] 周廷冲.受体生化药理学[M].北京:人民卫生出版社,1985.
[7] Doll J C,Park S J,Pruitt B L.Design optimization of piezoresistive cantilevers for force sensing in air and water[J].Journal of Applied Physics,2009,106:064310—1-064310—12.

