固定化溶菌酶的氧化石墨烯/聚醚砜杂化超滤膜制备及抗菌性能研究
朱军勇,王琼柯,许 欣,刘绰绰,刘金盾,张亚涛
(郑州大学化工与能源学院,郑州 450001)
固定化溶菌酶的氧化石墨烯/聚醚砜杂化超滤膜制备及抗菌性能研究
朱军勇,王琼柯,许 欣,刘绰绰,刘金盾,张亚涛
(郑州大学化工与能源学院,郑州 450001)
以氧化石墨烯(GO)为固定酶载体,在水溶液中通过静电吸附及氢键作用实现溶菌酶(Ly)的固定化得到GO-Ly。并将已固定化酶的GO为添加剂,以聚醚砜为膜材料,采用相转化法制备杂化超滤膜。考察了添加剂含量对膜形态、亲水性、分离性能、力学性能及抗菌性能的影响。结果表明,GO-Ly的加入使杂化膜的亲水性及纯水通量得到明显提高,同时拉伸强度也得到一定改善;尤其当GO-Ly添加量为1.5%(质量分数)时,膜的纯水通量达到318 L/(m2⋅h),并且对聚乙烯醇(PVA 30 000~70 000)的截留率维持在99%以上,对大肠杆菌的抑菌率可达68%。
氧化石墨烯;溶菌酶;聚醚砜超滤膜;抗菌性能
1 前言
超滤是近三十年来崛起的膜分离技术,广泛应用于大分子组成与小分子物质的分离,包括水处理、化工、医药及食品等工业[1~3]。聚醚砜(PES)具有良好的热力学、化学稳定性以及力学性能,已经成为常用的商业超滤膜材料之一。但是PES由于自身疏水性的缺点,在应用中易受膜生物污染,进而导致原液渗透速率降低、通量下降等一系列问题,最终降低膜的效率和使用寿命,限制了PES作为商业膜的应用前景[4~6]。膜生物污染主要由于细菌粘附在膜表面进而生长繁殖并分泌产物,最终形成一层致密的生物膜。制备具有抗菌性能的膜,可阻止细菌等微生物在膜表面形成生物膜并杀死细菌,在一定程度上抑制膜生物污染[7,8]。制备抗菌超滤膜主要通过膜表面改性和共混改性。其中,共混改性简单易行,在保证膜机械性能和化学稳定性的基础上,以抗菌材料作为添加组分制备共混膜,赋予膜一定的抗菌性能,能够减缓膜生物污染[9~12]。因此,膜共混改性有效扩大了超滤膜的适用范围,是制备抗菌超滤膜的有效方法之一。酶是具有生物催化功能的生物大分子,具有催化高效性、选择性强、反应条件温和等特性,相对其他多数抗菌剂,酶可以被微生物分解,且产物大多无毒,符合绿色化学的要求。其中,溶菌酶抗菌谱较广,对革兰氏阳性菌如枯草菌、金黄色葡萄球菌、大肠杆菌等具有较好的抗菌效果。溶菌酶安全性很高,特异性强,在食品、生物工程以及畜牧业中应用广泛[12~15]。氧化石墨烯(GO)是石墨烯氧化物的片层结构,含有大量易改性含氧官能团[16,17]。GO可以通过GO片层与其他分子之间的π-π堆积力、范德华力以及氢键等非共价键进行结合[18]。本文以GO作为固定溶菌酶的载体材料,通过静电作用将溶菌酶固定在GO表面,并以PES作为膜材料,通过共混改性的方法制备抗菌超滤膜。
2 实验部分
2.1 试剂与仪器
天然石墨粉(粒径约为45 μm),青岛兴和石墨有限公司;PES,工业品,BASF公司;异硫氰酸荧光素(FITC),95%,溶菌酶,生化试剂,百灵威化学试剂有限公司;聚乙二醇(PEG 20 000),分析纯,上海化学试剂厂;聚乙烯吡咯烷酮(PVP),N,N-二甲基乙酰胺(DMAc),分析纯,天津市科密欧化学试剂有限公司;聚乙烯醇(PVA 30 000~70 000),分析纯,ACROSORGANICS,美国。其他试剂均为分析纯。
美国FEI公司TECNAI G2型透射电子显微镜(TEM);杭州赛菲膜分离技术有限公司SF-SB型膜性能评价仪,测试条件为0.2 MPa;日本岛津公司UV-2450型紫外-可见分光光度计(UV-Vis);日本JEOL公司JSM-6700F型扫描电子显微镜(SEM),测试电压为25 kV;接触角测定仪(OCA20),德国Dataphysics公司;万能材料试验机,AG-10-TB,日本津岛公司;落射荧光显微镜(BM-21AY),上海彼爱姆光学仪器制造有限公司。
2.2 GO的制备
取4.5 g石墨粉末加入烧瓶中,添加体积比为9∶1的浓H2SO4/H3PO4混合液,在磁力搅拌条件下缓慢加入25 g高锰酸钾,油浴温度50℃下搅拌24 h。反应结束后自然冷却,加入1 000 mL碎冰,搅拌中加入30%H2O2直至混合物变为金黄色,超声2~3 h。通过超声降解法将其剥离成GO片层;将剥离后的混合液低速离心去沉淀,再高速离心。下层沉淀用30%盐酸洗涤并磁力搅拌12 h,离心并用无水甲醇离心洗涤3遍,真空干燥24 h。
2.3 GO固定溶菌酶
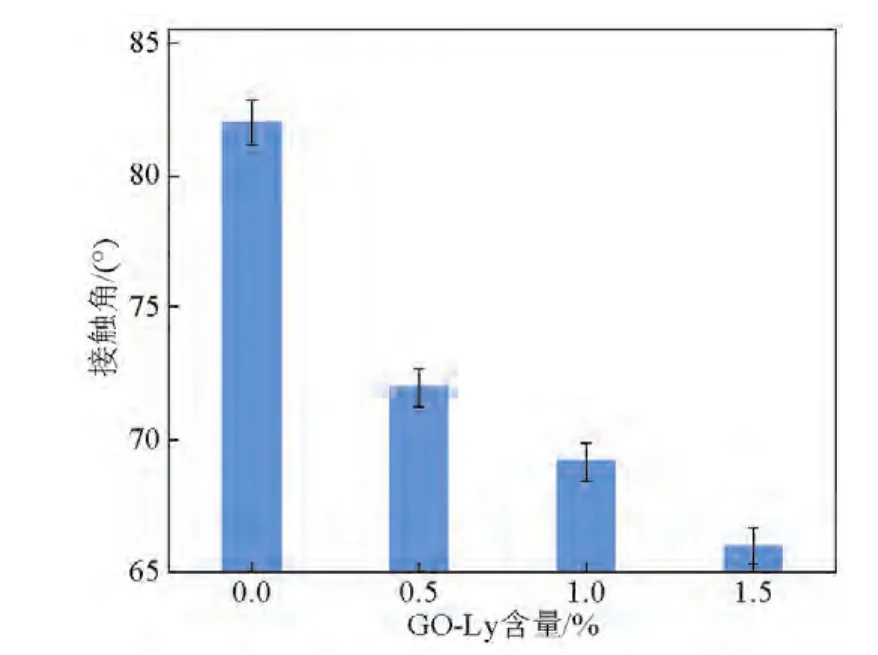
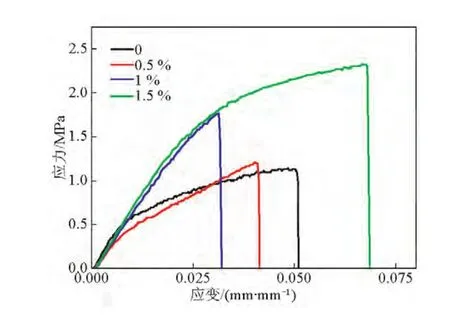
GO表面含有大量含氧官能团,当4 具体实验步骤如下:取50 mg上文制备的GO加入100 mL磷酸盐缓冲液中(0.2 mol/L、pH=6.2),室温条件下超声分散30 min;取180 mg溶菌酶加入上述缓冲液中,在4℃冰水浴中磁力搅拌1 h;反应结束后,离心,收集上清液测定酶固定量;将沉淀用同种缓冲液多次洗涤以除去物理吸附的溶菌酶,将最终产物真空冷冻干燥后置于4℃环境中保存,即获得固定化溶菌酶(GO-Ly)。 如图1所示,将一定量的GO-Ly超声分散于DMAc中,随后将一定量的PES、丙酮、PVP加入到DMAc溶剂中,在室温下机械搅拌至少15 h,制备出透明的均相铸膜液;过滤,真空脱泡;然后在干净的玻璃板上用刮刀刮出厚度约为0.1 mm的初生态膜,随后放入40℃去离子水中相转化成膜。 配制铸膜液(100 g)的组分及含量分别为:PES 18 g,PVP 8 g(致孔剂),DMAc 73.2 g以及丙酮0.8 g。铸膜液中GO-Ly的添加量为PES质量的0%、0.5%、1.0%、1.5%。以GO-Ly添加量为0%时制备的超滤膜作为空白对照组。 图1 抗菌超滤膜制备过程示意图Fig.1 The process scheme of preparation of antibacterial ultrafiltration membrane 评价PES超滤膜分离性能的重要指标是纯水通量和截留率。本文采用膜性能评价仪测定超滤膜的纯水通量J和对两种溶质(PEG 20 000和PVA 30 000~70 000,初始浓度均为0.5 g/L)的截留率R。用UV-Vis测量透过液的浓度。纯水通量J和截留率R通过式(1)和式(2)计算。 式(1)中,J为纯水通量,L/(m2⋅h);A为有效膜面积,m2,本文中A为0.222 3 m2;Δt为透过时间,h;V为Δt时间内通过膜的透过液的体积,L。 式(2)中,R为截留率,%;Cp为透过液的浓度,mg/L;Cf为原料液中的浓度,mg/L;Cp和Cf的值均由UVVis测得。 为判定抗菌剂的加入对超滤膜弹性拉伸力和断裂伸长率的影响,本文采用AG-10-TB万能材料试验机测试超滤膜。测定前,将样品膜裁剪成50 mm×25 mm(长×宽)大小,对样品条以拉伸速度10 mm/min进行拉伸测试。每个样品膜测定3次,实验结果取平均值。 实验中选择大肠杆菌(E.coli)为实验对象。实验用到的仪器均经灭菌处理,并在无菌操作台完成实验。制备106数量级的大肠杆菌菌液备用。将各种膜剪碎后称取0.06 g于试管中(用空白膜作为对照),每个试管中加入5 mL 106数量级的大肠杆菌菌液,置于37℃、250 r/min的摇床中培养4 h。培养后取出试管摇匀,吸取0.5 mL菌液于4.5 mL的无菌水中稀释,该试管中的菌浓度为培养后浓度的10-1,并按此稀释,得到的稀释浓度依次是10-2、10-3、10-4和10-5。取10-5浓度的稀释液0.1 mL于平板上,涂布均匀(此步骤做两个平行实验)。将平板倒置于37℃恒温培养箱中,培养12 h后观察结果,采集图像并对菌落计数,按式(3)计算抑菌率(BR) 式(3)中,A为对照组最终培养出的菌落数,cfu;B为实验组最终培养出的菌落数,cfu。 图2a为GO的TEM图像,从图中可以看出,所制备的GO为纳米片层结构,并且呈现带有褶皱的薄纱形貌,表现出了GO的典型特征。为进一步观察固定溶菌酶后的GO形貌变化,本研究对GO-Ly做了TEM分析,如图2b所示,GO片层堆积,不再是良好的单层纳米片薄纱状结构,褶皱更加明显,表明溶菌酶成功固定在GO表层。 图2 GO和GO-Ly的TEM图Fig.2 TEM images of GO and GO-Ly 本文利用具有荧光特性的FITC标记溶菌酶,观察标记后的溶菌酶(FITC-溶菌酶)固定于GO的荧光图片,结果如图3所示。图3所示为以静电吸附方式得到的GO-Ly。在激发波长为490 nm条件下,荧光显微镜中可观察到明亮的黄绿色荧光。图3中明显充满明亮的荧光,这表明溶菌酶通过静电吸附能成功固定到GO表面。 3.3.1 膜上表面及断面形貌 为研究GO-Ly的添加对膜形态的影响,图4a为超滤膜上表面的SEM图像,可以看出空白膜表面粗糙平整。图4b为杂化膜的上表面,可以看出,与GO-Ly共混后的杂化膜表面更加平整,粗糙程度降低,这从另一个角度说明了杂化膜的亲水性高于空白膜,这一结果与亲水性能测试结果一致。图4c和图4d分别为空白膜和杂化膜的断面形貌,由图可知GO-Ly的加入并未改变膜的指状孔结构,但杂化膜的致密皮层厚度变厚,这可能是由于GO-Ly的加入增加了铸膜液的黏度,延长了相分离时间所导致的。另外,杂化膜皮层较空白膜稀疏,膜孔密度增大;指状孔壁是较稀疏的海绵结构,指状孔增多,孔径增大,上下贯通性良好。 3.3.2 膜的亲水性能 图4 空白膜和杂化膜的上表面与断面的SEM图像Fig.4 SEM images of supine surface and cross-section of bare membrane and hybrid membrane 通过比较空白膜与杂化膜的接触角,研究不同GO-Ly添加量对杂化超滤膜表面亲水性能的影响,如图5所示。从图5中可以看出,不含GO-Ly的PES膜具有较大的接触角(82º),显示出较高的疏水性能。随着GO-Ly添加量的增加,膜的接触角持续降低,当添加量为1.5%(质量分数)时,接触角低至66°,说明杂化膜亲水性随着GO-Ly添加量的增加不断升高。这主要是由于GO富含大量亲水性基团,另外GO的比表面积相当大(2 600 m2/g),溶菌酶分子在其表面的结合位点由GO边缘大量的羧基以及基面上随意分布的羟基和环氧基提供。GO固定溶菌酶后仍然有相当大的面积暴露在外,具有亲水性。在相转化过程中,随着铸膜液中GO-Ly含量增加,具有亲水性能的GO-Ly向膜表面移动以减少表面能,从而提高了共混膜表面的亲水性。 3.3.3 分离性能 图5 添加剂GO-Ly含量对膜接触角的影响Fig.5 The effect of GO-Ly content on contact angle of hybrid membrane 图6显示了不同含量的GO-Ly对杂化膜分离性能的影响。由图6可知,在0.1 MPa下,不含GO-Ly的空白膜的纯水通量仅为198.5 L/(m2⋅h)。随着GO-Ly含量的增加,杂化膜的纯水通量显著提高,当含量仅为1.5%(质量分数)时,杂化膜的纯水通量增至318 L/(m2⋅h),与空白膜相比,通量提高了60.2%。另外,随着GO-Ly含量的增加,纯水通量增加的趋势变缓,开始阶段主要由于添加剂的亲水性使得纯水通量明显增加,但是随着含量的增加,一方面由于GO-Ly本身疏水,另一方面由于含量增加导致团聚概率大大增加,而GO片层不能透水,使得膜的有效透过面积降低,进而影响了杂化膜的透过性能。图6也显示了当GO-Ly含量分别为0.5%、1.0%和1.5%(质量分数)时杂化膜对PEG 20 000和PVA 30 000~70 000截留率的变化。随着GO-Ly含量的增加,杂化膜对PEG 20 000的截留率降低,介于73%~87%,而对PVA 30 000~70 000具有良好的截留效果。这可能是由于GO-Ly发生局部团聚,加入到铸膜液中后,可能造成杂化膜的孔径增大,孔密度增加,表现为纯水通量增大,对PEG 20 000的截留率下降。 图6 不同含量GO-Ly对杂化膜的纯水通量及截留率的影响Fig.6 The effect of GO-Ly content on water flux and rejection of hybrid membrane 3.3.4 膜的力学性能 通过测定杂化膜的拉伸强度和断裂伸长率考察GO-Ly添加量对膜的机械性能的影响,其拉伸应力-应变曲线如图7所示。杂化膜的机械性能主要受到添加剂分子交联和膜的均相性两方面因素的影响。由图7可知,当GO-Ly含量增加时,杂化膜的拉伸强度基本呈增加趋势,但断裂伸长率则出现不规律变化,可能是由于GO-Ly粒径较大,在膜主体中分散不均匀使膜均相性下降所造成的。 3.3.5 抗菌性能 本文通过引入具有抗菌性能的GO-Ly制备抗菌杂化膜,GO-Ly的作用是增加膜的抗菌性能。为了考察杂化超滤膜的抗菌性能,选择大肠杆菌做膜的抗菌实验。抗菌效果如图8所示。随着GO-Ly含量的增加,杂化膜的抗菌性能升高。由图8可知,相对空白膜培养皿中大肠杆菌的数量,杂化膜培养皿中大肠杆菌的数量明显减少,说明GO-Ly对大肠杆菌有一定抑制作用,同时也证明了GO-Ly已经被引入膜材料中。相对于空白膜,杂化膜对大肠杆菌的抑菌率为68%。 图7 不同含量的GO-Ly对杂化膜力学性能的影响Fig.7 The effect of GO-Ly content on mechanical property of hybrid membrane 图8 空白膜及含1.5%GO-Ly杂化膜对大肠杆菌的抗菌效果Fig.8 Antibacterial effect of PES membrane and hybrid membrane with 1.5%of GO-Ly against E.coli 在常温条件下,杂化膜保存2个月后仍然具有良好的抗菌活性,说明GO-Ly杂化超滤膜具有一定的抗菌持久性。 以GO为固定溶菌酶的载体材料,主要通过静电吸附方式使溶菌酶固定在GO表面,并通过GOLy与PES共混制备GO-Ly/PES杂化膜。通过对杂化膜进行一系列表征得到以下结论:GO-Ly的加入能较大程度地改善杂化膜的亲水性;另外,随着GOLy含量的增加,杂化膜的纯水通量显著增大,虽然对PEG 20 000的截留率降低,但是对PVA 30 000~70 000的截留率仍维持在99%以上,同时对大肠杆菌的抑菌率可达68%,并表现出了一定的抗菌持久性。 [1]Susanto Heru,Ulbricht Mathias.Characteristics,performance and stability of polyethersulfone ultrafiltration membranes prepared by phase separation method using different macromolecular additives[J].Journal of Membrane Science,2009,327(1/2):125-135. [2]Puro L,Kallioinen M,Mänttäri M,et al.Performance of RC and PES ultrafiltration membranes in filtration of pulp mill process waters[J].Desalination,2010,264(3):249-255. [3]Su Yanlei,Li Chao,Zhao Wei,et al.Modification of polyethersulfone ultrafiltration membranes with phosphorylcholine copolymer can remarkably improve the antifouling and permeation properties[J].Journal of Membrane Science,2008,322(1):171-177. [4]Shi Qing,Su Yanlei,Zhu Shiping,et al.A facile method for synthesis of pegylated polyethersulfone and its application in fabrication of antifouling ultrafiltration membrane[J].Journal of Membrane Science,2007,303(1/2):204-212. [5]Yu Haoxia,Zhang Yatao,Zhang Jingyi,et al.Preparation and antibacterial property of SiO2-Ag/PES hybrid ultrafiltration membranes[J].Desalination and Water Treatment,2013,51(16-18):3584-3590. [6]Chen Yifeng,Zhang Yatao,Liu Jindun,et al.Preparation and antibacterial property of polyethersulfone ultrafiltration hybrid membrane containing halloysite nanotubes loaded with copper ions[J].Chemical Engineering Journal,2012,210:298-308. [7]Ciston Shannon,Lueptow Richard M,Gray Kimberly A.Bacterial attachment on reactive ceramic ultrafiltration membranes[J].Journal of Membrane Science,2008,320(1/2):101-107. [8]Zhu Xiaoying,Bai Renbi,Wee Kin-Ho,et al.Membrane surfaces immobilized with ionic or reduced silver and their anti-biofouling performances[J].Journal of Membrane Science,2010,363(1/2):278-286. [9]Chen Yifeng,Zhang Yatao,Zhang Haoqin,et al.Biofouling control of halloysite nanotubes-decorated polyethersulfone ultrafiltration membrane modified with chitosan-silver nanoparticles[J].Chemical Engineering Journal,2013,228:12-20. [10]Yu Haoxia,Zhang Xiaofei,Zhang Yatao,et al.Development of a hydrophilic PES ultrafiltration membrane containing SiO2@N-Halamine nanoparticles with both organic antifouling and antibacterial properties[J].Desalination,2013,326:69-76. [11]Zhang Jingyi,Zhang Yatao,Chen Yifeng,et al.Preparation and characterization of novel polyethersulfone hybrid ultrafiltration membranes bending with modified halloysite nanotubes loaded with silver nanoparticles[J].Industrial&Engineering Chemistry Research,2012,51:3081-3090. [12]Yu Liang,Zhang Yatao,Zhang Bing,et al.Preparation and characterization of HPEI-GO/PES ultrafiltration membrane with antifouling and antibacterial properties[J].Journal of Membrane Science,2013,447:452-462. [13]Li W,Li X,Wang Q,et al.Antibacterial activity of nanofibrous mats coated with lysozyme-layered silicate composites via electrospraying[J].Carbohydrate Polymers,2014,99:218-225. [14]Eby D Matthew,Schaeublin Nicole M,Farrington Karen E,et al.Lysozyme catalyzes the formation of antimicrobial silver nanoparticles[J].ACS Nano,2009,3(4):984-994. [15]Wang Qiang,Fan Xuerong,Hu Yingjun,et al.Antibacterial functionalization of wool fabric via immobilizing lysozymes[J].Bioprocess and Biosystems Engineering,2009,32(5):633-639. [16]Edwards J Vincent,Prevost Nicolette T,Condon Brian,et al.Covalent attachment of lysozyme to cotton/cellulose materials:Protein verses solid support activation[J].Cellulose,2011,18(5):1239-1249. [17]Paredes J I,Villar-Rodil S,Martinez-Alonso A,et al.Graphene oxide dispersions in organic solvents[J].Langmuir,2008,24(19):10560-10564. [18]Wang Shiren,Zhang Yue,Abidi Noureddine,et al.Wettability and surface free energy of graphene films[J].Langmuir,2009,25(18):11078-11081. Preparation and antibacterial property of polyethersulfone hybrid ultrafiltration membrane containing GO immobilized by lysozyme Zhu Junyong,Wang Qiongke,Xu Xin,Liu Chuochuo,Liu Jindun,Zhang Yatao Graphene oxide(GO)provides an ideal substrate for lysozyme immobilization due to a large specific surface area and abundant functional groups.The lysozyme immobilization on the GO sheets could take place readily by electrostatic interaction of GO-lysozyme(GO-Ly).The immobilized lysozyme of GO used as the addictive was blended with polyethersulfone(PES)to prepare hybrid ultrafiltration membrane via phase inversion.The effect of GO-Ly content on the morphology,hydrophilicity,separation,mechanical and antibacterial properties of hybrid membranes was investigated.The results showed that the surface hydrophilicity and water flux were significantly improved with the increase of GO-Ly content.Meanwhile,the mechanical strength of hybrid membrane was also increased.Especially when GO-Ly content was 1.5%,the water flux reached up to 318 L/(m2⋅h).The rejection of polyvinyl alcohol(PVA 30 000~70 000)was 99%and the antibacterial rate of the hybrid membrane against E.coli could achieve 68%. graphene oxide;lysozyme;polyethersulfone ultrafiltration membrane;antibacterial property O631;TQ028.8 A 1009-1742(2014)07-0023-07 2014-05-08 国家自然科学基金项目(21106137,21376225);中国博士后基金项目(2013M531684);大学生创新实验训练计划项目(2013xjxm075,2013xjxm072) 张亚涛,1980年出生,男,河南项城市人,教授,主要从事抗菌超滤膜及CO2促进传递膜研究;E-mail:zhangyatao@zzu.edu.cn2.4 抗菌超滤膜的制备

2.5 膜的分离性能、机械性能和抗菌性能表征

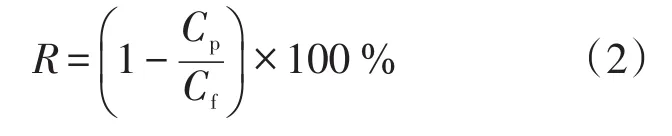

3 结果与讨论
3.1 GO及GO-Ly的表征

3.2 GO-Ly荧光分析
3.3 抗菌超滤膜的性能研究




4 结语
(School of Chemical Engineering and Energy,Zhengzhou University,Zhengzhou 450001,China)

