MBR-CANON工艺处理生活污水的快速启动及群落变化
张肖静,李 冬,梁瑜海,张玉龙,何永平,范 丹,张 杰
(1.哈尔滨工业大学城市水资源与水环境国家重点实验室,150090哈尔滨;2.北京工业大学水质科学与水环境恢复工程北京市重点实验室,100124北京)
近年来发展起来的厌氧工艺将越来越多的废水有机碳源转化为生物能源利用,导致传统脱氮工艺硝化反硝化所需碳源不足,进而限制了脱氮效率[1].而全程自养脱氮工艺(completely nitrogen removal over nitrite,CANON)可以利用氨氧化细菌(AOB)和厌氧氨氧化菌(anammox)的协同作用,在不消耗有机碳源的条件下实现脱氮,同时节省63%的曝气量,被认为是最经济有效的脱氮途径,目前已成功应用于一些生物膜系统中[2-3].在这些系统中,AOB处于生物膜外层消耗 DO,anammox处于缺氧内层去除氨氮和亚氮,然而生物膜法存在的堵塞等问题限制了该工艺的进一步发展.因此,关于活性污泥法CANON工艺的研究十分必要.目前活性污泥法的研究一般集中在SBR工艺[4-5]以及近几年新兴的膜曝气反应器[6-7].由于自养菌AOB及 anammox生长缓慢,导致CANON工艺的启动周期长,去除负荷低,解决这些问题的关键是污泥的截留.MBR反应器可以将所有微生物截留在反应器内,达到较高的生物浓度,使反应器的去除负荷得到提高,同时具有较好的出水水质.有研究表明,MBR可以有效富集以游离或者聚集体形式存在的AOB和anammox等自养菌[8],因此,若将MBR应用于CANON工艺的研究,一方面可以解决该工艺负荷低等问题,另一方面将推进MBR在污水处理领域的应用,目前关于 MBR-CANON工艺的研究未见报道,此外,CANON工艺的研究大多是基于高氨氮或者高温废水进行的,常温生活污水的研究较少,为此,提出采用MBR反应器研究生活污水CANON工艺.
本实验考察了常温下低氨氮CANON工艺的快速启动策略,以及该工艺应用于实际生活污水处理的可行性.同时,利用变性梯度凝胶电泳(PCR-DGGE)技术分析了不同运行阶段反应器内的微生物群落结构特征.
1 实验
1.1 反应器设置
采用有机玻璃圆柱形MBR反应器(图1).反应器高20cm,内径20cm,有效体积5.5L.内部放置聚偏氟乙烯中空纤维膜组件(厦门,鲲扬),膜孔径0.1 μm,有效面积0.2 m2.底部设曝气环供氧,并设搅拌器混合泥水.整个反应器置于直径为30 cm的水浴中,保证恒温25℃运行.
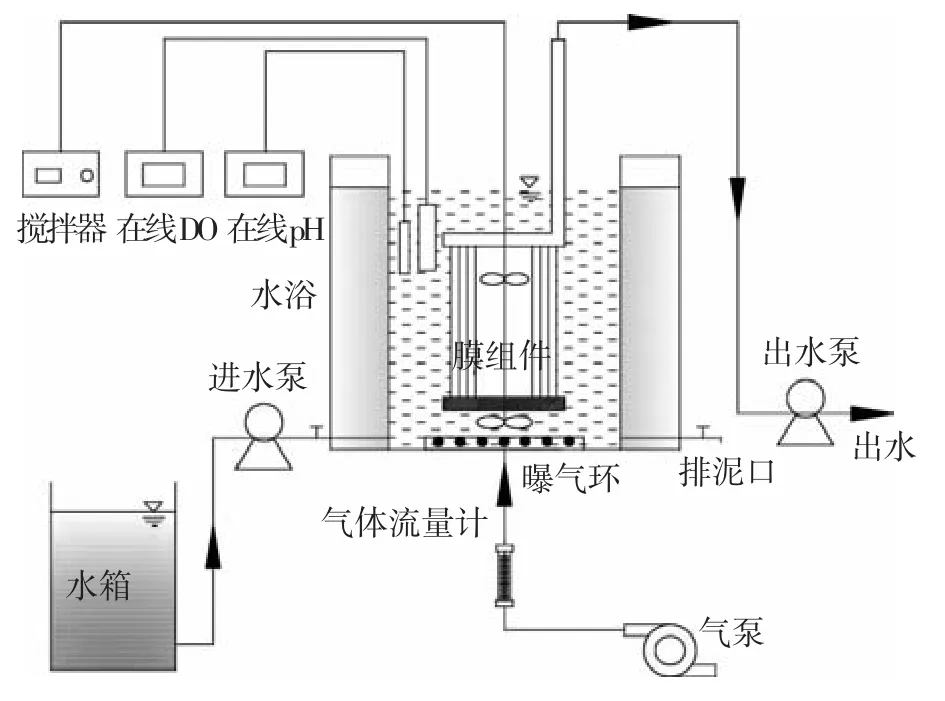
图1 MBR反应器装置
1.2 接种污泥及废水
接种污泥取自以A2/O工艺运行的北京高碑店污水处理厂的普通活性污泥(12.9 g/L,2 L).实验前期采用人工配水(NH4+-N为80 mg/L左右,接近拟处理的生活污水质量浓度),后期处理某大学生活区污水.配水以(NH4)2SO4和NaHCO3为主要基质,并添加 KH2PO4(0.068 g/L)、MgSO4·H2O(0.15 g/L)、CaCl2(0.068 g/L)及微量元素(1 mL/L).实验共进行240 d,包括亚硝化的启动、CANON工艺的启动及稳定运行、处理生活污水3个阶段.实验期间污泥龄为100 d,反应温度25℃,其他运行参数及各阶段水质指标见表1.
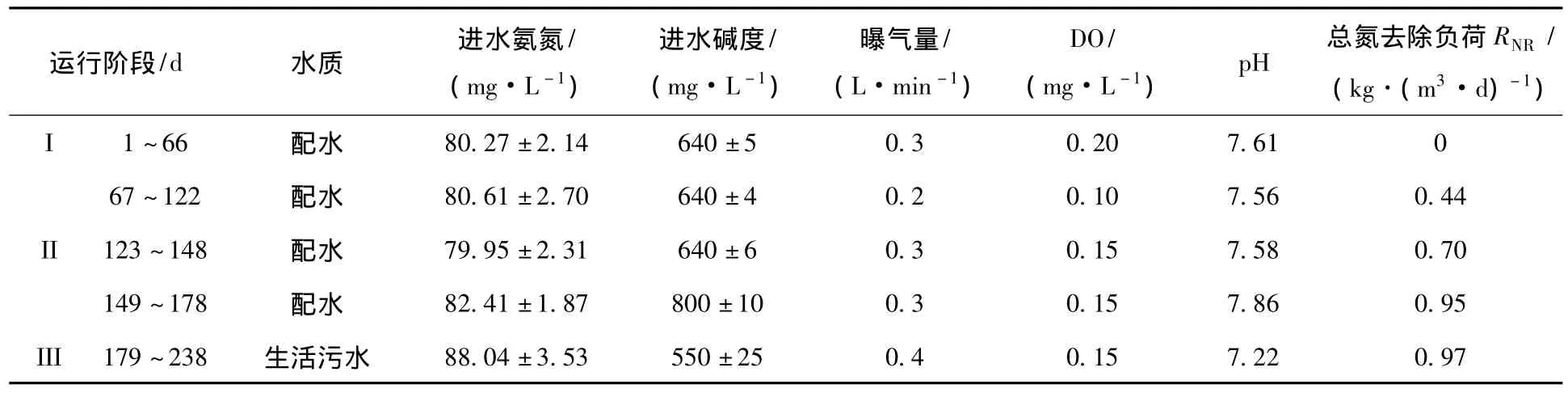
表1 实验期间水质指标及反应器运行参数
1.3 分析方法
NH4+-N:纳氏试剂分光光度法;NO2--N:N-(1-萘基)-乙二胺分光光度法;NO3--N:紫外分光光度法;COD:5B-3B型COD测定仪;碱度:ZDJ-2D电位滴定仪;DO、pH、T:WTW多电极测定仪.
1.4 变性梯度凝胶电泳—克隆—测序
从不同阶段的反应器中取混合液离心后收集沉淀,取 1.5 g沉淀加入 10 ml磷酸缓冲液(0.1 mol/L,pH8.0)清洗2次.按文献[9]方法进行总DNA提取,电泳检验后用试剂盒(上海生工)对DNA纯化回收,以回收的DNA为模板进行PCR.采用通用引物 BSF338-GC(5’-(下划线部分为“GC”夹)和BSR518(ATTACCGCGGCGCTGG)对全细菌16S rRNA基因V3区进行扩增[10].反应体系组成为:DNA 1.0 μL,10 × Buffer 2.5 μL,dNTPs(2.5 mmol/L)2.0 μL,正义引物和反义引物(10 μmol/L)各1 μL,Ex Taq 酶(5 U/μL)0.125 μL,补水至终体积为25 μL.PCR扩增条件为:94℃,5 min;94℃,40 s,55 ℃,40 s,72 ℃,1 min,35 个循环;72℃,10 min.在 D-Code System(Bio-Rad)内利用DGGE对PCR产物进行分离,电泳条件:聚丙烯酰胺8%,变性梯度30% ~60%,缓冲液为1×TAE,电压120 V,温度60℃,时间5 h.之后将凝胶进行银染[11],将凝胶上条带切下溶于200 μL 1×TE中,4℃放置过夜.以此为模板再次进行PCR扩增.将纯化回收的PCR产物连接到载体pMD19-T(TaKaRa)上,并转化到感受态细胞E.coli DH5α(TaKaRa)中克隆.阳性克隆送交上海生工生物公司进行测序,获得的序列通过BLAST进行比对,并提交至Gentbank.
2 结果与讨论
2.1 MBR亚硝化的启动及稳定运行
亚氮的积累是实现CANON工艺的关键步骤,这需要在富集AOB的同时抑制NOB的活性.本阶段控制进水氨氮为80 mg/L左右,碱度为640 mg/L左右,曝气量为 0.3 L/min,DO为0.2 mg/L左右,采用逐渐减小HRT(8~3.5 h)的策略抑制NOB,MBR的运行情况如图2所示.亚氮在最初2 d短暂积累后迅速降至0,所有的氨氮均被转化为硝氮,之后随着HRT的降低,氨氧化率逐渐下降,出水氨氮增多,然而出水亚氮仍然为0,说明NOB的活性没有受到抑制.直至第25天当HRT降为3.5 h时,亚氮开始积累,亚氮积累率(RNA)在一周之内迅速上升至60%以上,此时,氨氮去除率为50%左右,认为成功实现了AOB的富集及亚硝化启动.然而,随着反应的进行,RNA难以进一步提高,说明此时NOB的活性依然没有被完全抑制.为了进一步提高RNA,继续降低HRT为2.4 h,亚氮积累率又迅速上升,最终达99%以上,并保持稳定运行20 d,之后进行CANON工艺的启动.
减小HRT的本质是缩短反应时间,使NOB没有足够的时间消耗亚氮,最终实现亚氮的积累.同时,反应时间的减少也导致大量氨氮残留在反应器中,形成较高的游离氨(FA)质量浓度,在第天亚氮开始积累时,反应器内氨氮浓度为50 mg/L左右,FA质量浓度为2.6 mg/L,能够有效抑制NOB的活性.同时,反应器内DO较低,一直维持在0.2 mg/L左右,也有利于氧饱和常数较低的AOB生长.随着AOB活性的增强及数量的增多,氨氧化率在亚氮积累后也逐渐回升,最终稳定在70%左右,这说明HRT的降低并没有限制AOB的活性,最终出水氨氮降为20 mg/L以下.该阶段的实验结果表明,通过调节HRT在限氧条件下可以快速启动亚硝化,该方法简单易实施,无需改变进水水质、升温或者外部投加药物等.

图2 MBR亚硝化的快速启动
2.2 MBR-CANON工艺的启动及稳定运行
本阶段的主要目的是诱导anammox的活性,实现CANON工艺.在亚硝化启动成功并稳定运行后,保持其他参数不变,将曝气量由0.3 L/min降为0.2 L/min,此时反应器内DO降为0.2 mg/L,而污泥絮体形成的氧梯度可以使内部的DO降到更低,因而有利于anammox的生存.同时进一步降低HRT为1.9 h,提高进水氨氮负荷,使得单位氨氮的氧分压减少,也有利于CANON工艺的实现[7].由图3可知,在降低曝气量后反应器内逐渐出现了 TN去除的现象,第 78天RNR达0.1 kg/(m3·d),CANON 工艺启动成功.之后RNR逐渐升高,但升高速度缓慢,且反应器内有较多的氨氮残留.原因是AOB活性较低,不能将所有的氨氮转化为亚氮,因此,为了提高氨氮去除率,在第123天加大曝气量为0.3 L/min,RNR迅速升高,最终稳定在0.70 kg/(m3·d)左右.这说明之前的供氧不足限制了CANON的活性,适当加大曝气量有利于TN的去除.之后发现反应器中同时有氨氮与亚氮残留,原因是anammox的活性不足,不能将氨氮和亚氮完全转化为氮气.有研究认为提高无机碳源质量浓度有利于提高anammox的活性[12].因此,在进水中增加了NaHCO3的质量浓度,使无机碳源质量浓度达200 mg/L左右,pH由7.58升高到7.86,结果RNR第二次迅速上升,最终稳定在0.95 kg/(m3·d)左右.
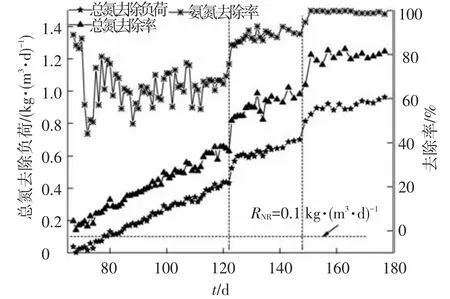
图3 MBR-CANON工艺的启动及高效运行
CANON的启动归因于以下几个方面:MBR中膜的截留能力可将微生物截留在反应器内,适宜SRT较长的微生物如AOB和anammox生长,避免了功能菌的流失;膜的抽吸作用使一些污泥吸附在膜丝表面,形成局部缺氧微环境,为anammox的增殖创造了适宜条件;反应器内较低的DO和较高的氨氮负荷有利于AOB和anammox的生存.本阶段实验结果说明曝气不足会抑制CANON的脱氮效果,但较高的曝气不利于CANON的稳定,可能造成亚氮积累或者诱导NOB的活性,因此,应维持适宜的曝气量及DO.此外,较高的无机碳源有利于强化anammox的活性,提高总氮去除负荷.目前已报道的活性污泥法CANON工艺的启动时间均需几百天以上,去除负荷在 0.06 ~ 0.8 kg/(m3·d)[13],而且大多接种的为不易获得的厌氧氨氧化污泥.而本实验接种普通活性污泥在78 d内成功启动了CANON工艺,并且具有较高的总氮去除负荷(0.95 kg/(m3·d))和去除率(81%),具有较明显的优势.
2.3 MBR-CANON工艺处理生活污水的运行效果
从第179天起将MBR用于处理生活污水,考虑到生活污水中存在300 mg/L左右的COD,将曝气量增加为0.4 L/min,处理效果见图4.引入生活污水第1天,RNR即降至0.63 kg/(m3·d).研究表明,有机物的增加将抑制anammox的活性,同时,生活污水中含有的固体悬浮颗粒(SS)及表面活性剂等物质均不利于微生物的生存.初始COD去除率为20%,之后逐渐上升,最终稳定在80%左右,这可能是由于生活污水中存在一部分异养菌,在好氧条件下其活性逐渐增强,将COD氧化,出水COD降到100 mg/L以下.反应器内COD的降低消除了其对anammox的抑制,RNR的下降速率逐渐减缓,在第192天开始回升,最终稳定在0.97 kg/(m3·d)以上.可见本实验COD对微生物的抑制是暂时且可逆的,而且该工艺处理生活污水的TN去除比配水时略高,原因是生活污水中存在的COD使反应器内发生了一部分反硝化或者短程反硝化反应,AOB、anammox、异养菌以及反硝化菌在MBR内协同作用,共同完成了TN和COD的高效去除.
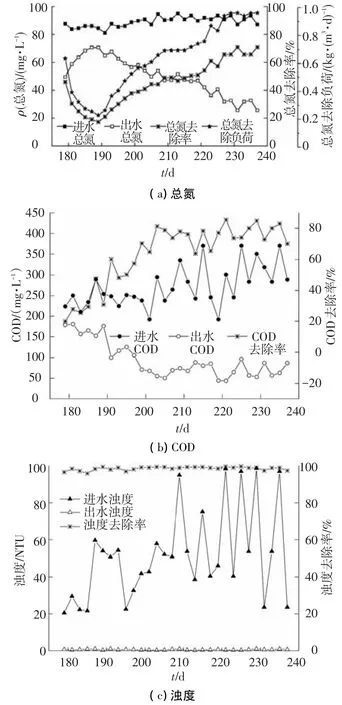
图4 生活污水中污染物的去除效果
值得注意的是,MBR能够有效截留SS.本阶段由于天气、人为、生活规律等影响,进水浊度波动较大,但是出水浊度均保持在1 NTU以下,达到了回用水标准.目前城市污水厂采用的传统硝化-反硝化脱氮工艺,消耗较多的曝气量及外加碳源,同时出水需要二沉池静沉及进一步的深度处理.本研究采用MBR-CANON系统处理生活污水,节省63%的曝气量,同时无需外加碳源,在单一反应器内实现了总氮和COD的同时高效去除,无需二沉池即可得到较好的出水水质,出水可直接用于校园草坪及花圃的浇灌等,为含氮废水的处理及回用提供了新思路.
2.4 微生物群落结构特征
图5为DGGE图谱结果,4个样品从左至右依次为接种污泥、反应器运行第60天、第170天及第235天的泥样,测序及BLAST比对结果见表2.接种污泥中,β-变形菌纲(β-Proteobacteria)、γ变形菌纲(γ-Proteobacteria)、浮霉菌纲(Planctomycetia)以及酸杆菌门(Acidobacteria)的微生物为占优势地位的菌群,此外还存在梭菌纲(Clostridia)、杆菌纲(Bacilli)、α-变形菌纲(α-Proteobacteria)的微生物.然而,以无机配水运行60 d后,条带数由13个减少为6个,说明生物种类减少,最终在实现CANON工艺后,脱氮菌成为反应器中的优势菌群.

图5 不同阶段的反应器内微生物DGGE结果
条带7、12与 AOB中的亚硝化单胞菌属(Nitrosomonas)相似度高达97%和99%,在种泥与反应器运行的3个阶段均存在,这说明反应器的运行条件有利于该种微生物的生存,AOB逐渐成为反应器中的优势菌群.条带9与AOB中的Nitrosococcus mobilis相似度高达99%,只存在于第I、II阶段,说明城市污水及生活污水中有机物的存在不利于该种微生物的生存.条带6与浮霉菌纲(Planctomycetia)中的待定斯图加特库氏菌(Candidatus Kuenenia)相似度高达99%,Candidatus Kuenenia是一种典型的Anammox菌属[16],在反应器运行的第II阶段才出现,与反应器表现出自养脱氮能力的时间一致,证明反应器内氨氮的去除是由AOB和anammox菌共同作用完成的.值得注意的是,条带13所代表的NOB中的Nitrobacter在4个样品中均存在,这说明本实验中NOB只是活性受到了抑制,并没有被完全淘洗出反应器.污水处理系统中氨氧化细菌的多样性程度越高,对复杂环境的适应能力越强,抗冲击能力就越强,该反应器中存在两种氨氧化菌和一种厌氧氨氧化菌,构成了较为稳定的脱氮系统.
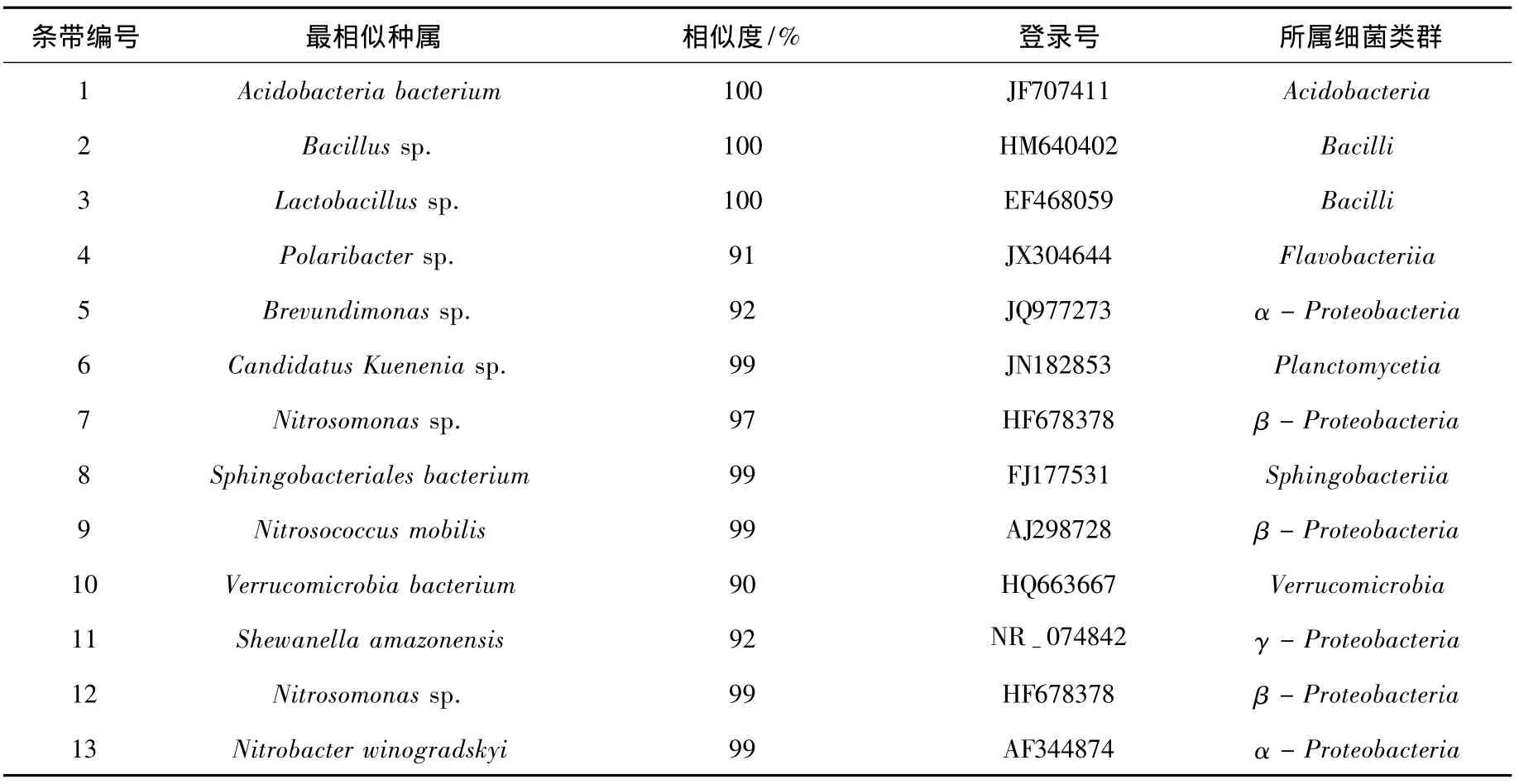
表2 序列比对结果
3 结论
1)在曝气量为0.3 L/min的限氧条件下,保持进水氨氮不变,通过减小HRT,在常温MBR反应器内经32 d快速启动亚硝化.
2)亚硝化启动成功后,减小曝气量为0.2 L/min,并进一步降低HRT为1.9 h,经78 d启动CANON工艺,并通过调节曝气量及无机碳源质量浓度,提高总氮去除负荷至0.95 kg/(m3·d).
3)将稳定运行的CANON工艺应用于生活污水的处理,可以实现COD与氨氮的同时高效去除,TN去除负荷达0.97 kg/(m3·d)以上,COD去除率达80%以上,出水浊度小于1 NTU.
4)微生物群落在反应器运行的不同阶段发生了较大变化,稳定运行的MBR-CANON反应器中检测到的氨氧化细菌为亚硝化单胞菌属(Nitrosomonas),厌氧氨氧化菌与Candidatus Kuenenia stuttgariensis的相似度高达99%.
[1]KARTAL B,KUENEN J G,LOOSDRECHT van M C M.Sewage treatment with anammox[J].Science,2010,328(5979):702-703.
[2]QIAO S,NISHIYAMA T,FUJII T,et al.Rapid startup and high rate nitrogen removal from anaerobic sludge digester liquor using a SNAP process [J].Biodegradation,2012,23(1):157-164.
[3]CHO S,FUJII N,LEE T,et al.Development of a simultaneous partial nitrification and anaerobic ammonia oxidation process in a single reactor[J].Bioresour Technol,2011,102(2):652-659.
[4]THIRD K A,SLIEKERS A O,KUENEN J G,et al.The CANON system(completely autotrophic nitrogenremoval overnitrite)underammonium limitation:interaction and competition between three groups of bacteria[J].Syst Appl Microbiol,2001,24(4):588-596.
[5]SLIEKER A O,DERWORT N,CAMPOS-GOMEZ J L,et al.Completely autotrophic nitrogen removal over nitrite in one single reactor[J].Water Research,2002,36(10):2475-2482.
[6]GONG Z,YANG F,LIU S,et al.Feasibility of a membrane-aerated biofilm reactor to achieve single-stage autotrophic nitrogen removal based on anammox[J].Chemosphere,2007,69(5):776-784.
[7]PELLICER-NACHER C,SUN S P,LACKNER S,et al.Sequential aeration of membrane-aerated biofilm reactors forhigh-rate autotrophic nitrogen removal:experimental demonstration[J].Environmental Science& Technology,2010,44(19):7628-7634.
[8]YUAN L M,ZHANG C Y,ZHANG Y Q,et al.Biological nutrient removal using an alternating of anoxic and anaerobic membrane bioreactor(AAAM)process[J].Desalination,2008,221(1/2/3):566-575.
[9]杨洋,左剑恶,全哲学.UASB反应器中厌氧氨氧化污泥的种群分析[J].中国环境科学,2006,26(1):52-56.
[10]OVREAS L,FOMEY L,DAAE F L,et al.Distribution of bacterioplankton in meromictic Lake Saelenvannet,as determined by denaturing gradient gel electrophoresis of PCR-amplified gene fragments coding for 16S rRNA[J].Applied and Environmental Microbiology,1997,63(9):3367-3373.
[11]BASSAM B J,CAETANO-ANOLLES G,PETER M G.Fast and sensitive silver staining of DNA in polyacrylamide gels[J].AnalyticalBiochemistry,1991,19(6):80-83.
[12]CHEN Y P,LI S,FANG F,et al.Effect of inorganic carbon on the completely autotrophic nitrogen removal over nitrite(CANON)process in a sequencing batch biofilm reactor[J].Environmental Technology,2012,33(23):2611-2617.
[13]AHN Y H,CHOI H C.Autotrophic nitrogen removal from sludge digester liquids in upflow sludge bed reactor with external aeration[J].Process Biochemistry,2006,41(9):1945-1950.
[14]CHAMCHOI N,NITISORAVUT S,SCHMIDT J E.Inactivation of ANAMMOX communities under concurrent operation of anaerobic ammonium oxidation(ANAMMOX)anddenitrification[J].Bioresour Technol,2008,99(9):3331-3336.
[15]刘涛,李冬,曾辉平,等.常温下CANON反应器中功能微生物的沿程分布[J].哈尔滨工业大学学报,2012,44(10):22-27.
[16]郑平,张蕾.厌氧氨氧化菌的特性与分类[J].浙江大学学报:农业与生命科学版,2009,35(5):473-481.

