奶牛乳脂降低综合征理论及其分子调节机制
赵 勐 卜登攀 张养东 周凌云
(中国农业科学院北京畜牧兽医研究所,动物营养国家重点实验室,北京 100193)
乳脂是牛奶营养品质的重要指标之一,牛奶中乳脂的含量和组成与人类健康密切相关,牛奶中的不饱和脂肪酸对于预防疾病(高血压、高胆固醇以及心脑血管疾病等)有积极作用[1-2]。乳脂降低综合征(milk fat depression,MFD)是当前奶牛养殖实践中普遍存在的问题,也是当前研究的热点和难点。随着人们对乳脂降低综合征的深入研究,不同的理论体系和各种分子生物学机制被提出来用于解释乳脂降低综合征。本文旨在综述乳脂降低综合征的理论体系现状以及分子生物学机制研究进展。
1 乳脂降低综合征概念
乳脂降低综合征是指饲粮因素引起的牛奶乳脂率和乳脂含量降低的一种现象,降低幅度可达50%,而乳蛋白、乳糖含量以及产奶量等并未受到明显影响。引起乳脂降低综合征的饲粮因素主要包括2方面:一是饲粮中含有大量易发酵的碳水化合物;二是饲粮中含有丰富的不饱和脂肪酸[3]。
1845年,人们用甜菜饲喂奶牛时发现,牛奶乳脂率下降,这是对乳脂降低综合征的最早认识[4]。随后,人们发现饲喂鱼油或高精料低粗料饲粮也会发生乳脂降低综合征。近期研究人员发现,在高精料低粗料饲粮条件下,瘤胃异常代谢产物(脂多糖、组胺以及反式脂肪酸等)增加,乳脂和脂肪酸组成发生改变[5]。随着研究的不断深入,解释乳脂降低综合征的理论也相继提出。
2 解释乳脂降低综合征相关理论
自从1845年人们首次发现乳脂降低综合征,多种理论体系被提出用于解释乳脂降低综合征,主要理论体系可分为2类:一类是底物不足理论,这种理论主要包括饲粮中脂肪不足理论、乙酸不足理论、β-羟丁酸不足以及葡萄糖-胰岛素理论等;二类是乳脂合成抑制理论,此理论主要包括维生素B12缺乏理论、反式脂肪酸抑制理论以及生物氢化理论(图1)[6]。
2.1 底物不足理论
2.1.1 脂肪不足理论
脂肪不足理论是最早用于解释乳脂降低综合征的理论,人们认为饲粮中脂肪含量不足引起乳脂降低综合征,脂肪不足理论也因此被提出。随后,科研人员进行大量试验来验证该理论,结果发现,减少饲粮中脂肪含量后,乳脂含量变化很小。因此,脂肪不足理论并不能解释乳脂降低综合征[7-8]。
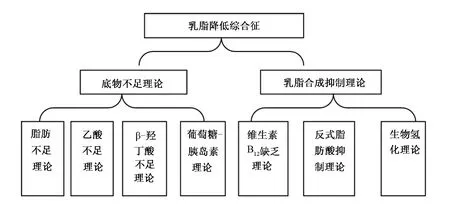
图1 乳脂降低综合征相关理论Fig.1 Milk fat depression related theories
2.1.2 乙酸不足理论
乙酸不足理论由Tyznik等[9]提出。该理论认为乙酸不足是引起乳脂降低综合征的主要原因。乙酸是牛奶乳脂合成的重要底物,乳脂脂肪酸中的中短链脂肪酸是由乳腺摄取乙酸和β-羟丁酸从头合成。此理论的提出主要是在高精料低粗料饲粮条件下,瘤胃的发酵模式发生改变,挥发性脂肪酸(VFA)组成比例发生改变,乙酸比例降低,丙酸比例升高,因此,乙酸不足理论被提出。乙酸灌注试验被用于验证此理论的可靠性,灌注试验发现,乳脂含量仅轻微升高[3]。此外,Bauman 等[10]发现,高精料低粗料的饲粮条件下,乙酸在VFA中的比例降低主要是由于丙酸产量增加引起,乙酸的实际产量并未发生明显改变。由此,人们认为乙酸不足并不是引起乳脂降低综合征的主要原因,并不能完全解释乳脂降低综合征。
2.1.3 β-羟丁酸不足理论
β-羟丁酸不足理论由 Van Soest等[11]提出。与乙酸不足理论类似,该理论认为β-羟丁酸是引起乳脂降低综合征的主要原因,β-羟丁酸也是中短链脂肪酸合成的底物,其主要有2个来源:一是来源于瘤胃上皮细胞,由丁酸转化而来,二是来源于肝脏酮体的生成过程。高精料低粗料的饲粮条件下,瘤胃中丙酸产量增加,丙酸能够抑制肝脏的酮体产生过程,血液中β-羟丁酸是酮体的主要成分,进而减少β-羟丁酸的产量,但β-羟丁酸对于乳脂脂肪酸的贡献率最大为8%[6],而乳脂降低综合征中乳脂率下降可达50%,因此,该理论也不能解释乳脂降低综合征。
身体素质各指标与总分的相关性,除女子坐位体前屈与总分低度相关外(r=0.317,P<0.01),其余指标男女皆与总分呈中度相关。其中50m、800m(女)、1000m(男)与总分呈中度负相关(r男50m=0.530,r男1000m=-0.694,r女50m=-0.534,r女800m=-0.620,P<0.01),其余都呈中度正相关。因此,作为大学生要想体测成绩达到优秀,每一项身体素质都不能落下,他们共同构建体质健康整体。
2.1.4 葡萄糖-胰岛素理论
葡萄糖 -胰岛素理论由 McClymont等[12]提出,此理论是建立在组织器官利用营养素具有差异性的基础上。胰岛素能够促进脂肪组织的脂肪沉积,抑制脂解过程,但是,奶牛乳腺对胰岛素含量的改变无明显功能学应答。葡萄糖-胰岛素理论的核心为血液中葡萄糖和胰岛素含量过高,引起乳脂降低。在高精料低粗料的饲粮模式下,易发酵碳水化合物含量较高,瘤胃发酵产生丙酸增多,血液中丙酸含量升高,促进肝脏糖异生过程,血糖含量升高,引起胰岛素分泌增多,血液中高浓度的胰岛素促进脂肪组织利用乙酸、β-羟丁酸以及吸收的脂肪酸,同时,抑制脂肪组织的脂解作用,体脂动员受限制,据估计4% ~8%乳脂脂肪酸来源于体脂动员[6],乳腺可摄取长链脂肪酸含量相对减少,这样既可以减少乳中中短链脂肪酸的合成,又可以限制长链脂肪酸的摄取,进而引起乳脂降低综合征[13]。
葡萄糖-胰岛素理论能在一定程度上解释乳脂降低综合征,但也存在一定的局限性。首先,大量灌注试验结果与饲粮诱导的乳脂降低综合征结果在乳脂含量上相矛盾,Bauman等[6]总结了24个葡萄糖灌注试验的结果,发现乳脂含量变异范围也较大,变化范围(-16%)~(+4%)。高胰岛素-正常血糖夹试验被用于验证胰岛素在乳脂合成过程中的作用,与对照组相比,试验组血液中胰岛素含量升高4倍,结果发现乳脂含量变化不明显[14]。其次,灌注试验结果与饲粮诱导的乳脂降低综合征结果在乳脂脂肪酸组成上相矛盾,在丙酸和葡萄糖灌注以及高葡萄糖-正常血糖夹试验中,脂肪酸的组成发生改变,结果表明中短链脂肪酸合成量增加,长链脂肪酸含量减少[6],而饲粮诱导的乳脂降低综合征中,中短链脂肪酸合成减少,长链脂肪酸摄取增加。因此,葡萄糖-胰岛素理论用于解释乳脂降低综合征需进一步研究。
2.2 乳脂合成抑制理论
乳脂合成抑制理论是指经过外源添加或者体内产生的物质抑制乳脂的合成,通过影响乳脂合成过程关键酶和基因的表达来实现,最终引起乳脂降低综合征。根据乳脂降低综合征的研究,乳脂合成抑制理论主要包括:维生素B12缺乏理论、反式脂肪酸抑制理论和生物氢化理论,其中后两者是近来研究比较多,被众多学者所接受的理论[6]。
2.2.1 维生素B12缺乏理论
维生素 B12缺乏理论由 Frobish等[15]提出,该理论认为维生素B12在乳脂合成过程中起关键作用。维生素B12是甲基丙二酸单酰辅酶A变位酶,维生素B12的缺乏能够引起丙酸代谢异常,造成甲基丙二酸在机体内的蓄积,甲基丙二酸能够抑制乳腺脂肪酸的从头合成,造成乳脂合成能力降低。然而,已有研究证明,在高精料低粗料的饲粮条件下,瘤胃中的维生素B12含量减少,但补充维生素B12后,乳脂未出现无明显改善[16]。因此,该理论未被作为解释引起乳脂降低综合征的主要原因。
2.2.2 反式脂肪酸抑制理论
1970年,Davis等[17]提出反式脂肪酸抑制理论。随后,Pennington等[18]对该理论进行了详细的阐述。反式脂肪酸是由饲粮中不饱和脂肪酸经过瘤胃氢化作用产生。反-11-十八碳脂肪酸(trans-11 C18)是瘤胃液中最主要的反式脂肪酸,若饲粮含有大量精料或不饱和脂肪酸,瘤胃液和牛奶中的反-10-十八碳脂肪酸(trans-10 C18)含量增加[19-20]。Piperova 等[21]研究结果表明,饲粮诱导的乳脂降低综合征能够增加牛奶中trans-10 C18含量。有研究人员提出,瘤胃液trans-10 C18含量的增加与乳脂降低综合征可能存在密切关系。Zened等[22]通过体外试验发现,培养基中加入高淀粉或者添加不饱和脂肪酸时,乳脂脂肪酸的类型发生改变,由 trans-11 C18向 trans-10 C18转变。随后Zened等[23]通过饲养试验证实,奶牛在饲喂高淀粉以及添加不饱和脂肪酸饲粮时,瘤胃中脂肪酸的氢化发生改变,脂肪酸由trans-11 C18向trans-10 C18形式转变。
反式脂肪酸存在多种异构体,并不是每种反式脂肪酸都能引起乳脂降低综合征,反-9-油酸(trans-9 C18∶1)、反 -11- 油酸(trans-11 C18∶1)和反-12-油酸(trans-12 C18∶1)并不能引起乳脂降低综合征[24-25]。研究发现,乳脂降低综合征中乳脂含量和反-10,顺-12共轭亚油酸(trans-10,cis-12 CLA)含量呈显著线性关系[26],Baumgard等[27]试验证明,每天仅需灌注 3.5 g trans-10,cis-12 CLA能造成乳脂降低20%。Maxin等[3]研究发现,饲粮每天添加1.6 g trans-10,cis-12 CLA后,乳脂率降低15%。对于其他反刍动物,Hussein等[28]在山羊试验中发现,每天饲喂山羊1.5 g trans-10,cis-12 CLA,乳脂率和乳脂含量均下降23%。trans-10,cis-12 CLA被公认为是引起乳脂降低综合征的重要反式脂肪酸抑制因子。因此,反式脂肪酸虽未完全解释乳脂降低综合征,但其被认为是引起乳脂降低综合征的主要原因之一,能够很大程度解释乳脂降低综合征。
2.2.3 生物氢化理论
生物氢化理论是在反式脂肪酸抑制理论的基础上发展起来的,反式脂肪酸是饲粮中的脂类物质在瘤胃细菌氢化作用下产生的,因此,在饲粮诱导下产生的乳脂降低综合征中,生物氢化理论是通过各种反式脂肪酸来解释的。反式脂肪酸抑制理论中涉及的trans-10,cis-12 CLA就是瘤胃微生物氢化产生,在生物氢化过程中产生的其他脂肪酸异构体也可能引起乳脂降低综合征,Baumgard等[27]通过真胃灌注部分氢化植物油(PHVO)引起乳脂含量减低25%,部分PHVO中含有43%反式油酸,结果说明某种或某些被氢化的植物油能够引起乳脂含量降低。
生物氢化理论也存在一定的局限性,一方面体现在牛奶中乳脂含量降低与奶牛体况变化的矛盾上。在乳脂降低综合征中,乳脂含量降低,减少牛奶中能量输出,但奶牛的体况未变化,甚至降低,这是生物氢化理论无法解释的。另一方面是生物氢化理论与硬脂酰辅酶A去饱和酶(SCD)9活性的矛盾,饲粮引起的乳脂降低综合征能够抑制SCD9活性,但是在生物氢化理论中,SCD9活性未发生改变[27]。此理论虽然存在一定的局限性,但其在解释乳脂降低综合征方面得到众多学者的认可,生物氢化过程中产生的某些脂肪酸及其异构体能够调节乳脂的合成。
3 乳脂降低综合征产生的分子调节机理的研究
牛奶乳脂中的脂肪酸主要来源于2个部分,四至十四碳饱和脂肪酸(C4∶0~C14∶0)和50%的棕榈酸(C16∶0)来源于乳腺组织內源从头合成,底物主要是乙酸和β-羟丁酸;另外50%的C16∶0和所有的十八碳脂肪酸来源于血液,血液中脂肪酸则直接来源于饲粮或机体脂肪组织中甘油三酯的动员。脂肪酸合成过程所涉及的主要基因包括:乙酰辅酶A羧化酶(ACACA)、脂肪酸合成酶(FAS)、脂蛋白脂酶(LPL)、脂肪酸结合蛋白(FABP)以及 SCD 等[29]。
3.1 乳脂从头合成相关基因的变化
牛奶中的中短链脂肪酸(C4∶0~C14∶0以及50%C16∶0)是乳腺组织內源从头合成,血液中的乙酸和β-羟丁酸是乳腺所利用的底物。乳脂降低综合征过程中,乳中的中短链脂肪酸发生改变,此过程主要是通过改变乳腺从头合成脂肪酸过程中关键基因表达实现。Bernard等[30]研究表明,ACACA和FAS基因表达水平与牛奶中中短链脂肪酸含量呈正相关。Mach等[31]在饲粮诱导的乳脂降低综合征中发现,乳中中短链脂肪酸含量降低,相应地,乳腺中ACACA和FAS基因表达水平也降低。Baumgard等[32]采用真胃灌注 trans-10,cis-12 CLA和Harvatine等[33]通过静脉注射trans-10,cis-12 CLA诱导的乳脂降低综合征试验中,乳腺中ACACA、FAS以及相关转录调节蛋白基因表达水平降低。Loor等[34]研究了乳脂降低综合征的转录组学变化,在高精料低粗料饲粮诱导的乳脂降低综合征的模型中,乳腺中FAS和ACACA关键基因表达下调。
3.2 长链脂肪酸摄取相关基因的变化
乳中长链脂肪酸[十六碳以上脂肪酸(>C16)以及50%C16∶0]主要是依靠乳腺从血液中直接摄取,乳脂降低综合征影响乳中长链脂肪酸含量也是通过改变关键基因表达实现。奶牛饲粮中添加植物油能够增加乳中长链脂肪酸的含量,但对于高精料饲粮引起的乳脂降低综合征中,乳中长链脂肪酸含量未增加,甚至呈降低趋势[19,21]。有研究表明,对于反刍动物,乳腺摄取长链脂肪酸存在物种差异性,奶山羊饲粮中添加植物油,乳中长链脂肪酸均升高;而奶牛饲粮中添加长链脂肪酸,乳中长链脂肪酸变化较大[35]。Peterson 等[36]研究表明,在高精料饲粮条件下,乳腺中LPL基因表达水平降低。Harvatine等[33]研究静脉灌注trans-10,cis-12 CLA对乳腺乳脂合成相关基因表达的影响时发现,乳腺脂蛋白酯酶基因表达水平降低。Drackley等[37]提出乳腺脂蛋白酯酶基因表达水平能够反映乳腺对长链脂肪酸的摄取情况,但底物可利用性、动脉血中甘油三酯含量等因素是决定乳脂合成的重要因素,研究乳腺对长链脂肪酸摄取时,需综合考虑血液中底物可利用性等因素。
3.3 乳脂合成调控因子变化
乳脂的合成是在各种酶的催化作用下完成,而表达这些酶的基因也受到多种转录调控因子的控制。已有研究表明,固醇调节元件结合蛋白(SREBP)、过氧化物酶体增殖物激活受体(PPARs)研究比较广泛,是重要的乳脂合成转录调节因子。SREBP属于核转录因子家族成员,是脂肪合成基因的转录调节因子[38]。PPARs属于核激素受体家族成员,为配体激活转录因子,在反刍动物乳脂合成过程起重要调节作用[39]。SREBP和PPARs能够调节 ACACA、FAS、LPL以及 SCD基因的表达[34,39-40]。Bionaz 等[41]证实饲粮诱导的乳脂降低综合征中SREBP和PPARs含量降低,能够调节乳脂合成中相关基因表达。Harvatine等[33]通过静脉灌注 trans-10,cis-12 CLA 试验也证实SREBP和PPARs对乳脂合成基因的调控作用。
对于反刍动物,SREBP和PPARs是研究最多的乳脂合成调控因子。随着研究的深入,其他转录调控因子也相继被提出,甲状腺激素响应(Spot14)基因在哺乳动物的脂肪组织内表达,如腹脂和乳腺组织,故被认为是一种乳脂合成调控因子,有关Spot14基因已被广泛研究[42]。Harvatine等[33]发现静脉灌注 trans-10,cis-12 CLA 试验中,Spot14基因表达发生改变。在啮齿类动物研究中证实Spot14是重要的乳脂合成调控因子,但其在奶牛乳脂合成过程中的作用有待进一步研究。Anderson等[43]在啮齿类动物肝细胞试验中证明,腺苷酸活化蛋白激酶能够降低SREBP1基因表达,能够调节乳脂合成过程。McFadden等[44]利用乳腺上皮细胞试验证明,腺苷酸活化蛋白激酶能够抑制乳脂合成,促进LPL、3-磷酸甘油酰基转移酶以及PPARG基因表达,抑制FAS、FABP3和SREBP基因表达。肝脏X受体(LXR)是一类与脂类代谢相关的核激素受体蛋白,可分为LXRα和LXRβ,其能够作用于脂肪合成基因的启动子,促进FAS基因的表达,同时,LXR是SREBP的激活因子,能够通过SREBP调节乳脂合成相关基因的表达[45]。
近年来,乳脂降低综合征的机理研究取得了很多进展,但相关的代谢通路以及关键调节代谢物仍需深入研究。脂肪酸、蛋白质及其他代谢物都会影响乳脂合成过程的关键环节。啮齿类动物中乳脂合成调控的关键分子尚未在反刍动物研究中探明,主要包括:蛋白激酶B能够提高SREBP1的稳定性,蛋白激酶B能够抑制糖原合成激酶3(GSK3)活性,糖原合成激酶3(GSK3)能够降解SREBP或者使SREBP基因泛素化[43];Botolin等[46]研究发现,二十二碳六烯酸(DHA)能够抑制SREBP基因在肝脏细胞内的表达,在肝细胞中,DHA主要通过26S蛋白酶体抑制乳脂的合成,但在乳腺上皮细胞中的作用尚未证实;在蛋白激酶样内质网激酶(PERK)基因敲除小鼠试验中发现,PERK能够抑制 SREBP1的活性,抑制脂质生成[47];肝脏中 CD36是 LXR的靶基因,LXR可直接上调CD36的表达,也可通过上调过氧化物酶体增殖物激活受体C,再上调CD36的表达,CD36在肝脏摄取脂质,进而导致脂肪的堆积。LXR激动剂可导致肝脏内脂肪的积聚和血浆中甘油三酯含量的升高,甚至引起肝脂肪变性[48];高精料低粗料饲粮条件下,瘤胃的异常代谢产物反式脂肪酸能够抑制乳脂的合成和影响脂肪酸的组成,其他异常代谢产物能否直接或间接影响乳脂的合成也成为重要研究方向,有研究人员提出,脂多糖能够通过炎症反应影响乳脂合成,血浆中急性期反应蛋白C与乳脂含量呈强负相关,而急性期反应蛋白C与脂多糖密切相关[49-50]。因此,乳脂降低综合征的具体原因和机理需要进一步的研究来阐述。
4 小结
乳脂降低综合征是影响牛奶品质的重要因素之一,随着人们对其研究的不断深入,引起乳脂降低综合征的因素及机理研究取得了很大进展。目前,虽然反式脂肪酸抑制理论和生物氢化理论的研究最多、说服力最强,但很多学者认为乳脂降低综合征是由多种因素(底物不足、反式脂肪酸抑制以及生物氢化)共同引起或者具有其他理论能够解释乳脂降低综合征,例如瘤胃其他异常代谢产物(脂多糖等)与乳脂降低综合征之间的关系,这有待进一步研究。分子生物学方面的研究也很大程度促进了人们对乳脂降低综合征的认识和了解,相关信号通路以及分子机制的研究能够解释乳脂降低综合征的发生机理,为运用营养学等相关手段预防乳脂降低综合征提供科学依据。
[1]BAUMAN D E,LOCK A L.Milk fatty acid composition:challenges and opportunities related to human health[C]//Proceedings of the 26th world buiatrics congress.Santiago:[s.n.],2010:278-289.
[2]冯志华,高艳霞,李秋凤,等.奶牛脂肪营养研究进展[J].动物营养学报,2013,25(6):1137-1143.
[3]MAXIN G,GLASSER F,HURTAUD C,et al.Combined effects of trans-10,cis-12 conjugated linoleic acid,propionate,and acetate on milk fat yield and composition in dairy cows[J].Journal of Dairy Science,2011,94(4):2051-2059.
[4]VAN SOEST P J.Nutritional ecology of the ruminant[M].2nd ed.Ithaca:Cornell University Press,1994.
[5]COLMAN E,KHAFIPOUR E,VLAEMINCK B,et al.Grain-based versus alfalfa-based subacute ruminal acidosis induction experiments:similarities and differences between changes in milk fatty acids[J].Journal of Dairy Science,2013,96(7):4100-4111.
[6]BAUMAN D E,GRIINARIJM.Regulation and nutritional manipulation of milk fat:low-fat milk syndrome[J].Livestock Production Science,2001,70(1):15-29.
[7]VIRTANEN A I.Milk production of cows on proteinfree feed[J].Science,1966,153:1603-1614.
[8]邵广,苗树君,沈冰蕾.奶牛乳脂降低综合征的研究进展[J].草食家畜,2008(4):1-4.
[9]TYZNIK W,ALLEN N.The relation of roughage in-take to the fat content of the milk and the level of fatty acids in the rumen[J].Journal of Dairy Science,1951,34:493.
[10]BAUMAN D E,DAVIS C L,BUCHOLTZ H F.Propionate production in the rumen of cows fed either a control or high-grain,low-fiber diet[J].Journal of Dairy Science,1971,54(9):1282-1287.
[11]VAN SOEST P,ALLEN N.Studies on the relationships between rumen acids and fat metabolism of ruminants fed on restricted roughage diets[J].Journal of Dairy Science,1959,42(12):1977-1985.
[12]MCCLYMONT G L,VALLANCE S.Depression of blood glycerides and milk-fat synthesis by glucose infusion[J].Proceedings of the Nutrition Society,1962,21(2):xli-xlii.
[13]周美玲,张建刚,侯玉洁.奶牛低乳脂综合征的研究进展[J].中国饲料添加剂,2013(1):25-28.
[14]MACKLE T R,DWYER D A,INGVARTSEN K L,et al.Effects of insulin and amino acids on milk protein concentration and yield from dairy cows[J].Journal of Dairy Science,1999,82(7):1512-1524.
[15]FROBISH R A,DAVISC L.Theory involving propionate and vitamin B12 in the low-milk fat syndrome[J].Journal of Dairy Science,1977,60(2):268-273.
[16]CROOM W J,Jr,BAUMAN D E,DAVISC L.Methylmalonic acid in low-fat milk syndrome[J].Journal of Dairy Science,1981,64(4):649-654.
[17]DAVISC,BROWN R,PHILLIPSON A.Low-fat milk syndrome[C]//Proceedings of the 3rd international symposium.Cambridge:Oriel Press,1970.
[18]PENNINGTON J A,DAVIS C L.Effects of intraruminal and intra-abomasal additions of cod-liver oil on milk fat production in the cow[J].Journal of Dairy Science,1975,58(1):49-55.
[19]STERK A,JOHANSSON B E O,TAWEEL H Z H,et al.Effects of forage type,forage to concentrate ratio,and crushed linseed supplementation on milk fatty acid profile in lactating dairy cows[J].Journal of Dairy Science,2011,94(12):6078-6091.
[20]MAIA M R G,BESSA R J B,WALLACE R J.Is the trans-10 shift that sometimes occurs in the ruminal biohydrogenation of linoleic acid caused by low pH or starch?A rusitec study[C]//Proceedings of theⅪ th international symposium on ruminant physiology,Wageningen:Wageningen Academic Publishers,2009:276-277.
[21]PIPEROVA L S,TETER B B,BRUCKENTAL I,et al.Mammary lipogenic enzyme activity,trans fatty acids and conjugated linoleic acids are altered in lactating dairy cows fed a milk fat-depressing diet[J].The Journal of Nutrition,2000,130(10):2568-2574.
[22]ZENED A,ENJALBERT F,NICOT M C,et al.In vitro study of dietary factors affecting the biohydrogenation shift from trans-11 to trans-10 fatty acids in the rumen of dairy cows[J].Animal,2012,6(3):459-467.
[23]ZENED A,ENJALBERT F,NICOT M C,et al.Starch plus sunflower oil addition to the diet of dry dairy cows results in a trans-11 to trans-10 shift of biohydrogenation[J].Journal of Dairy Science,2013,96(1):451-459.
[24]SHINGFIELD K J,BERNARD L,LEROUX C,et al.Role of trans fatty acids in the nutritional regulation of mammary lipogenesis in ruminants[J].Animal,2010,4(7):1140-1166.
[25]梁松,王加启,卜登攀,等.奶牛乳脂降低综合症的生物氢化理论研究进展[J].中国畜牧兽医,2007,34(12):70-73.
[26]BAUMAN D E,HARVATINE K J,LOCK A L.Nutrigenomics,rumen-derived bioactive fatty acids,and the regulation of milk fat synthesis[J].Annual Review of Nutrition,2011,31(1):299-319.
[27]BAUMGARD L H,CORL B A,DWYER D A,et al.Identification of the conjugated linoleic acid isomer that inhibits milk fat synthesis[J].American Journal of Physiology:Regulatory,Integrative and Comparative Physiology,2000,278(1):179-184.
[28]HUSSEIN M,HARVATINE K H,WEERASINGHE W M PB,et al.Conjugated linoleic acid-induced milk fat depression in lactating ewes is accompanied by reduced expression of mammary genes involved in lipid synthesis[J].Journal of Dairy Science,2013,96(6):3825-3834.
[29]胡菡,王加启,李发弟,等.奶牛乳腺脂肪酸合成相关基因研究进展[J].生物技术通报,2009(10):34-38.
[30]BERNARD L,BONNET M,LEROUX C,et al.Effect of sunflower-seed oil and linseed oil on tissue lipid metabolism,gene expression,and milk fatty acid secretion in alpine goats fed maize silage-based diets[J].Journal of Dairy Science,2009,92(12):6083-6094.
[31]MACH N,JACOBS A A A,KRUIJT L,et al.Altera-tion of gene expression in mammary gland tissue of dairy cows in response to dietary unsaturated fatty acids[J].Animal,2011,5(8):1217-1230.
[32]BAUMGARD L H,MATITASHVILI E,CORL B A,et al.trans-10,cis-12 conjugated linoleic acid decreases lipogenic rates and expression of genes involved in milk lipid synthesis in dairy cows[J].Journal of Dairy Science,2002,85(9):2155-2163.
[33]HARVATINE K J,BAUMAN D E.SREBP1 and thyroid hormone responsive spot 14(S14)are involved in the regulation of bovine mammary lipid synthesis during diet-induced milk fat depression and treatment with CLA[J].The Journal of Nutrition,2006,136(10):2468-2474.
[34]LOOR J,UEDA K,FERLAY A,et al.Intestinal flow and digestibility of trans fatty acids and conjugated linoleic acids(CLA)in dairy cows fed a high-concentrate diet supplemented with fish oil,linseed oil,or sunflower oil[J].Animal Feed Science and Technology,2005,119(3/4):203-225.
[35]ROY A,FERLAY A,SHINGFIELD K J,et al.Examination of the persistency of milk fatty acid composition responses to plant oils in cows given different basal diets,with particular emphasis on trans-C18∶1 fatty acids and isomers of conjugated linoleic acid[J].Animal Science,2006,82(4):479-492.
[36]PETERSON D G,MATITASHVILI E A,BAUMAN D E.Diet-induced milk fat depression in dairy cows results in increased trans-10,cis-12 CLA in milk fat and coordinate suppression of mRNA abundance for mammary enzymes involved in milk fat synthesis[J].The Journal of Nutrition,2003,133(10):3098-3102.
[37]DRACKLEY JK,OVERTON T R,ORTIZ-GONZALEZ G,et al.Responses to increasing amounts of high-oleic sunflower fatty acids infused into the abomasum of lactating dairy cows[J].Journal of Dairy Science,2007,90(11):5165-5175.
[38]SHAO W,ESPENSHADE P J.Expanding roles for SREBP in metabolism[J].Cell Metabolism,2012,16(4):414-419.
[39]SHI H B,LUO J,ZHU J J,et al.PPARγ regulates genes involved in triacylglycerol synthesis and secretion in mammary gland epithelial cells of dairy goats[J].PPAR Research,2013(2013):310948.
[40]MA L,CORL B A.Transcriptional regulation of lipid synthesis in bovine mammary epithelial cells by sterol regulatory element binding protein-1[J].Journal of Dairy Science,2012,95(7):3743-3755.
[41]BIONAZ M,LOOR JJ.Gene networks driving bovine milk fat synthesis during the lactation cycle[J].BMC Genomics,2008,9(1):366.
[42]GAUTHIER K,BILLON C,BISSLER M,et al.Thyroid hormone receptorβ (TRβ)and liver X Receptor(LXR)regulate carbohydrate-response element-binding protein(ChREBP)expression in a tissue-selective manner[J].The Journal of Biological Chemistry,2010,285(36):28156-28163.
[43]ANDERSON SM,RUDOLPH M C,MCMANAMAN J L,et al.Secretory activation in the mammary gland:it’s not just about milk protein synthesis[J].Breast Cancer Research,2007,9(1):204-217.
[44]MCFADDEN J W,CORL B A.Activation of AMP-activated protein kinase(AMPK)inhibits fatty acid synthesis in bovine mammary epithelial cells[J].Biochemical and Biophysical Research Communications,2009,390(3):388-393.
[45]王强,江渝.肝X受体的研究进展[J].生理科学进展,2009,40(2):147-150.
[46]BOTOLIN D,WANG Y,CHRISTIAN B,et al.Docosahexaneoic acid(22∶6,n-3)regulates rat hepatocyte SREBP-1 nuclear abundance by Erk-and 26S proteasome-dependent pathways[J].Journal of Lipid Research,2006,47(1):181-192.
[47]BOBROVNIKOVA-MARJON E,HATZIVASSILIOU G,GRIGORIADOU C,et al.PERK-dependent regulation of lipogenesis during mouse mammary gland development and adipocyte differentiation[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(42):16314-16319.
[48]ZHOU J,FEBBRAIO M,WADA T,et al.Hepatic fatty acid transporter CD36 is a common target of LXR,PXR,and PPARγ in promoting steatosis[J].Gastroenterology,2008,134(2):556-567.
[49]ZEBELI Q,AMETAJ B N.Relationships between rumen lipopolysaccharide and mediators of inflammatory response with milk fat production and efficiency in dairy cows[J].Journal of Dairy Science,2009,92(8):3800-3809.
[50]张养东.脂多糖对泌乳奶牛乳脂肪和乳蛋白影响及其机理研究[D].博士学位论文.哈尔滨:东北农业大学,2011:5-6.

