裙带菜孢子多糖的体内抗氧化和免疫调节活性
奚 倩,赫 丹,韩 众 鑫,余 洋 定,孙 黎 明,赵 雅 娉,张 警 予,启 航
(1.大连工业大学 食品学院,辽宁 大连 116034;2.国家海洋食品工程技术研究中心,辽宁 大连 116034;3.丹东市振安区种子管理站,辽宁 丹东 118000;4.丹东市农产品质量检验监测中心,辽宁 丹东 118000)
0 引 言
裙带菜、海带等褐藻含有丰富的矿物质、维生素和膳食纤维[1],常被加工成保持身体健康的多功能食品,在东亚地区深受欢迎。我国是世界上藻类产量最多的国家。2012年,中国的藻类产量达到179.7万t(干重),其中大部分是裙带菜和海带[2]。裙带菜加工过程中,其孢子叶常被当作废弃物处理,造成了资源的极大浪费和环境污染。裙带菜和海带中的褐藻多糖硫酸酯具有抗肿瘤、抗菌、抗病毒和抗凝血等活性[3-6]。2003年 Katatsube等[7]提取了裙带菜孢子叶多糖,并研究了其抑制透明质酸酶的活性;2004年Lee等[1]发现裙带菜孢子叶多糖具有抗病毒活性;2007年Kim等[8]研究了韩国裙带菜孢子叶多糖的抗凝血活性;2010年You等[9]报道了裙带菜孢子叶多糖的体外抗氧化活性;Synytsya等[10]报道了韩国裙带菜孢子叶多糖的抗肿瘤活性。然而,裙带菜孢子叶多糖体内抗氧化及免疫调节活性,至今鲜见报道。多糖的抗肿瘤活性很可能是通过刺激免疫的机制实现的[11]。因此,本文建立研究裙带菜孢子叶多糖的体内免疫调节作用对于研究多糖的生理活性功能、开发相关的功能性产品具有一定的现实意义。
1 材料和方法
1.1 原料与试剂
裙带菜孢子叶多糖粗提液,大连水产养殖集团有限公司;昆明种小白鼠(18~22g,5~6周)、绵羊红细胞(SRBC),大连医科大学动物实验中心;RPMI 1640培养基、青霉素、链霉素、3-(4,5-二甲基-2-基)-2,5-二苯基溴(MTT)、二甲基亚砜(DMSO)、丝裂霉素C(MMC),Gibco Invitrogen;台盼蓝,Amresco公司(美国);香菇多糖,Sigma化学有限公司;丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒,南京建成生物工程研究所。其他试剂均为分析纯。
1.2 仪 器
PHS-3C型pH计,上海鹏顺科学仪器有限公司;LIM-2A低速离心机,北京医用离心机厂;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;SP-756紫外可见分光光度计,上海光谱仪器有限公司;Bio-Rad 680酶标仪,美国Bio-Rad公司;倒置显微镜,日本奥林巴斯公司;CO2培养箱,日本三洋公司。
1.3 方 法
1.3.1 裙带菜孢子叶多糖精制
裙带菜孢子叶多糖粗提液经乙醇沉淀,5 000g离心10min,收集沉淀,冻干保存备用。精制后裙带菜孢子叶多糖质量分数为34.25%。单糖组成为岩藻糖、半乳糖、甘露糖、葡萄糖和鼠李糖,含量最多的是岩藻糖[12]。
1.3.2 体内抗氧化能力检测
1.3.2.1 实验动物分组及处理
昆明种小白鼠72只(18~22g,雌性)随机分成6组,每组12只,饲养于空调温室内,温度(20±1)℃,光照12h,颗粒饲料喂养,自由饮水。
造模:小鼠随机分成的6组分别为空白对照组、阴性对照组、低剂量组、中剂量组、高剂量组和阳性对照组。除空白对照组每日灌胃等体积生理盐水外,其他5组连续腹腔注射D-半乳糖30d,剂量120mg/kg,注射量为0.01mL/g,1次/d,第31天刺眼眶取血,测定血清中MDA水平,确定氧化损伤动物模型建成。之后,除空白对照组外,其他5组分别按下述剂量连续灌胃给药:阴性对照组(生理盐水)、低剂量组(裙带菜孢子叶多糖50mg/kg)、中剂量组(裙带菜孢子叶多糖150mg/kg)、高剂量组(裙带菜孢子叶多糖300mg/kg)、阳性对照组(香菇多糖300mg/kg),给药量为0.01mL/g,1次/d。给药过程中继续腹腔注射D-半乳糖。连续灌胃45d后摘眼球取血,离心10min(4 000r/min)取血清;颈椎脱臼法处死小鼠,取肝脏和脑,并制备其匀浆液,进行相关抗氧化能力检测。
1.3.2.2 抗氧化能力检测
采用试剂盒检测血清、肝组织和脑组织匀浆液中SOD、MDA、GSH-Px。
1.3.3 体内免疫调节能力检测
1.3.3.1 实验动物分组及处理
昆明种小白鼠60只(18~22g,雌性)随机分成5组,每组12只,饲养于空调温室内,温度(20±1)℃,光照12h,颗粒饲料喂养,自由饮水。各组分别按下述剂量连续灌胃:阴性对照组(生理盐水)、低剂量组(裙带菜孢子叶多糖50mg/kg)、中剂量组(裙带菜孢子叶多糖150mg/kg)、高剂量组(裙带菜孢子叶多糖300mg/kg)、阳性对照组(香菇多糖300mg/kg),给药量为0.01mL/g,1次/d。连续灌胃45d,第46天进行免疫功能检测。
1.3.3.2 小鼠脾脏指数和胸腺指数
小鼠颈椎脱臼处死,称取小鼠体重、脾脏及胸腺质量。根据以下公式计算脾脏指数(mg/g)和胸腺指数(mg/g):

1.3.3.3 小鼠脾淋巴细胞的制备
用颈椎脱臼法处死小鼠并将其放入75%乙醇中浸泡5min消毒,在无菌条件下,剪开皮肤和腹壁,剥离脾脏并称重,在200目尼龙网上用塑料注射器芯研碎脾脏获取单细胞悬液,用0.83%氯化铵(NH4Cl)破碎红细胞,用Hank′s液洗3次,1 000r/min离心15min弃上清,加入完全培养基。用台盼蓝染色法检测细胞活性,保证活细胞数大于95%,并调节细胞浓度为5×106个/mL。
1.3.3.4 淋巴细胞增殖活性的测定
MTT比色法测定淋巴细胞增殖活性[13]。在96孔细胞培养板内,每孔添加已制备的各实验组的脾细胞悬液200μL,置于37℃5%CO2饱和湿度的培养箱中培养72h。在培养结束前4h,每孔中加入 MTT(5mg/mL)10μL。继续孵育4h。离心,弃上清,加入DMSO 150μL。用多孔酶标测定仪于570nm处测吸光值。
1.3.3.5 自然杀伤细胞(NK细胞)活性测定
无菌条件下取小鼠脾细胞,调整细胞数为5×106个/mL,作为效应细胞,取小鼠淋巴瘤细胞Yac-1(大连医科大学病理室赠送),调整细胞数为1×105个/mL,作为靶细胞。在96孔细胞培养板中,分别设效应细胞孔、效靶细胞孔和靶细胞孔3组,每孔加入相应细胞悬液,效靶细胞比例为50∶1,每孔总体积为200μL,不足部分以完全培养基补足。置于5%CO2饱和湿度的培养箱中37℃培养24h。根据CCK-8测定生存细胞活性[14]。NK细胞杀伤活性按公式(3)计算。

1.3.3.6 抗体生成水平的测定
根据Gan等[15]方法检测血清中SRBC抗体,0.2mL 2%SRBC在体内实验结束前5d对小鼠腹腔注射,经5d免疫后,从小鼠眼眶取血,分离血清。依次加入2%GGVB缓冲溶液稀释的SRBC 100μL、50倍稀释的补体100μL、10倍稀释的小鼠血清10μL,混匀后,37℃恒温0.5h,置入冰浴终止反应,2 500r/min离心15min,取上清,于波长414nm测吸光值。
1.4 统计学方法
采用统计学软件SPSS15.0对各组数据进行单因素方差分析(One-way AVOVA),数据用(平均值±标准偏差)(M±SD)表示。p<0.05表示与对照组比较有显著性差异(具有统计学意义),p<0.01表示差异极其显著。
2 结果与讨论
2.1 裙带菜孢子叶多糖对小鼠不同组织的氧化损伤的影响
MDA是氧自由基损伤组织或细胞导致脂质过氧化的最重要的产物之一。SOD能催化清除超氧阴离子自由基的反应,使生物体免受超氧阴离子自由基的损伤。GSH-Px是机体内广泛存在的一种重要的过氧化物分解酶,它特异的催化还原型谷胱甘肽对过氧化氢的还原反应,使有毒的过氧化物还原成无毒的羟基化合物,同时促进过氧化氢的分解。MDA水平、SOD和GSH-Px的活性可以表征机体的氧化损伤。
本文考察了裙带菜孢子叶多糖对氧化损伤小鼠体内 MDA水平、SOD和GSH-Px活力的影响。如表1所示,注射D-半乳糖后,模型组中小鼠血清和脑组织中的MDA水平极其显著高于阴性对照组(p<0.01),SOD和GSH-Px活力显著低于阴性对照组(p<0.01,p<0.05),说明小鼠氧化损伤模型建成。此时小鼠机体抗氧化功能显著降低,自由基清除能力减弱。与模型组相比,各剂量裙带菜孢子叶多糖组小鼠的血清和脑组织中MDA水平极其显著下降(p<0.01),并且高剂量组的MDA水平与空白对照组小鼠接近;各剂量裙带菜孢子叶多糖组小鼠的血清和脑组织中的SOD活力和GSH-Px活力都极其显著提高(p<0.01)。以上结果表明,裙带菜孢子叶多糖可以提高氧化损伤小鼠抗氧化酶活力,降低MDA含量,恢复机体抗氧化能力。

表1 裙带菜孢子叶多糖对氧化损伤小鼠血液和脑组织中MDA水平、SOD和GSH-Px活力的影响Tab.1 Effects of PSU on MDA level,SOD and GSH-Px in tissues of oxidative-damaged mice
2008年 Wang等[16]和 Ye等[17]报道褐藻多糖具有清除自由基的能力。此报道为裙带菜孢子叶多糖具有较好的体内抗氧化活性提供了支撑。
2.2 裙带菜孢子叶多糖对小鼠免疫器官的影响
免疫器官(脾脏和胸腺)的相对质量是非特异性免疫功能的重要参数。如表2所示,与阴性对照组相比,各剂量的裙带菜孢子叶多糖组中小鼠的脾脏和胸腺指数极其显著提高(p<0.01)。并且高剂量裙带菜孢子叶多糖组的脾脏指数和胸腺指数明显高于低剂量组。
2.3 裙带菜孢子叶多糖对细胞免疫功能和抗体生成的影响
淋巴细胞增殖是一种广泛使用的反映免疫应答能力的检测方法。如表3所示,中、高剂量裙带菜孢子叶多糖组小鼠的淋巴细胞增殖能力显著提高(p<0.05,p<0.01)。

表2 裙带菜孢子叶多糖对小鼠脾脏和胸腺指数的影响Tab.2 Effect of the PSU on spleen and thymus indices of mice
NK细胞被认为是非特异性免疫防御系统的重要组成部分。各剂量裙带菜孢子叶多糖组的NK细胞的活性极其显著增强(p<0.01)(表3)。这些结果与 Maruyama等[18-19]在裙带菜孢子叶中提取的褐藻多糖硫酸酯提高NK细胞的细胞溶解活性的研究报告相一致。另外,中高剂量裙带菜孢子叶多糖组中小鼠血清中的抗体生成水平极其显著提高(p<0.01)。以上结果表明,裙带菜孢子叶多糖具有显著的体内免疫调节活性。
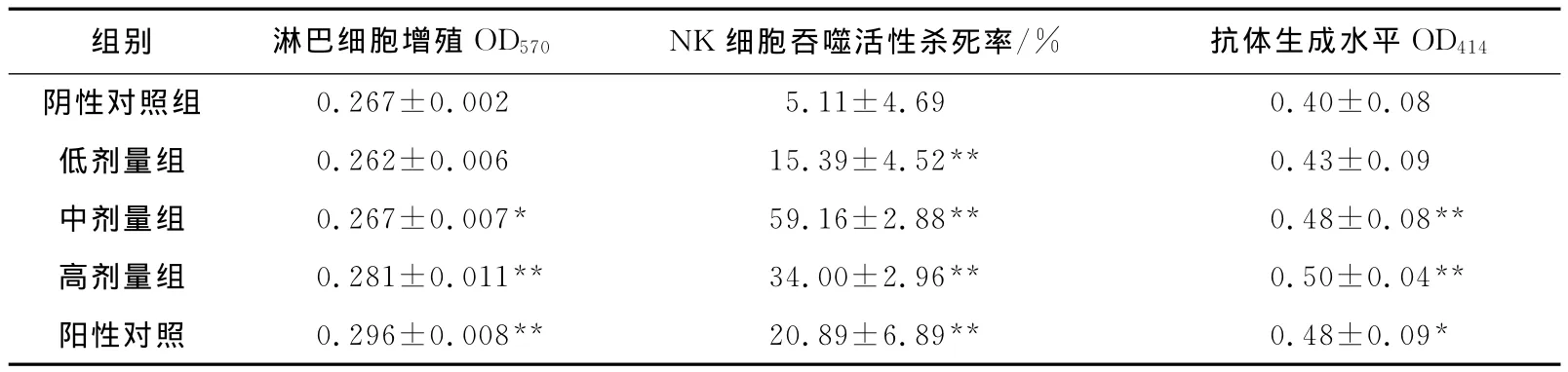
表3 裙带菜孢子叶多糖对小鼠淋巴细胞增殖、NK细胞杀伤活性和抗体生成能力的影响Tab.3 Effects of PSU on the lymphocytes proliferation,NK cell phagocytosis activities and antibody production in serum of mice
3 结 论
(1)裙带菜孢子叶多糖能够显著降低血清和脑组织中MDA水平,提高SOD活力和GSH-Px活力,说明裙带菜孢子叶多糖具有良好的体内抗氧化活性。
(2)裙带菜孢子叶多糖显著提高了小鼠的脾脏和胸腺指数,促进淋巴细胞增殖,增强NK细胞的杀伤活性,并提高小鼠血清中的抗体生成水平,说明裙带菜孢子叶多糖具有良好的体内免疫调节活性。
[1]LEE J,HAYASHI K,HASHIMOTO M.et al.Novel antiviral fucoidan from sporophyll ofUndaria pinnatifida(Mekabu)[J].Chemical and Pharmaceutical Bulletin,2004,52(9):1091-1094.
[2]农业部渔业局.2013年中国渔业统计年鉴[M].北京:中国农业出版社,2013:23.
[3]SHIBATA H,IIMURO M,UCHIDA N,et al.Preventive effects of cladosiphon fucoidan against Helicobacter pylori in Mongolian gerbils[J].Helicobacter,2003,8(1):59-65.[4]SUGAWARA I,ITOH W,KIMURA S,et al.Further characterization of sulfated homopolysaccharides as anti-HIV agents[J].Experientia,1989,45(10):996-998.
[5]SCHAEFFER D,KRYLOV V.Anti-HIV activity of extracts and compounds from algae and cyanobacteria[J].Ecotoxicology and Environmental Safety,2000,45(3):s208-s227.
[6]SOEDA S,SAKAGUCHI S,SHIMENO H,et al.Fibrinolytic and anticoagulant activities of highly sulfated fucoidan[J].Biochemical Pharmacology,1992,43(8):1853-1858.
[7]KATATSUBE T,YAMASAKI Y,IWAMOTO M,et al.Hyaluronidase-inhibiting polysaccharide isolated and purified from hot water extract of sporophyll ofUndariapinnatifida[J].Food Science and Technology Research,2003,9(1):25-29.
[8]KIM W,KIM S,KIM H,et al.Purification and anticoagulant activity of a fucoidan from KoreanUndariapinnatifidasporophyll[J].Algae,2007,22(3):247-252.
[9]YOU S,YANG C,LEE H,et al.Molecular characteristics of partially hydrolyzed fucoidans from sporophyll ofUndariaPinnatifidaand their in vitro anticancer activity[J].Food Chemistry,2010,119(2):554-559.
[10]SYNYTSYA A,KIM W,KIM S,et al.Structure and antitumour activity of fucoidan isolated from sporophyll of Korean brown seaweedUndariapinnatifida[J].Carbohydrate Polymers,2010,81(1):41-48.
[11]MARUYAMA H,TANAKA M,HASHIMOTO M,et al.The suppressive effect of Mekabu fucoidan on an attachment ofCryptosporidiumparvumoocysts to the intestinal epithelial cells in neonatal mice[J].Life Science,2007,80(8):775-781.
[12]QI Hang,YU Yangding,SUN Liming,et al.Puri fication and partial bioactivityinvitroof polysaccharides from sporophyll ofUndariapinnatifida[J].Journal of Food and Agriculture Environment,2012,10(3/4):197-201.
[13]MOSMANN T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J].Journal of Immunological Methods,1983,65(1/2):55-63.
[14]ZHOU Gefei,SHENG Wenxu,YAO Wenhong,et al.Effect of low molecularλ-carrageenan fromChondrusocellatuson antitumor H-22activity of 5-Fu[J].Pharmarlogical Research,2006,53(2):129-134.
[15]GAN Lu,ZHANG Shenghua,YANG Xiangliang,et al.Immunomodulation and antitumor activity by a polysaccharide-protein complex fromLyciumbarbarum[J].International Immunopharmacology,2004,4(4):563-569.
[16]WANG J,ZHANG Q,ZHANG Z,et al.Antioxidant activity of sulfated polysaccharide fractions extracted fromLaminariajaponica[J].International Journal of Biological Macromolecules,2008,42(2):127-132.
[17]YE Hong,WANG Kegi,ZHOU Chunhong,et al.Purification,antitumor and antioxidant activitiesin vitroof polysaccharides from the brown seaweedsargassumpallidum[J].Food Chemistry,2008,111(2):428-432.
[18]MARUYAMA H,TAMAUCHI H,HASHIMOTO M,et al.Suppression of Th2immune responses by Mekabu fucoidan fromUndariapinnatifidasporophylls[J].International Archives of Allergy and Immunology,2005,137:289-294.
[19]MARUYAMA H,TAMAUCHI H,HASHIMOTO M,et al.Antitumor activity and immune response of Mekabu fucoidan extracted from Sporophyll ofUndariapinnatifida[J].In Vivo,2003,17(3):245-249.

